ADA Scientific Sessions 2012: Wegmarken für die antidiabetische Therapie

Mit der Erstpräsentation der ORIGIN-Studie konnte die Jahrestagung der US-amerikanischen Diabetesgesellschaft heuer seit längerem wieder mit einem echten Highlight aufwarten. Daneben wurde eine Reihe von Vergleichsstudien präsentiert, die wichtige Anhaltspunkte für die klinische Positionierung der immer zahlreicher verfügbaren Antidiabetika liefern, wobei insbesondere inkretinbasierte Therapeutika und die neue Klasse der SGLT2-Inhibitoren stark im Fokus standen. Auch die aktuellen Kontroversen in der Diabetologie – von den Zielwerten der pharmakologischen Intervention bis zu den Kausalzusammenhängen zwischen Diabetes, Diabetestherapie und Tumorrisiko wurden in Philadelphia fortgeführt.
Die Bedeutung der Outcome Reduction With an Initial Glargine Intervention (ORIGIN) Study (NCT00069784) liegt darin, dass trotz jahrzehntelanger Verwendung von Insulin bislang nicht wirklich klar ist, ob die unter Insulintherapie erreichte Blutzuckersenkung auch eine Reduktion der makrovaskulären Morbidität und Mortalität mit sich bringt oder ob unerwünschte Therapieeffekte (und hier vor allem Gewichtszunahme und Hypoglykämien) in Summe die Prognose der Patienten sogar verschlechtern.
Um diese Frage zu beantworten, wurden ab 2003 weltweit insgesamt 12.537 Personen mit gestörter Glukosetoleranz (IGT) oder Typ-2-Diabetes und erhöhtem kardiovaskulärem Risiko (vorangegangenes kardiovaskuläres Ereignis, manifeste koronare, zerebrale oder periphere Gefäßerkrankung oder Albuminurie) rekrutiert. Die Studienteilnehmer waren im Schnitt 64 ± 8 Jahre alt, hatten einen Body Mass Index (BMI) von 30 ± 5 kg/m2 und stammten etwa zur Hälfte aus Europa; in Österreich waren 9 Zentren an der Studie beteiligt. Die Probanden erhielten randomisiert entweder Insulin glargin (mit dem Titrationsziel eines Nüchternblutzuckers von ≤ 95 mg/dl) oder eine orale „Standardtherapie“.
Insulin hinsichtlich Herz-Kreislauf-Risiko „neutral“
Das Ergebnis nach median 6,2 Jahren (ORIGIN Trial Investigators, New Engl J Med 2012): Die primären Kompositendpunkte (nichtfataler Myokardinfarkt/Insult oder kardiovaskulärer Tod; die Genannten plus koronare Revaskularisierung oder Hospitalisierung wegen Herzinsuffizienz) traten unter Insulintherapie mit fast identer Häufigkeit auf wie in der Kontrollgruppe (Abb. 1). 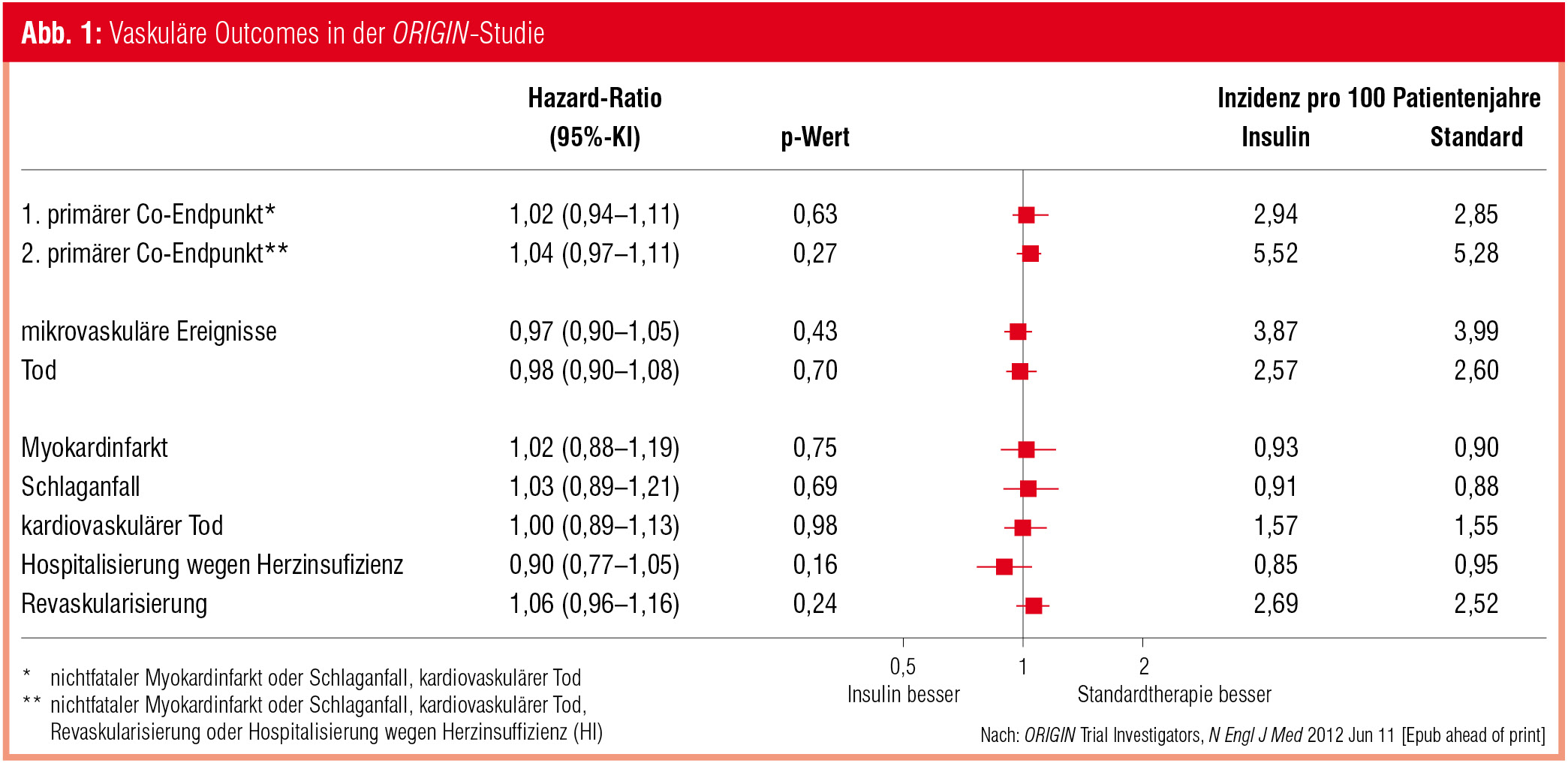 Einzeln ausgewertete makrovaskuläre Endpunkte, mikrovaskuläre Ereignisse und Gesamtmortalität waren ebenfalls nicht signifikant reduziert. Allerdings traten in der Insulingruppe bei Teilnehmern mit IGT zu Studienbeginn deutlich weniger (–28 %) neue Diabetesfälle auf als in der Vergleichsgruppe. Hypoglykämien waren unter Insulintherapie erwartungsgemäß häufiger, die Raten schwerer Ereignisse waren mit 1,0 vs. 0,3 pro 100 Patientenjahren aber relativ niedrig. Die Gewichtsdifferenz war mit 2,1 kg nach 6 Jahren ebenfalls gering.
Einzeln ausgewertete makrovaskuläre Endpunkte, mikrovaskuläre Ereignisse und Gesamtmortalität waren ebenfalls nicht signifikant reduziert. Allerdings traten in der Insulingruppe bei Teilnehmern mit IGT zu Studienbeginn deutlich weniger (–28 %) neue Diabetesfälle auf als in der Vergleichsgruppe. Hypoglykämien waren unter Insulintherapie erwartungsgemäß häufiger, die Raten schwerer Ereignisse waren mit 1,0 vs. 0,3 pro 100 Patientenjahren aber relativ niedrig. Die Gewichtsdifferenz war mit 2,1 kg nach 6 Jahren ebenfalls gering.
Zusätzlich zum Vergleich von Insulin glargin und oraler Standardtherapie sah das 2×2-faktorielle Design der ORIGIN-Studie die Verabreichung von Omega-3-Fettsäuren (1 g/Tag als Säureethylester in Kapselform) versus Placebo vor (ORIGIN Trial Investigators, New Engl J Med 2012). Mit Ausnahme einer leichten Triglyzeridsenkung (–15 mg/dl) hatte dies keine Auswirkung auf den Stoffwechsel und ebenso nicht auf die primären oder sekundären vaskulären Endpunkte der Studie (inklusive fataler Arrhythmie).
Wesentlich für die Einordnung der Outcomes im Insulinarm der ORIGIN-Studie ist der Umstand, dass die Studienteilnehmer mit einem medianen HbA1c von 6,4 % (Interquartilbereich: 5,8–7,1 %) in die Studie eingeschlossen wurden und dass die HbA1c-Werte in der Insulingruppe gegen Studienende nicht viel niedriger waren als in der Kontrollgruppe (6,2 % vs. 6,5 %). Auch lassen sich die bei Patienten mit sehr kurzer Diabetesdauer bzw. Prädiabetes und entsprechend niedrigen Insulindosen (0,31–0,41 I. E./kg/d) beobachteten Effekte nur bedingt auf Patienten übertragen, die nach heutiger Empfehlungslage typischerweise mit Insulin behandelt werden. Zu erwähnen ist schließlich, dass die Studie aufgrund der unerwartet niedrigen Ereignisraten (als Folge der Hintergrundmedikation mit Statinen, Antihypertensiva und Thrombozytenaggregationshemmern) zweimal verlängert werden musste.
Krebsrisiko durch Glargin: vorsichtige Entwarnung
Für die weitere Stellung von Insulin glargin entscheidender ist aber der Befund der ORIGIN-Studie, dass die Inzidenz von Tumorerkrankungen (insbesondere von Brustkrebs) und die Tumormortalität bei den mit Insulin glargin behandelten Teilnehmern gegenüber der Vergleichsgruppe definitiv nicht erhöht waren. Bestätigt wird dies durch drei Observationsstudien, die im Zuge der Debatte um die Sicherheit von Insulin glargin (siehe DIABETES FORUM 4/2009) im Jahr 2009 initiiert wurden und in Philadelphia Gegenstand einer eigenen Sitzung („Cancer Link with Insulin – Data from the U.S. and Northern Europe“) waren:
 Die von Peter Boyle (Lyon, Frankreich) präsentierte Northern European Database Study wertete Patientendaten aus Dänemark, Schweden, Norwegen, Finnland und Schottland aus und repräsentiert eine Insulinexpositionszeit von insgesamt 1,5 Millionen Patientenjahren. Glargin-Patienten wurden durchschnittlich 3,1 Jahre nachverfolgt. Die Analyse ergab für Glargin gegenüber anderen Basalinsulinen kein erhöhtes Krebsrisiko – weder insgesamt, noch für einzelne Entitäten, darunter Brustkrebs bei Frauen (Tab. 1). Interessanterweise hatten auch die Kombination mit Metformin und weitere mögliche Confounders wie BMI oder Rauchen in dieser Studie keinen nachweisbaren Effekt. Boyle verglich die Ergebnisse mit den schon bisher verfügbaren Auswertungen und schlussfolgerte, dass – unter Berücksichtigung der für Registeranalysen geltenden Einschränkungen – eine beeindruckende Datenfülle (21 Analysen, 1 Million Diabetespatienten, 3 Millionen Personenjahre) für die Sicherheit von Insulin glargin spreche (Tab. 1). Um einen Kausalzusammenhang zwischen antidiabetischen Therapien und vermehrten Krebserkrankungen etablieren zu können, seien aber auch deutlich längere Follow-up-Zeiten nötig.
Die von Peter Boyle (Lyon, Frankreich) präsentierte Northern European Database Study wertete Patientendaten aus Dänemark, Schweden, Norwegen, Finnland und Schottland aus und repräsentiert eine Insulinexpositionszeit von insgesamt 1,5 Millionen Patientenjahren. Glargin-Patienten wurden durchschnittlich 3,1 Jahre nachverfolgt. Die Analyse ergab für Glargin gegenüber anderen Basalinsulinen kein erhöhtes Krebsrisiko – weder insgesamt, noch für einzelne Entitäten, darunter Brustkrebs bei Frauen (Tab. 1). Interessanterweise hatten auch die Kombination mit Metformin und weitere mögliche Confounders wie BMI oder Rauchen in dieser Studie keinen nachweisbaren Effekt. Boyle verglich die Ergebnisse mit den schon bisher verfügbaren Auswertungen und schlussfolgerte, dass – unter Berücksichtigung der für Registeranalysen geltenden Einschränkungen – eine beeindruckende Datenfülle (21 Analysen, 1 Million Diabetespatienten, 3 Millionen Personenjahre) für die Sicherheit von Insulin glargin spreche (Tab. 1). Um einen Kausalzusammenhang zwischen antidiabetischen Therapien und vermehrten Krebserkrankungen etablieren zu können, seien aber auch deutlich längere Follow-up-Zeiten nötig.
Til Sturmer (Chapel Hill, USA) präsentierte Versicherungsdaten US-amerikanischer Patienten, die durchschnittlich etwas länger als ein Jahr mit Insulin glargin (n = 9.147) bzw. NPH-Insulin (n = 43.306) behandelt wurden. Auch diese Analyse ergab keinerlei Hinweise auf vermehrte Brust-, Prostata- oder Kolorektalkarzinome. Sturmer merkte an, dass die Aussagekraft der Ergebnisse durch die kurze Beobachtungsdauer und die Nichtberücksichtigung von BMI und anderen Confounders limitiert wird.
Dass Kohortenstudien mitunter schwierig zu interpretierende Ergebnisse liefern, illustrierte Laurel A. Habel (Oakland, USA) anhand einer Auswertung des kalifornischen Kaiser Permanente Registry, das Patienten unter Therapie mit Insulin glargin (n = 27.418) und NPH-Insulin (n = 11.757) retrospektiv verfolgte. Im Untersuchungszeitraum von 2,3–3,6 Jahren war das Gesamtkrebsrisiko zwischen den Gruppen vergleichbar. In der Gruppe der Patienten, die neu auf Insulin glargin (n = 6.548) oder NPH-Insulin (n = 39.708) eingestellt wurden, ergab die Analyse ein statistisch grenzwertiges Signal für vermehrte Mammakarzinome unter Glargin (HR = 1,6; 95%-KI: 1,0–2,8). Dagegen zeigten Patientinnen, die von NPH-Insulin auf Glargin wechselten, auch bei längerer Glargin-Exposition kein erhöhtes Brustkrebsrisiko.
Neue Einblicke in den UKPDS „Legacy Effekt“
Marcus Lind (Lund, Schweden) und Mitarbeiter untersuchten anhand von 3.849 Teilnehmern der UKPDS, welche Faktoren längerfristig für die Lebenserwartung von Patienten mit Typ-2-Diabetes von Bedeutung sind. Nach den im Rahmen der „Late-breaking Abstract Session“ präsentierten Daten war die Überlebensprognose der Patienten nach Abschluss der UKPDS nicht primär von der Zuteilung zu einer bestimmten Therapiegruppe abhängig, sondern von Alter, Geschlecht und erzielten HbA1c-Werten. Die Autoren schlussfolgerten, dass die wesentlichen Effekte der verbesserten Diabeteskontrolle mit einer Zeitverzögerung von 5–10 Jahren zum Tragen kommen und durch eine stärkere HbA1c-Senkung bedingt sind (Holman et al., New Engl J Med 2008) – eine weitere Bestätigung für die These, dass intensivierte antidiabetische Therapien möglichst früh im Verlauf des Typ-2-Diabetes einsetzen müssen, um einen maximalen Benefit zu erzielen (Schernthaner, Wien Med Wochenschr 2009).
Eine Auswertung des nationalen schwedischen Diabetesregisters durch Karin Eeg-Olofsson et al. mit Daten von 18.000 Patienten mit Typ-2-Diabetes ohne manifeste Herz-Kreislauf-Erkrankung ergab, dass bei Patienten, deren HbA1c-Werte sich in den Jahren 2004 bis 2009 verbesserten (von 7,8 % auf 7,0 %), deutlich weniger kardiovaskuläre Komplikationen (–37 %) und Todesfälle (–45 %) auftraten als bei jenen, deren HbA1c im gleichen Zeitraum angestiegen war (von 7,7 % auf 8,3 %). Vor dem Hintergrund prospektiver Outcome-Studien (UKPDS, ACCORD, ADVANCE) liegt aber auch für die Autoren die Vermutung nahe, dass die unterschiedlichen Ereignisraten im Diabetesregister nicht so sehr als Erfolg der Diabetestherapie, sondern als Ausdruck unterschiedlicher Patientenkollektive zu werten sind – und als weiterer Hinweis darauf, dass vor allem jene Patienten ein hohes kardiovaskuläres Risiko aufweisen, die ihre HbA1c-Ziele nicht oder nur unter besonderen Schwierigkeiten erreichen.
Aktuelle „Head-to-head trials“ – was tun nach Metformin?
Während Metformin als antihyperglykämische First-Line-Medikation bei Typ-2-Diabetes weithin unumstritten ist (Clodi et al., Wien Klin Wochenschr 2009; Inzucchi et al., Diabetologia 2012), ist die Frage der Therapieerweiterung nach Versagen der Metformin-Therapie alles andere als geklärt (Madsbad, Lancet 2012). Mit Blick auf die phänotypische Heterogenität der Patienten, nicht zuletzt aber aufgrund der begrenzten Datenlage zu den verschiedenen Wirkprinzipien, listet das rezente Positionspapier der ADA und der European Association of the Study of Diabetes (EASD) Sulfonylharnstoffe, Glitazone (Pioglitazon), DPP-4-Inhibitoren, GLP-1-Rezeptoragonisten und Insulin als prinzipiell gleichrangige Optionen, die im individuellen Fall nach Maßgabe von Effektivität, Hypoglykämierisiko, Gewichtseffekten, Nebenwirkungen und Kosten zum Einsatz gebracht werden sollen (Inzucchi et al., Diabetologia 2012). In den vergangenen Jahren wurden zunehmend vor allem neuere Antidiabetika mit etablierten Substanzen in Studien verglichen. In Philadelphia wurden weitere „Head-to-head trials“ vorgestellt, zwei davon – jeweils mit österreichischer Beteiligung – im Rahmen des renommieren „Joint ADA/The Lancet Symposium“.
Insulin glargin vs. Sitagliptin (plus Metformin). In der Evaluation of Insulin Glargine Versus Sitagliptin In Insulin-Naive Patients (EASIE) Study (Aschner et al., Lancet 2012) wurden 515 Patienten (Alter: 37–70 Jahre; Diabetesdauer: 2–8 Jahre; BMI: 25–45 kg/m2) mit inadäquater HbA1c-Kontrolle (7–11 %) unter Metformin-Monotherapie offen randomisiert mit Sitagliptin (100 mg/Tag) oder mit Insulin glargin behandelt; das Insulin wurde mit einem Ziel eines Nüchternblutzuckers von 70–100 mg/dl titriert. Im Verlauf von 24 Wochen sanken die HbA1c-Werte mit Insulin glargin um 1,7 Prozentpunkte und mit Sitagliptin um 1,1 Prozentpunkte ab (p < 0,0001). Damit erreichten unter Insulintherapie deutlich mehr Patienten (68 % vs. 48 %) das HbA1c-Ziel von < 7 %. Erwartungsgemäß waren auch symptomatische Hypoglykämien in der Insulingruppe erheblich häufiger als unter inkretinbasierter Therapie (4,2 vs. 0,5 Ereignisse pro Patient und Jahr; p < 0,0001). Schwere Hypoglykämien betrafen 3 bzw. 1 Patienten, schwerwiegende Nebenwirkungen traten insgesamt bei 6 % vs. 3 % (Glargin/Sitagliptin) der Patienten auf.
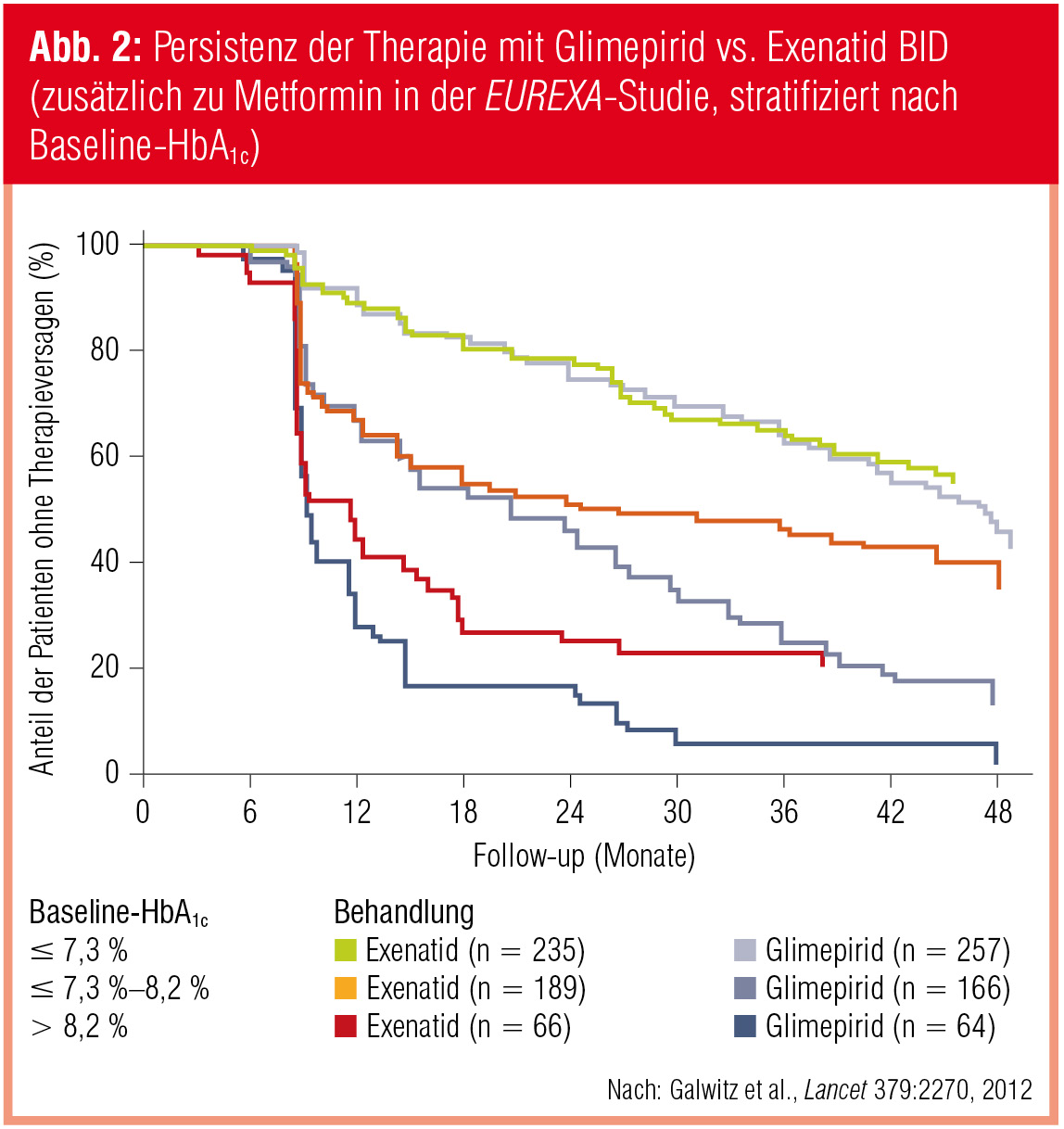 Exenatid BID vs. Glimepirid (plus Metformin). Die EUREXA-Studie (Gallwitz et al., Lancet 2012) inkludierte ein ähnliches Kollektiv von Patienten (Alter: 18–85 Jahre; Diabetesdauer: 5,6 ± 4,5 Jahre; BMI: 32,5 ± 4,1 kg/m2; HbA1c unter Metformin-Monotherapie: 7,4 ± 0,7 %) und verglich Glimepirid mit Exenatid (jeweils zweimal täglich). Primäres Studienziel war in diesem Fall die Zeit bis zum neuerlichen Therapieversagen (definiert als HbA1c-Anstieg auf > 9 % innerhalb der ersten 3 Monate bzw. zweimalig konsekutiv auf > 7 % nach 6 Monaten). In der Intention-to-treat-Population erreichten mit Glimepirid behandelte Patienten (n = 487) den primären Endpunkt median um 38 Wochen früher als Patienten der Exenatid-Gruppe (n = 490). Im Beobachtungszeitraum von 48 Monaten kam es bei 54 % (Glimepirid) vs. 41 % der Patienten (Exenatid) zum Versagen der Add-on-Therapie (HR = 0,784; p = 0,002). Besonders aufschlussreich ist die Stratifizierung der Patienten nach der Qualität der Stoffwechselkontrolle zu Studienbeginn: So schnitt Glimepirid bei HbA1c-Ausgangswerten bis 7,3 % genauso gut ab wie Exenatid, während das GLP-1-Analogon bei höheren Baseline-Werten deutlich länger eine adäquate Blutzuckerkontrolle ermöglichte als der Sulfonylharnstoff (Abb. 2). Gewichtsverläufe (Glimepirid: +1,15 kg; Exenatid: –3,32 kg), Hypoglykämieraten (67 % der Glimepirid-Patienten vs. 36 % der Exenatid-Patienten berichteten über zumindest eine Episode) und Nebenwirkungshäufigkeiten entsprechen den bekannten Profilen der Wirksubstanzen.
Exenatid BID vs. Glimepirid (plus Metformin). Die EUREXA-Studie (Gallwitz et al., Lancet 2012) inkludierte ein ähnliches Kollektiv von Patienten (Alter: 18–85 Jahre; Diabetesdauer: 5,6 ± 4,5 Jahre; BMI: 32,5 ± 4,1 kg/m2; HbA1c unter Metformin-Monotherapie: 7,4 ± 0,7 %) und verglich Glimepirid mit Exenatid (jeweils zweimal täglich). Primäres Studienziel war in diesem Fall die Zeit bis zum neuerlichen Therapieversagen (definiert als HbA1c-Anstieg auf > 9 % innerhalb der ersten 3 Monate bzw. zweimalig konsekutiv auf > 7 % nach 6 Monaten). In der Intention-to-treat-Population erreichten mit Glimepirid behandelte Patienten (n = 487) den primären Endpunkt median um 38 Wochen früher als Patienten der Exenatid-Gruppe (n = 490). Im Beobachtungszeitraum von 48 Monaten kam es bei 54 % (Glimepirid) vs. 41 % der Patienten (Exenatid) zum Versagen der Add-on-Therapie (HR = 0,784; p = 0,002). Besonders aufschlussreich ist die Stratifizierung der Patienten nach der Qualität der Stoffwechselkontrolle zu Studienbeginn: So schnitt Glimepirid bei HbA1c-Ausgangswerten bis 7,3 % genauso gut ab wie Exenatid, während das GLP-1-Analogon bei höheren Baseline-Werten deutlich länger eine adäquate Blutzuckerkontrolle ermöglichte als der Sulfonylharnstoff (Abb. 2). Gewichtsverläufe (Glimepirid: +1,15 kg; Exenatid: –3,32 kg), Hypoglykämieraten (67 % der Glimepirid-Patienten vs. 36 % der Exenatid-Patienten berichteten über zumindest eine Episode) und Nebenwirkungshäufigkeiten entsprechen den bekannten Profilen der Wirksubstanzen.
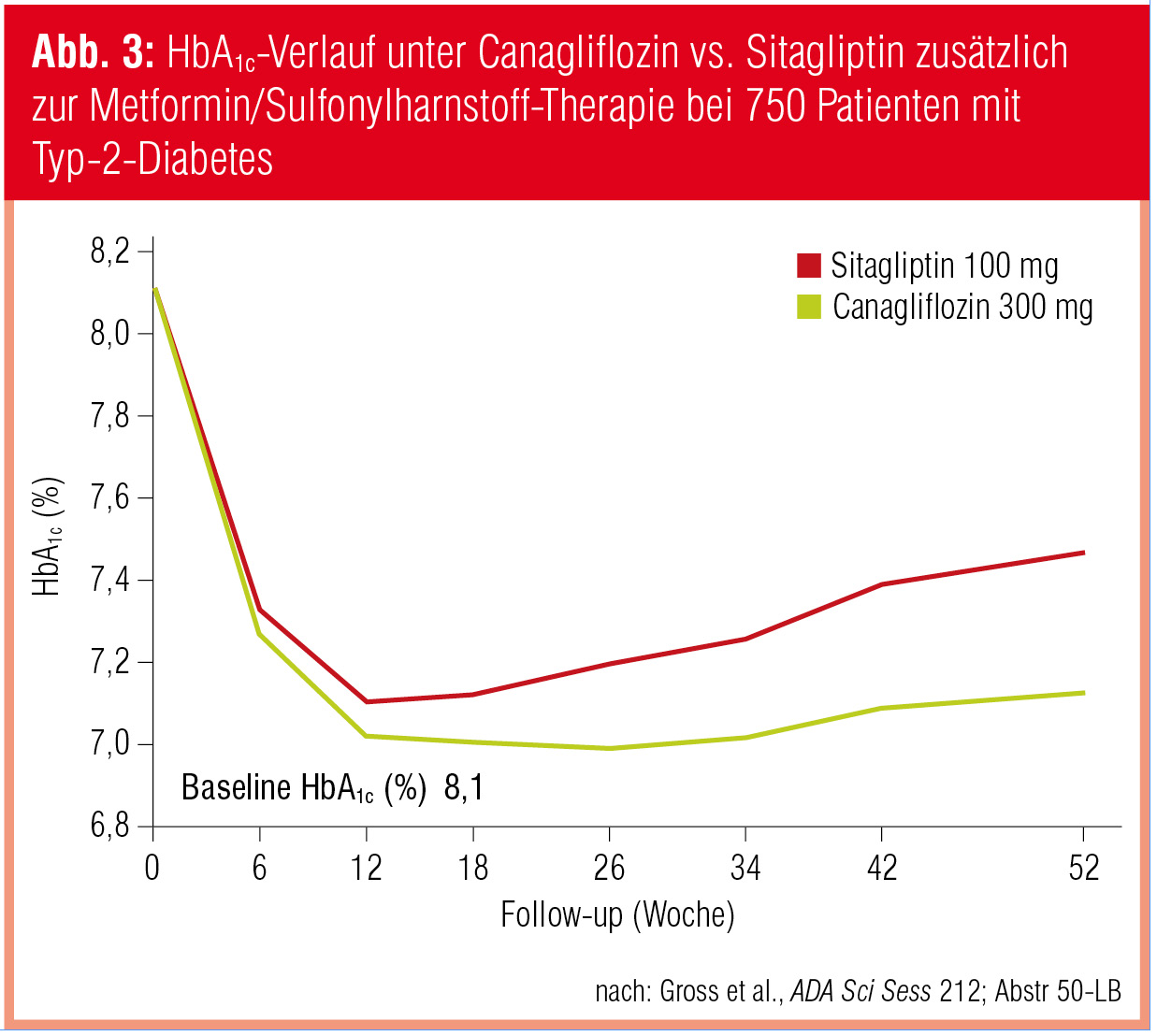 Canagliflozin vs. Sitagliptin (plus Metformin/Sulfonylharnstoff). Als Beispiel einer Head-to-Head-Studie mit der neuen Klasse der SGLT2-Inhibitoren präsentierten Jorge L. Gross und Mitarbeiter (Abstr 50-LB) – wiederum mit österreichischer Beteiligung – eine Phase-III-Studie mit 755 inadäquat eingestellten Patienten (Alter: 57 Jahre; BMI: 32 kg/m2; Baseline-HbA1c: 8,1 %) unter Vortherapie mit Metformin und einem Sulfonylharnstoff. Die Patienten erhielten randomisiert und doppelblind Canagliflozin (300 mg/Tag) oder Sitagliptin (100 mg/Tag). Im Verlauf von 52 Wochen reduzierte der SGLT2-Hemmer Nüchternblutzucker und HbA1c (Abb. 3) signifikant stärker und nachhaltiger als der DPP-4-Hemmer und senkte zudem das Körpergewicht um 2,5 kg ab, während Sitagliptin den bekannt neutralen Gewichtsverlauf (+0,3 kg) zeigte. Parallel dazu sanken die Blutdruckwerte in der Canagliflozin-Gruppe um durchschnittlich 7/3 mmHg. Allerdings kam es unter Canagliflozin auch zu einem leichten Anstieg der Lipidwerte (LDL-Cholesterin: +11,7 mg/dl; HDL-Cholesterin: +7,6 mmHg).
Canagliflozin vs. Sitagliptin (plus Metformin/Sulfonylharnstoff). Als Beispiel einer Head-to-Head-Studie mit der neuen Klasse der SGLT2-Inhibitoren präsentierten Jorge L. Gross und Mitarbeiter (Abstr 50-LB) – wiederum mit österreichischer Beteiligung – eine Phase-III-Studie mit 755 inadäquat eingestellten Patienten (Alter: 57 Jahre; BMI: 32 kg/m2; Baseline-HbA1c: 8,1 %) unter Vortherapie mit Metformin und einem Sulfonylharnstoff. Die Patienten erhielten randomisiert und doppelblind Canagliflozin (300 mg/Tag) oder Sitagliptin (100 mg/Tag). Im Verlauf von 52 Wochen reduzierte der SGLT2-Hemmer Nüchternblutzucker und HbA1c (Abb. 3) signifikant stärker und nachhaltiger als der DPP-4-Hemmer und senkte zudem das Körpergewicht um 2,5 kg ab, während Sitagliptin den bekannt neutralen Gewichtsverlauf (+0,3 kg) zeigte. Parallel dazu sanken die Blutdruckwerte in der Canagliflozin-Gruppe um durchschnittlich 7/3 mmHg. Allerdings kam es unter Canagliflozin auch zu einem leichten Anstieg der Lipidwerte (LDL-Cholesterin: +11,7 mg/dl; HDL-Cholesterin: +7,6 mmHg).
Diabetesrisiko der Statintherapie im Kontext
Unter dem Titel „Hot Topics in Diabetes, Dyslipidemia, and Cardiovascular Disease“ wurden aktuelle Kontroversen in der Lipidtherapie bei Diabetes besprochen, darunter die Stellung von Fibraten und Nikotinsäure nach ACCORD-Lipid (Goldfine et al., New Engl J Med 2011) bzw. AIM-HIGH (Giuliano, JAMA 2011), vor allem aber auch die Frage, ob das erhöhte Risiko für Typ-2-Diabetes, das in rezenten Metaanalysen der großen Statinstudien sichtbar wurde, für das vaskuläre Risikomanagement von Bedeutung ist.
Naveed Sattar (Glasgow, Großbritannien), Erstautor der 2010 publizierten Metaanalyse von 13 Statinstudien mit insgesamt 91.140 Teilnehmern (Sattar et al., Lancet 2010), die für die Statintherapie vs. Placebo ein relativ um 9 % erhöhtes Manifestationsrisiko gezeigt hatte, wies in seinem Vortrag darauf hin, dass dieser durch robuste Evidenz gesicherte Effekt der Statine dosisabhängig auftritt und eine höher dosierte Therapie bzw. der Einsatz potenterer Statine daher auch mit einem höheren Diabetesrisiko assoziiert ist.
Sattar plädierte dafür, angesichts der unzweifelhaften Benefits der Statintherapie die geltenden Empfehlungen beizubehalten, die Patienten aber über die Risiken der Therapie zu informieren und sie noch stärker als bisher zur Lebensstilmodifikation anzuhalten. Außerdem sollte in künftigen Lipidstudien zwingend ein Monitoring des Blutzuckers erfolgen.
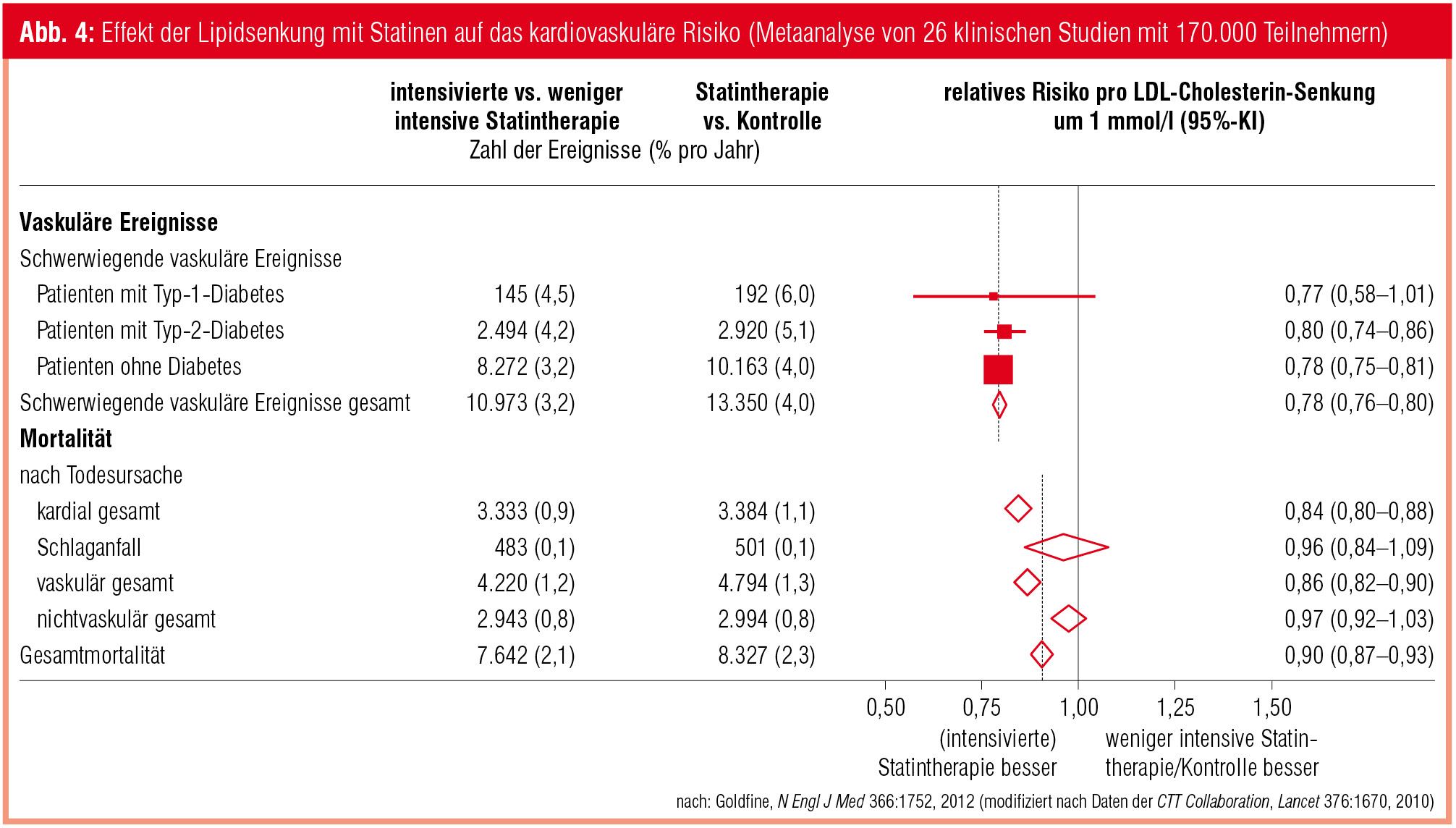 Anne C. Goldberg (St. Louis, USA) stellte das mit der Statintherapie verbundene Diabetesrisiko in den Kontext der kardiovaskulären Risikoreduktion: Nach der Metaanalyse von Sattar et al. führen Statine innerhalb von 4 Jahren bei einem von 256 Patienten zur Diabetesmanifestation. In einer neueren Metaanalyse von 5 Studien mit 32.752 zu Studienbeginn nichtdiabetischen Teilnehmern (Preiss et al., JAMA 2011) lag die diesbezügliche „number needed to harm“ bei 498 in 5 Jahren. Im Vergleich dazu sinkt die kardiovaskuläre Ereignisrate unter Statintherapie bei Diabetespatienten – praktisch ident wie bei Nichtdiabetikern – mit jeder Absenkung des LDL-Cholesterins um 1 mmol/l (39 mg/dl) um 22 %, die kardiovaskuläre Mortalität um 16 % und die Gesamtmortalität um 10 % (Goldfine, New Engl J Med 2011; Abb. 4).
Anne C. Goldberg (St. Louis, USA) stellte das mit der Statintherapie verbundene Diabetesrisiko in den Kontext der kardiovaskulären Risikoreduktion: Nach der Metaanalyse von Sattar et al. führen Statine innerhalb von 4 Jahren bei einem von 256 Patienten zur Diabetesmanifestation. In einer neueren Metaanalyse von 5 Studien mit 32.752 zu Studienbeginn nichtdiabetischen Teilnehmern (Preiss et al., JAMA 2011) lag die diesbezügliche „number needed to harm“ bei 498 in 5 Jahren. Im Vergleich dazu sinkt die kardiovaskuläre Ereignisrate unter Statintherapie bei Diabetespatienten – praktisch ident wie bei Nichtdiabetikern – mit jeder Absenkung des LDL-Cholesterins um 1 mmol/l (39 mg/dl) um 22 %, die kardiovaskuläre Mortalität um 16 % und die Gesamtmortalität um 10 % (Goldfine, New Engl J Med 2011; Abb. 4).
 Prim. o. Univ.-Prof. Dr. Dr. h. c. Heinz Drexel
Prim. o. Univ.-Prof. Dr. Dr. h. c. Heinz Drexel
VIVIT-Institut/Abteilung für Innere Medizin und Kardiologie, LKH Feldkirch
Nutzen der Statintherapie wiegt Diabetesrisiko jedenfalls auf
Die Lipidtherapie ist der Schlüssel zur Verringerung des Risikos für kardiovaskuläre Ereignisse. Dies gilt gerade und im Besonderen für die Höchstrisikopopulation der Patienten mit Typ-2-Diabetes. Aus diesem Grund gilt national und international die Empfehlung, bei Patienten mit Typ-2-Diabetes LDL-Cholesterinwerte von < 70 mg/dl anzustreben.
Das in den Metaanalysen beobachtete Risiko, unter Statintherapie Typ-2-Diabetes zu entwickeln, ist in Absolutzahlen sehr gering. Es ist auch nicht auszuschließen, dass Statine eine latente Diabeteserkrankung demaskieren und die Manifestation lediglich beschleunigen – was die Notwendigkeit begleitender Lebensstilmaßnahmen zur medikamentösen Therapie unterstreichen würde. Der Nutzen der Lipidsenkung mit Statinen im Hinblick auf die Reduktion der kardiovaskulären Morbidität und Mortalität bei Patienten mit Diabetes und Patienten ohne Diabetes ist durch Studien und Metaanalysen aber so eindeutig belegt, dass diese Vorteile die potenziellen Nachteile dieser Medikamente – quantitativ, vor allem aber auch qualitativ – in jedem Fall wieder aufwiegen.
 Prim. Univ.-Prof. Dr. Guntram Schernthaner
Prim. Univ.-Prof. Dr. Guntram Schernthaner
1. Medizinische Abteilung, Rudolfstiftung Wien
ORIGIN: Kein Argument für generelle frühe Insulintherapie bei Typ-2-Diabetes
Ein frühzeitiger Einsatz der Insulintherapie bei Patienten mit Typ-2-Diabetes wäre zu präferieren, wenn sie der oralen Standardtherapie in mikro- und makrovaskulärer Hinsicht überlegen wäre. Im Insulinarm der ORIGIN-Studie hatte ein niedrig dosiertes Basalinsulin (0,40 I. E./kg KG nach 6 Jahren) bezüglich Gesamtmortalität und kardiovaskulärer Mortalität oder kardiovaskulärer Ereignisse keinerlei Vorteil gegenüber einer oralen Standardtherapie (60 % Metformin, 47 % Sulfonylharnstoffe). Allerdings erhielten in der Insulintherapiegruppe ebenfalls 46 % der Patienten Metformin und 25 % Sulfonylharnstoffe. Und obwohl nach 6-jähriger Studiendauer die HbA1c-Differenz nur marginal unterschiedlich war (6,3 % vs. 6,5 %), hatten Patienten in der Insulingruppe dreimal häufiger schwere Hypoglykämien und nahmen um 2 kg mehr zu als Patienten in der Kontrollgruppe.
Die „neutralen“ Befunde sind auch deshalb kritisch zu beurteilen, weil im Kontrollarm in vielen Fällen eine Kombination aus Metformin und Sulfonylharnstoffen eingesetzt wurde – eine Therapieform, die in mehreren Studien – UKPDS 34 (Lancet 1998), Fremantle Diabetes Study (Sillars et al., Diabetes Obes Metab 2010) – und Metaanalysen (Rao et al., Diabetes Care 2008; Lamanna et al., Diabetes Obes Metab 2011; Boussageon et al., BMJ 2012) mit signifikant erhöhten kardiovaskulären Ereignisraten bzw. erhöhter kardiovaskulärer Mortalität assoziiert war.
Auch in Bezug auf mögliche Krebsrisiken der Insulintherapie (dies gilt nach derzeitiger Datenlage ausdrücklich nicht spezifisch für Insulin glargin) ist zu bedenken, dass die im Kontrollarm verwendeten Sulfonylharnstoffe in diesem Punkt ebenfalls das Krebsrisiko erhöhen dürften (Currie et al., Diabetologia 2009). Mit großem Interesse erwarten wir daher Subgruppenanalysen der ORIGIN-Daten, in denen die Tumorinzidenz für Patienten mit und ohne Metformin- bzw. Sulfonylharnstofftherapie getrennt ausgewiesen wird.
 Prim. Univ.-Prof. Dr. Peter Fasching
Prim. Univ.-Prof. Dr. Peter Fasching
5. Medizinische Abteilung, Wilhelminenspital Wien
Neues von GLP-1-Agonisten und SGLT2-Inhibitoren
Ein Schwerpunkt der Abstract-Präsentationen beim heurigen ADA-Kongress waren die Ergebnisse neuer Arzneimittelstudien. Besonders auf dem Gebiet der GLP-1-Mimetika tut sich einiges Neues: Das einmal täglich zu verabreichende Liraglutid wird für die meisten neuen GLP-1-Präparate im Head-to-Head-Vergleich als Referenzsubstanz verwendet, so auch für Albiglutid, ein in Entwicklung befindliches GLP-1-Mimetikum (GSK), welches einmal wöchentlich gespritzt werden muss. Auch wenn die HbA1c-senkende und gewichtsreduzierende Wirkung von Albiglutid geringfügig schwächer ausfiel, sind der erhöhte Patientenkomfort und womöglich die verbesserte Compliance in der klinischen Anwendung des langwirksamen Albiglutid in Zukunft zu berücksichtigen.
Einen gegensätzlichen Trend vertritt das dem Exenatid chemisch verwandte GLP-1-Präparat Lixisenatid (Sanofi). Dieses Präparat wird für die einmal tägliche Verabreichung zugelassen, wirkt in erster Linie auf die postprandialen Glukoseexkursionen und eignet sich daher ideal für eine allfällige Kombination mit Basalinsulinen. Eine Zulassung in Europa wird für Lixisenatid etwa Anfang 2013 erwartet. Eine Kombination von kurz und lang wirksamen GLP-1-Mimetika erscheint aber nicht sinnvoll, da durch die erzielten chronischen GLP-1-Konzentrationen die entsprechenden Rezeptoren bei lang wirksamen Präparaten permanent besetzt bzw. stimuliert sind.
Ebenfalls großen Raum nahmen Studienresultate zur neuen Substanzklasse der SGLT2-Blocker ein, welche bei Hyperglykämie eine Glukosurie durch Hemmung der Glukoseresorptionen der Niere erzielen. Prinzipiell sind bei aufrechter Nierenfunktion diese Substanzen mit allen gängigen Diabetesmedikamenten kombinierbar; sie führen zusätzlich zu der HbA1c-Senkung von mindestens 0,5 Prozentpunkten zu einer Reduktion des Körpergewichtes und des Blutdrucks.
Die Therapie des Diabetes wird zukünftig zunehmend komplexer. Die Gefahr, das Österreich von internationalen Therapieentwicklungen abgekoppelt wird, ist aber groß, wenn man die derzeitige völlig unbefriedigende Refundierungssituation für zugelassene GLP-1-Mimetika in Österreich in Betracht zieht.
 Prof. Dr. Gertrud Kacerovsky-Bielesz
Prof. Dr. Gertrud Kacerovsky-Bielesz
Karl-Landsteiner-Institut für Endokrinologie und Stoffwechselkrankheiten, Hanusch-Krankenhaus, Wien; Nationale ORIGIN-Studienkoordinatorin für Österreich
Zur Bedeutung der ORIGIN-Studie
Als ORIGIN vor rund 10 Jahren konzipiert wurde, war aus früheren Studien (uKPDs und anderen) nicht klar, ob eine strenge Blutzuckereinstellung bei Personen mit vorbestehender Herz-Kreislauf-Erkrankung kardiovaskuläre Ereignisse verhindern kann. Das Studienprotokoll sah für die Insulingruppe ein Nüchternblutzuckerziel von < 95 mg/dl vor. Bei Personen mit Glukoseintoleranz (IGT) bzw. gestörter Nüchternglukose (IFG) oder mit frühem Typ-2-Diabetes, wie sie in die ORIGIN-Studie eingeschlossen wurden, wurde ein solches Therapieziel mit Basalinsulin unter Titrierung gut erreicht. Aber auch in der Kontrollgruppe mit Metformin und Sulfonylharnstoffen konnten die HbA1c-Werte über sechs Jahre stabil bei durchschnittlich 6,5 % gehalten werden. Der Monitoring-Aufwand war allerdings erheblich, im Praxisalltag wäre er in dieser Form nicht durchführbar. Das Risiko für schwere Hypoglykämien war in der Insulingruppe dreimal höher als in der Kontrollgruppe, die Patienten nahmen im Vergleich zur Kontrollgruppe 1,6 kg zu.
Nach den nun vorliegenden Ergebnissen der Studie können wir sagen, dass eine intensivierte Blutzuckerkontrolle mit Insulin im Vergleich zu einer weniger intensiven oralen Diabetestherapie, zumindest im untersuchten Kollektiv, keine kardiovaskulären Vorteile mit sich bringt. Insofern kann man nicht empfehlen, die Standardtherapie für Patienten mit IFG, IGT oder neu entdecktem Typ-2-Diabetes zu ändern. Die Studie hat auch gezeigt, dass Insulin bei kardiovaskulären Risikopatienten sicher einsetzbar ist. Auch dieses Wissen hatten wir vor Beginn der ORIGIN-Studie nicht.


















































































