ASCO 2012: Trastuzumab-Emtansine – neuer HER2-Ansatz bei Mammakarzinom
Am diesjährigen ASCO-Meeting in Chicago wurden die Ergebnisse der EMILIA-Studie präsentiert. T-DM1 stellt einen neuen und vielversprechenden Therapieansatz in der Behandlung des metastasierten HER2-positiven Mammakarzinoms dar.
HER2-gezielte Therapie des Mammakarzinoms
Eine Amplifizierung des EGF-Rezeptors HER2 findet sich in ca. 20–25 % aller primären Mammakarzinome und resultiert in einer Überexpression des HER2-Proteins mit über 1 Million Kopien pro Zelle. Bekanntermaßen geht die HER2-Überexpression beim Mammakarzinom mit einer schlechten Prognose und aggressivem Tumorwachstum einher.
Mit der Einführung von Trastuzumab (Herceptin®), einem humanisierten monoklonalen Antikörper, der gegen die extrazelluläre Komponente des HER2-Proteins gerichtet ist, steht eine zielgerichtete und höchst effektive Therapie für diese Subgruppe an Karzinomen zur Verfügung. Obwohl der genaue Wirkmechanismus von Trastuzumab nicht vollständig geklärt ist, werden die erzielten Behandlungserfolge durch die Blockade der nachgeschalteten Signaltransduktion sowie die antikörpervermittelte zelluläre Zytotoxizität erklärt.
Sowohl in der Behandlung des primären als auch des metastasierten HER2-positiven-Mammakarzinoms hat die Einführung von Trastuzumab in das Therapieregime zu revolutionären Verbesserungen geführt.
Derzeit stehen uns auf diesem Gebiet weitere wohl bahnbrechende Veränderungen bevor. Mit der Einführung von Pertuzumab, ebenfalls ein gegen HER2 gerichteter monoklonaler Antikörper, der die Dimerisierung von EGFR2 mit seinen Partnern verhindert, werden sich hier die Rahmenbedingungen nochmals verändern. Die vorliegenden und laufenden Studien versprechen jedenfalls eine weitere Verbesserung des Outcomes bei günstigen Nebenwirkungsprofilen.
Dennoch kommt es bei metastasierten Patientinnen auch unter HER2-gezielter Therapie irgendwann zu einem Fortschreiten der Erkrankung. Es besteht also weiterhin ein Bedarf an effektiven Therapieoptionen. Eine gänzlich neue Option tut sich hier mit der Gruppe der Antikörper-Wirkstoff-Konjugate (Antibody-Drug-Conjugate – ADC) auf.
Innovation durch Antikörper-Wirkstoff-Konjugate
ADCs sind designt, um hochpotente Zytostatika gezielt zu antigenpräsentierenden Zellen zu bringen, um so den therapeutischen Index des Medikaments zu steigern. Die Hauptkomponenten der ADCs sind ein zytotoxisches Agens, ein monoklonaler Antikörper, der im Idealfall ein tumorspezifisches Antigen bindet, und einem Linker, der die beiden Hauptkomponenten kovalent aneinander bindet.
Trastuzumab-MCC-Emtansine (T-DM1) ist ein solches ADC, das über Trastuzumab spezifisch HER2-überexprimierende Zellen anvisiert. Das zytotoxische Agens in diesem Konjugat ist DM1, ein Derivat von Maytansine 1, einer hochpotenten antimitotischen Substanz, die ähnlich wie Vinkaalkaloide an Mikrotubuli bindet, jedoch um ein Vielfaches potenter ist. In vitro zeigt Emtansine eine bis zu 500-fach potentere Aktivität als Paclitaxel. Maytansine zeigte als unkonjugiertes i. v. Präparat ausgeprägte Toxizitäten und nur wenig Antitumoraktivität in tolerabler Dosierung.
Als Linker fungiert N-Maleimidomethyl-Cyclohexan-1-Carboxylat (MCC), der DM1 durch nicht reduzierbare Thioesterverbindungen an Trastuzumab bindet, und zwar im Schnitt 3,5 DM1-Moleküle pro Antikörper. Im präklinischen Setting trug die Einführung von MCC als stabiler Linker maßgeblich zur Verbesserung sowohl von Toxizität als auch Effektivität bei.
T-DM1 bindet an die extrazelluläre Domäne des HER2-Moleküls. Der T-DM1/HER2-Komplex wird von der Zelle endozytotisch internalisiert und in Lysosomen degradiert. Dadurch wird der aktive Metabolit Lys-MCC-DM1 ins Zytoplasma freigesetzt.
In einer Phase-I-Studie mit 24 Patientinnen mit metastasiertem Mammakarzinom zeigte sich eine Dosierung von 3,6 mg/kg alle 3 Wochen als maximal tolerabel. Dosislimitierend waren dabei Grad-4-Thrombopenien bei 4,8 mg/kg. In der Arbeit von Krop et al. zeigte die empfohlene Dosierung in dieser Gruppe von ausgedehnt vorbehandelten Patientinnen nur eine milde und reversible Toxizität unter der Therapie mit T-DM1, vor allem Thromozytopenien, Anstieg der Transaminasen, Fatigue und Übelkeit. Es wurden keine Alopezie, Erbrechen, Neuropathie oder kardiale Effekte über Grad 1 beobachtet.
In der größten publizierten Phase-II-Studie wurden 112 Patientinnen mit metastasiertem, HER2-positivem Mammakarzinom in einem Arm eingeschlossen. Patientinnen waren zumeist in der Third-Line oder Fourth-Line chemotherapievorbehandelt und erhielten zuvor zumindest ein Herceptin® enthaltendes Schema. Alle Patientinnen zeigten einen Progress unter Trastuzumab-Therapie oder weniger als 60 Tage nach der letzten Gabe. 60 % der Patientinnen waren auch mit Lapatinib vorbehandelt.
Unter den behandelten Patientinnen zeigten 29 eine objektives Ansprechen auf die Therapie nach RECIST-Kriterien (25,9 %).
Eine zentrale HER2-Testung von 95 Patientinnen, bei denen die originalen Tumorblöcke zur Verfügung standen, ergab, dass bei 21 dieser Patientinnen keine HER2-Amplifikation vorlag. Bei den 74 verbleibenden HER2-positiven Patientinnen zeigten 34 % ein objektives Ansprechen, verglichen mit nur 4,8 % bei den HER2-negativen Tumoren.
Die häufigsten Nebenwirkungen umfassten Fatigue, Übelkeit und Kopfschmerzen. Bei den Grad-3-oder Grad-4-Nebenwirkungen zeigte sich wiederum die Thrombozytopenie als häufigstes Problem, wobei schwerwiegende hämorrhagische Ereignisse in diesem Zusammenhang selten auftraten. Eine Epistaxis vom Grad 1–2 war jedoch bei 34 % der behandelten Patientinnen zu beobachten.
Somit zeigte die Substanz auch in der Phase II eine gute antitumorale Aktivität als Monotherapie bei vorbehandelten HER2-positiven metastasierten Mammakarzinomen, bei guter Verträglichkeit in der angewendeten Dosierung.
EMILIA-Studie – Phase-III-Daten zu T-DM1
Am diesjährigen Annual Meeting der ASCO in Chicago präsentierte Kimberly Blackwell erste Daten der EMILIA-Studie im Rahmen der „Plenary Session“. Der EMILIA-Trial ist die erste prospektiv-randomisierte Phase-III-Studie, die die Wirkung von T-DM1 bei metastasierten HER2-positiven Mammakarzinomen untersucht.
Patientinnen und Design: Es wurden 980 Patientinnen mit metastasiertem oder lokal fortgeschrittenem Mammakarzinom, bei denen der HER2-Status zentral getestet wurde, in die Studie eingeschlossen. Alle Patientinnen waren mit Trastuzumab und Taxanen vorbehandelt und zeigten einen Progress unter laufender First-, Second- oder Third-Line-Therapie bzw. innerhalb von 6 Monaten nach einer adjuvanten Therapie. Es erfolgte eine 1:1-Randomisierung in die beiden Studienarme. Der 1. Arm wurde mit T-DM1 3,6 mg/kg i. v. 3-wöchentlich behandelt, also nach demselben Schema wie bereits in den vorangegangenen Phase-I- und Phase-II-Studien. Im Kontrollarm wurden die Patientinnen mit Capecitabine 1.000 mg/m2 2 x tgl. von Tag 1–14 des 21-Tage-Zyklus sowie Lapatinib 1.250 mg in einer täglichen Dosis. Das Schema des Kontrollarms basiert hierbei auf den Ergebnissen einer Phase-III-Studie, die von Geyer et al. publiziert wurde.
Die primären Endpunkte der EMILIA-Studie waren das progressionsfreie Überleben (PFS), Gesamtüberleben (OS) und die Sicherheit der Therapie.
Für die finale Analyse des PFS wurden 508 Ereignisse erwartet, um mit einer Power von 90 % eine HR von 0,75 zu detektieren. Für die finale Analyse des OS sind 632 Ereignisse zu erreichen, um hier mit einer Power von 80 % eine HR von 0,80 ermitteln zu können. Die vorgegebenen Grenzen zur Bestimmung des OS wurden bislang in der experimentellen Gruppe nicht erreicht und die endgültigen Ergebnisse hierzu werden für Anfang 2014 erwartet, so Blackwell.
Die Rekrutierung der Studie begann im Februar 2009 und die letzte Patientin wurde im Oktober 2011 randomisiert. In beiden Behandlungsarmen fanden sich nach Abschluss der Rekrutierung 490 Patientinnen, wobei zum Zeitpunkt der präsentierten Datenanalyse (Cut-off 01/12) eine mediane Follow-up-Zeit von 12,9 Monaten vorlag.
Was die demografischen Daten, Erkrankungscharakteristika und Anzahl sowie Art der Vorbehandlung anbelangt, waren beide Patientengruppen sehr gut balanciert.
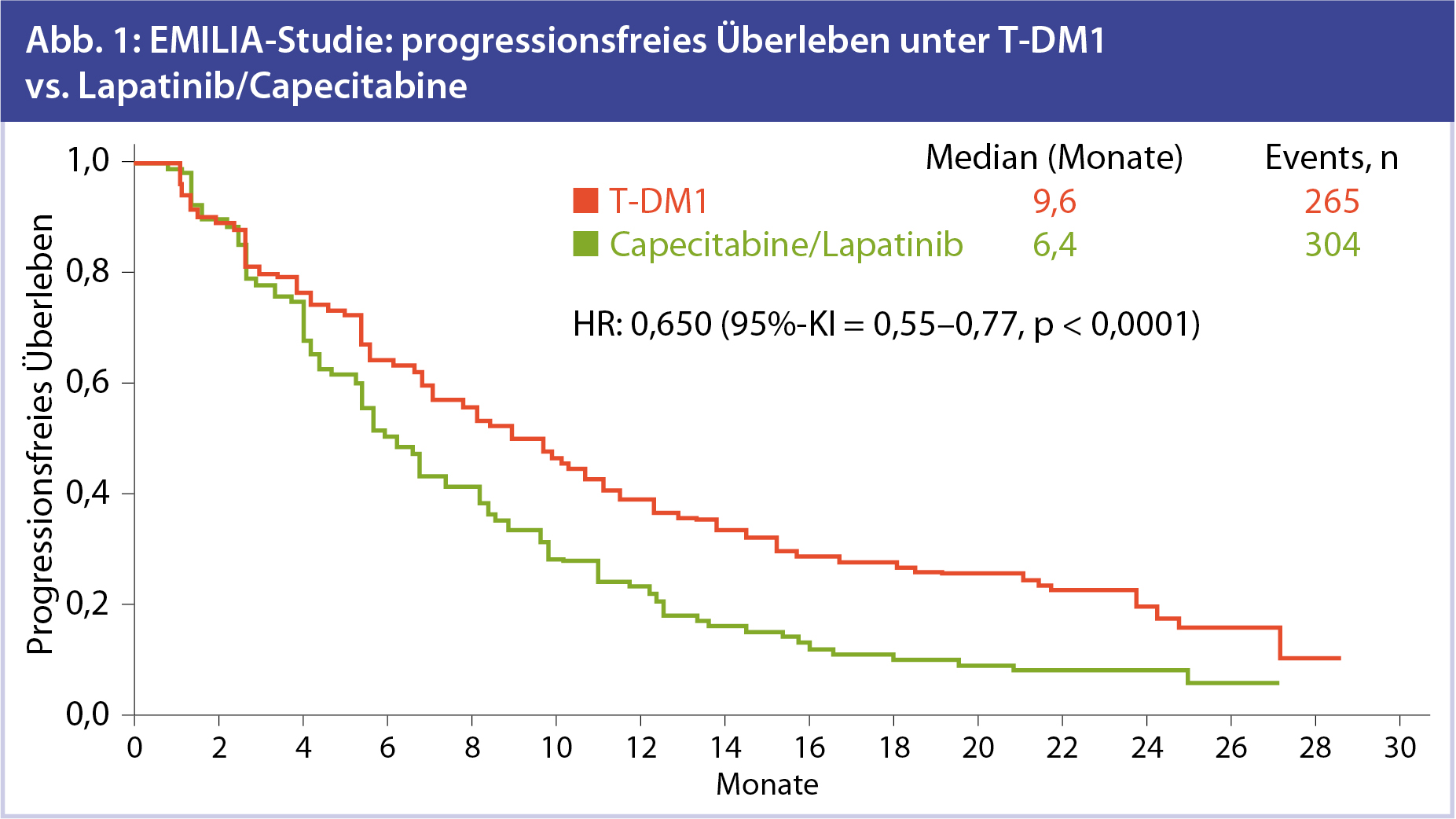
Die finale Analyse des PFS zeigte einen klaren Vorteil im T-DM1-Arm (Abb. 1). Die durchschnittliche Dauer bis zur Progression betrug unter T-DM1-Therapie 9,6 Monate und war im Vergleich zur Capecitabine/Lapatinib-Gruppe mit einem Median von 6,4 Monaten signifikant besser. Wobei die HR bei 0,65 liegt, mit einem p-Wert von < 0,0001. Diese Ergebnisse deckten sich sowohl in der geplanten unabhängigen als auch in der durch die Studiengruppe durchgeführten Analyse.
Bis auf die Gruppe der über 65-Jährigen zeigte T-DM1 in allen Subgruppen das deutlich bessere Outcome. In der kleinen Gruppe der älteren Patientinnen (n = 138) lag jedoch nur eine HR von 1,06 mit weiten Konfidenzintervallen vor.
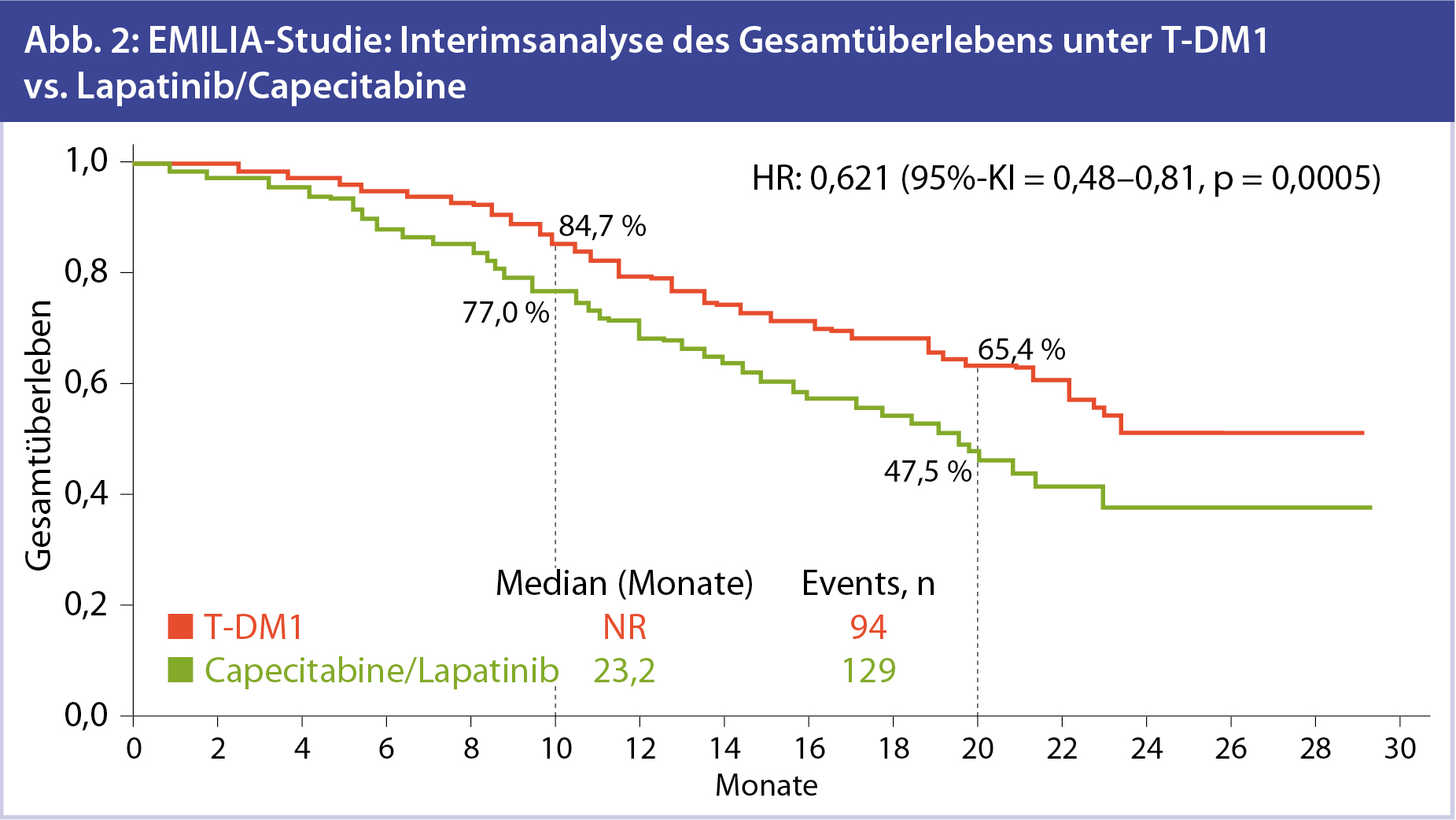
Präliminäre Daten zum Gesamtüberleben: Da die vorgegebenen statistischen Grenzwerte noch nicht erreicht sind, liegen für das OS bislang nur interimistische Daten vor (Abb. 2). Hier zeigt sich zwar ein deutlicher Trend für eine Verbesserung des Gesamtüberlebens im T-DM1-Arm, jedoch sind hier die finalen Auswertungen abzuwarten. Wie bereits erwähnt, sind diese Daten für Anfang 2014 zu erwarten. In 2 vorgeplanten Auswertungen aber zeigte sich beim OS nach einem Jahr eine absolute Verbesserung von 7,7 % unter T-DM1-Therapie im Vergleich zu Capecitabine und Lapatinib, nach 2 Jahren sogar bereits 17,9 %.
Sicherheit der Therapie: Auch was Verträglichkeit und Sicherheit anbelangt, hat T-DM1 in der Studie sehr gute Ergebnisse geliefert. Bei der Gesamtauswertung der „Adverse Events“ gab es keine signifikanten Unterschiede. Bei der Anwendung von Trastuzumab-Emtansine kam es im Vergleich zur Kombinationstherapie mit Xeloda® und Tyverb® vor allem zu häufigeren Erhöhungen der Leberfunktionsparameter sowie vermehrter Thrombopenie und Anämie, was sich in vermehrter Notwendigkeit von Thrombozytenkonzentraten oder Bluttransfusionen niederschlug. Insgesamt kam es im Kontrollarm zu deutlich mehr Therapieabbrüchen aufgrund von Adverse Events (10,7 % vs. 5,9 %) als in der Patientinnengruppe, die T-DM1 erhalten hatte. Besonders hervorzuheben ist, dass es zu keinen Unterschieden in der Beeinträchtigung der LVEF gekommen ist und diese in beiden Gruppen selten war.
Zusammenfassend zeigt Trastuzumab-Emtansine in diesem Patientenkollektiv von teils stark vorbehandelten HER2-neu-positiven metastasierten Mammakarzinomen im Vergleich zur Therapie mit Capecitabine und Lapatinib eine überlegene Effektivität. Dies zeigt sich in der signifikanten Verbesserung des PFS. Obwohl der Median im OS für die T-DM1-Gruppe noch nicht erreicht ist, zeigt sich auch hier eine klare Tendenz zugunsten der ADC-Therapie. Ob sich diese Daten nach Erreichen der erforderlichen Events als eindeutig signifikant zeigen werden, ist aber noch abzuwarten. Auch in den sekundären Endpunkten und der Therapiesicherheit zeigt sich das Antikörper-Zytostatikum-Konjugat dem Kontrollregime überlegen.
Aufgrund der vorliegenden Ergebnisse aller Studien zu diesem Wirkstoff wird T-DM1 in naher Zukunft eine wichtige therapeutische Option in der Behandlung des HER2-überexprimierenden Mammakarzinoms darstellen. Die Anträge an die EMA und die FDA sind bereits erfolgt, mit einer Zulassung ist bereits in den nächsten Monaten zu rechnen.
AUSBLICK: Trotz der guten Daten, die vor allem durch das saubere Studiendesign und die gute Durchführung der EMILIA-Studie als sehr glaubwürdig einzuschätzen sind, bleiben noch viele Fragen zu dieser neuen Gruppe der ADCs und T-DM1 im Speziellen offen. Antworten sind jedoch bereits unterwegs, denn auf www.clinicaltrials.gov sind derzeit nicht weniger als 17 Studien zu diesem Thema gelistet. Speziell die Ergebnisse des MARIANNE-Trials, ebenfalls einer Phase-III-Studie, werden nun mit Spannung erwartet. Hier wird die Effektivität von T-DM1 als Monotherapie oder in Kombination mit Pertuzumab in der First-Line-Therapie untersucht. Im Vergleichsarm kommt Trastuzumab in Kombination mit einem Taxan zum Einsatz.
Für dieses Setting gibt es schon vielversprechende präliminäre Daten aus einer Phase-II-Studie von Perez et al. Sollte auch die Phase-III-Studie ein positives Ergebnis liefern, wird der nächste notwendige Schritt die Erprobung im adjuvanten und auch neoadjuvanten Bereich sein.
Auch wissen wir derzeit noch nicht, ob Kombinationen mit anderen Antitumortherapien weitere Verbesserungen erzielen könnten. Und wenn ja, welche Substanzen hier als potente Partner in Frage kommen.