Nachsorge des Mammakarzinoms
Zur Primärtherapie wird die Operation, Bestrahlung, neoadjuvante oder adjuvante Chemotherapie, antihormonelle Therapie und Immuntherapie gerechnet. Die Nachsorge sollte als ärztliche Aufgabe angesehen werden. Die Betreuung von Brustkrebspatientinnen im Rahmen der Nachsorge hat mehrere Ziele:
- Begleitung im Sinne von kontinuierlicher Aufklärung der adjuvanten Therapie und Behandlung von Nebenwirkungen
- Früherkennung und Behandlung von Lokalrezidiven
- Früherkennung und Behandlung von kontralateralen Rezidiven
- Früherkennung und Behandlung von Fernmetastasen
- Überwachung der adjuvanten Primärtherapie und ev. Adaptation dieser (insbes. der antihormonellen Therapie)
- psychologische Betreuung
Grundsätzlich sollte die Nachsorge 10 Jahre dauern, da innerhalb der ersten 5 Jahre nach Operation und innerhalb der ersten 10 Jahre nach Operation die Rezidivrate kaum abnimmt.1 Nachsorge kann durchaus von niedergelassenen ÄrztInnen durchgeführt werden. Wünschenswert ist eine enge Kooperation mit dem Brustzentrum. Ein Vergleich zwischen Nachsorge bei Brustkrebsspezialisten und Nachsorgeuntersuchungen von Allgemein-medizinern in der Praxis verglichen zeigte kein Unterschied hinsichtlich des Zeitpunkts, wann ein Rezidiv diagnostiziert wurde, und der Lebensqualität.² Allerdings zeigte sich eine größere Zufriedenheit unter denjenigen Patientinnen, welche ihre Nachsorgeuntersuchungen beim niedergelassenen Arzt durchführen ließen. Wichtig ist, dass die niedergelassenen KollegInnen mit den Fragestellungen, die sich in der Nachsorge nach Brustkrebs ergeben (z. B. Nebenwirkungen adjuvanter antihormoneller Therapien) vertraut sind.
Während die Wahl der adjuvanten Therapie individuell nach Risikoklassifikationen, vor allem die Tumorbiologie betreffend, entschieden wird, besteht keine evidenzbasierte individualisierte risikoadaptierte Nachsorge. Wir wissen zwar heutzutage, dass die Prognose hinsichtlich Rezidiven und Überleben beim Mammakarzinom von Faktoren wie Hormonrezeptorstatus, TNM-Klassifikation, Nodalstatus und HER2-Status abhängig ist, die Intensität der Nachsorge ist aber für alle Patientinnen unabhängig von diesen Prognosefaktoren gleich. Prospektiv-randomisierte Daten hinsichtlich einer individualisierten, risikoadaptierten Nachsorge wären sehr interessant.
Symptomorientierte vs. intensivierte Nachsorge
Basis der Nachsorge ist die Anamnese, das ärztliche Gespräch und die klinische Untersuchung. Eine intensivierte diagnostisch-apparative Nachsorge wäre zu befürworten, wenn diese entweder die Zahl der Überlebenden erhöht, die Überlebenszeit verlängert oder die Lebensqualität verbessert. Bisher gibt es keine Evidenz, dass durch eine intensivierte Nachsorge auch nur eine der drei oben genannten Kriterien erfüllt wird. Deswegen kam es vor etwa 10 Jahren zu einem Wandel in der Nachsorge, weg von der intensivierten diagnostisch-apparativen Nachsorge hin zur symptomorientierten Nachsorge. Ausschlaggebend dafür war ein systematischer Review2 von 4 randomisierte Studien mit insgesamt 3.055 Patientinnen. Die Studie verglich ein Nachsorgeschema basierend auf Arztbesuch und Mammographie verglichen mit ergänzenden radiologischen diagnostischen Untersuchungen und Laborabnahmen. Es konnte kein Unterschied im Overall-Survival (HR 0,94) und im Disease-free-Survival (HR 0,84) festgestellt werden. Eine weitere randomisierte Multicenterstudie3 verglich eine Patientinnengruppe, bei der regelmäßig zur klinischen Visite Skelettszintigraphie, Oberbauchsonographie, Thoraxröntgen und Laboruntersuchungen durchgeführt wurden, mit einer Patientinnengruppe, bei der im Rahmen der gleichfrequenten klinischen Untersuchungen weitere diagnostische Untersuchungen nur bei entsprechender Symptomatik durchgeführt wurden. Es konnte kein signifikanter Unterschied hinsichtlich Gesamtüberlebens, Auftreten von Rezidiven oder gesundheitsspezifischer Lebensqualität festgestellt werden.
Nachsorgeschema
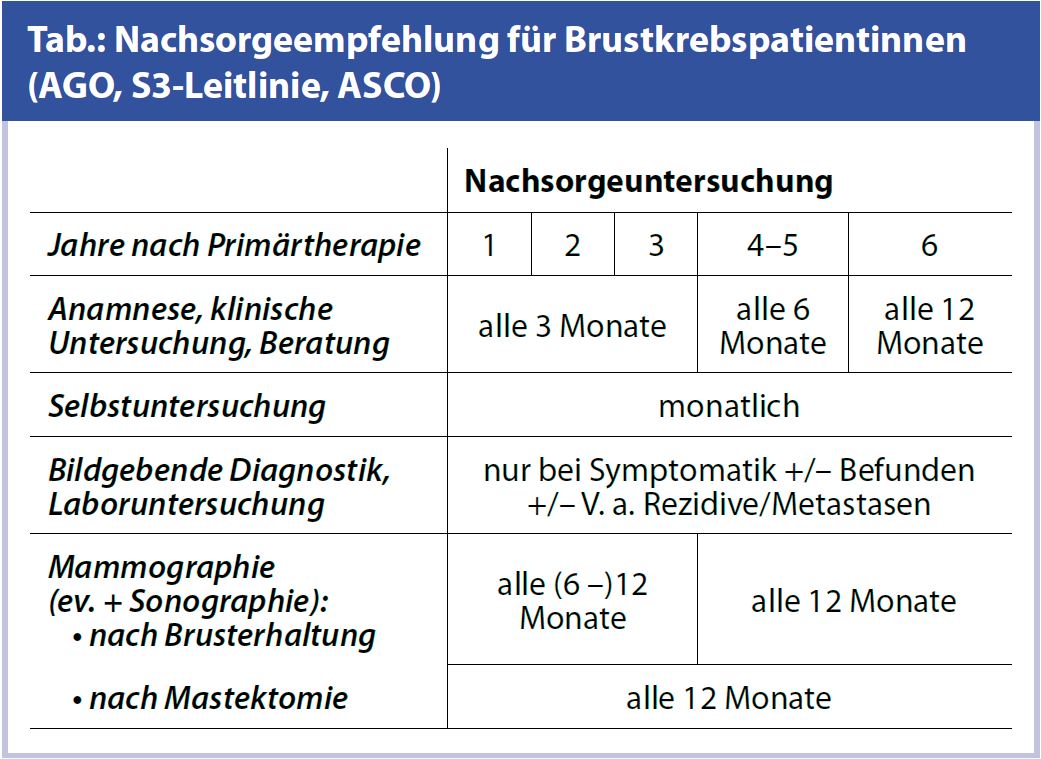
Die aktuellen Nachsorgeuntersuchungen und Zeitintervalle, wie sie in den AGO-Leitlinien 20114, S3-Leitlinien der Deutschen Krebsgesellschaft 20085 und ASCO-Guidelines 20066 empfohlen werden, sind in der Tab. zusammengefasst. Die Routinenachsorge sollte ein ärztliches Gespräch, eine klinische Untersuchung und die regelmäßige Durchführung der Mammographie (eventuell mit Mammasonographie) beinhalten.
Ärztliches Gespräch: Das ärztliche Gespräch ist die Basis der Nachsorgeuntersuchungen und sollte in den ersten 3 Jahren alle 3 Monate, danach halbjährlich und nach dem fünften Jahr jährlich stattfinden. Die Patientinnen sollten über den Nutzen der Therapie und über mögliche therapiespezifische Kurzund Langzeitnebenwirkungen, wie postmenopausalen Beschwerden, Knochenschmerzen und Abnahme der Libido, aufgeklärt werden. Eine genaue Anamnese über neu aufgetretene Beschwerden bringt meistens entscheidende Hinweise für eine mögliche notwendige weiterführende Diagnostik oder Therapie. Dabei sollte auch genügend Zeit für Fragen von Patientinnen einberaumt werden. Falls notwendig, sind auch andere Berufsgruppen wie PsychologInnen oder PhysiotherapeutInnen in die Nachsorge miteinzubeziehen.
Palpation der Brust: Die klinische Untersuchung beinhaltet die Palpation der operierten und der kontralateralen Brust sowie ein Abtasten der Thoraxwand und der Lymphabflusswege. Frauen mit einem isolierten intramammären oder lokoregionären Rezidiv können, anders als in der metastasierten Situation, kurativ behandelt werden. Wichtiger ist daher die frühe Erkennung eines intramammären oder lokoregionären Rezidivs, welche am ehesten durch eine genaue klinische Untersuchung entdeckt werden können. In einer Arbeit konnten 71 % der aufgetretenen ipsilateralen Rezidive nach primär kurativer brusterhaltender Operation mittels klinischer Untersuchung entdeckt werden und hingegen nur 29 % mittels Mammographie.7
Mammographie: Da nach primärem Mammakarzinom ein erhöhtes Risiko für intramammäre und lokoregionäre Rezidive besteht, ist die jährliche Mammographie fixer Bestandteil der Nachsorge. Häufig kommt es im Operationsgebiet zu Vernarbungen, welche manchmal schwierig von Rezidiven zu unterscheiden sind. Hilfreich für die Unterscheidung Narbengewebe oder Rezidiv und auch bei sehr dichtem Brustdrüsengewebe kann eine ergänzende Ultraschalluntersuchung sein. Scheint es dennoch nicht möglich zu sein, zwischen Rezidiv und Narbe zu differenzieren, wäre eine Magnetresonanzmammographie indiziert. Die MR-Mammographie konnte in einer deutschen Studie 12 Monaten nach der Operation ein Rezidiv von einer Narbe mit einer Sensitivität von nahezu 100 % und einer Spezifität von über 90 % detektieren.8 Die MR-Mammographie scheint auch die Methode der Wahl in der Nachsorge von Patientinnen, bei denen die Brust mittels prothetischen Verfahren rekonstruiert wurde.
Laborwerte und Tumormarker: Die routinemäßige Bestimmung von Tumormarker wird in aktuellen Leitlinien (AGO, S3-Leitlinie, ASCO) nicht empfohlen. Der Nutzen der Tumormarkerbestimmung bei asymptomatischen Patientinnen ist aufgrund der geringen Sensitivität und Spezifität für das Auftreten einer Metastase oder eines Lokalrezidivs nicht gegeben.
Es konnte gezeigt werden, dass nur in 32 % der Patientinnen die CA-15-3-Werte 6 und 3 Monate vor der klinischen Manifestation der Metastasierung erhöht waren.9 In einer weiteren Arbeit wurden bei 243 Brustkrebspatientinnen nach Primärtherapie prospektive alle 6 Monate bis zum ersten Wiederauftreten der Erkrankung die CA-15-3-Werte gemessen. Nach einer 5-jährigen Nachbeobachtungszeit zeigte sich bei 59 Patientinnen ein Wiederauftreten der Erkrankung. Bei diesen 59 Patientinnen wurden insgesamt 199 Bluttests auf CA 15-3 durchgeführt, wovon nur 25 (13 %) positiv waren. Unter den 186 Patientinnen ohne Hinweis auf Relaps waren die CA-15- 3-Werte ebenfalls in 3 % erhöht.10
Lifestyle-Optimierung
Patientinnen im Rahmen der Nachsorge stellen oft die Frage, was sie denn selbst zu einem positiven Krankheitsverlauf beitragen können. Spätestens dann sollte auf mögliche Faktoren zur Lifestyle-Optimierung, wie Gewichtsreduktion und sportliche Aktivität, hingewiesen werden.
Gewichtsreduktion: Adipositas ist v. a. nach den Wechseljahren ein Risikofaktor für die Entstehung von Brustkrebs. Eine aktuelle Studie hat auch gezeigt, dass Frauen mit einem erhöhten BMI (Body Mass Index) eine schlechtere Prognose hinsichtlich ihres Krankheitsverlaufes haben.11 Als Ursache dafür wird die vermehrte Umwandlung von Androgenen in Östrogene im Fettgewebe angesehen. Die Östrogene können das Wachstum von Brusttumoren fördern. Weiters haben adipöse Frauen höhere Glukosespiegel und somit eine vermehrte Ausschüttung von Insulin. Insulin wiederum reguliert nicht nur den Blutzucker, es ist auch ein Wachstumshormon und stimuliert die Zellproliferation im normalen Brustgewebe und in Brustkrebszelllinien. Demnach sollten adipöse Patientinnen im Rahmen der Nachsorge besonders motiviert werden, ihr Gewicht zu reduzieren.
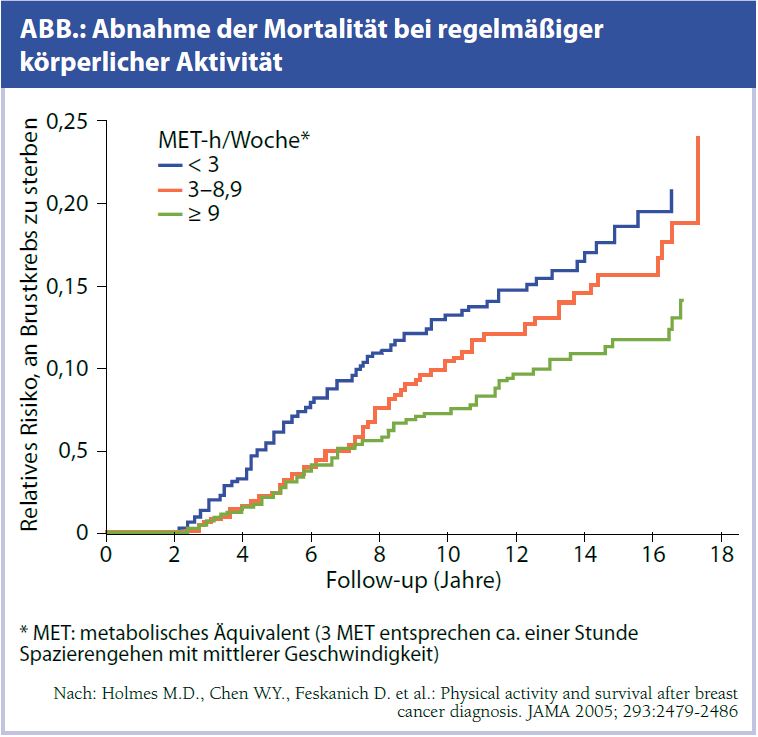
Sportliche/körperliche Aktivität: Neben einer Stimulierung der Immunantwort wird durch regelmäßige körperliche Aktivität auch das Körperfett mit den darin enthaltenen Östrogenvorstufen reduziert. Weiters kommt es durch Sport zu einer Reduktion des Insulin-like Growth Factor 1. Sportliche Aktivität hat einen günstigen Einfluss auf das Risiko, an Brustkrebs zu erkranken. Bereits regelmäßiges Spazierengehen von mehr als 4 Stunden in der Woche kann das Brustkrebsrisiko senken. Holmes et al.12 untersuchten, ob regelmäßige sportliche Aktivität auch die Mortalität nach Brustkrebs senken kann. Zur Objektivierung der sportlichen Aktivität wurde die Einheit MET (metabolisches Äquivalent) eingeführt, wobei 3 MET ca. einer Stunde Spazierengehen mit mittlerer Geschwindigkeit entsprechen. Holmes et al. zeigten, dass das adjustierte relative Risiko, an Brustkrebs zu sterben, für Patientinnen mit weniger als 3 MET in der Woche 0,80 betrug, mit einer körperlichen Aktivität von 3–8,9 MET in der Woche nur mehr 0,50 war. Der größte Benefit zeigte sich für Patientinnen mit einem hormonsensiblen Mammakarzinom. Entscheidend aus dieser Studie ist die Tatsache, dass Patientinnen umgerechnet mit 3 bis 5 Stunden Spazierengehen mit mittlerer Geschwindigkeit pro Woche ihr Risiko, an Brustkrebs zu versterben, halbieren könnten (Abb.).
Alkohol: Grundsätzlich wissen wir, dass Alkohol das Krebsrisiko erhöht. Der genaue Wirkmechanismus, wie Alkohol zur Krebsentstehung beiträgt, ist noch nicht bekannt, aber regelmäßiger Alkoholkonsum führt zu einer Erhöhung der Konzentration von freiem Östradiol im Serum. Weiters zeigt sich eine lineare Zunahme der Mammakarzinominzidenz mit der täglichen konsumierten Alkoholmenge.13
ZUSAMMENFASSUNG: Nach entsprechenden Leitlinien (AGO, S3-Leitlinie, ASCO) sollte die Nachsorge eine symptomorientierte Betreuung über 10 Jahre hinweg sein. Basis der Nachsorge ist die Anamnese, die klinische Untersuchung und das ärztliche Gespräch mit Fokus auf mögliche Nebenwirkungen. Als einzige bildgebende Diagnostik wird bei asymptomatischen Patientinnen die jährliche Mammographie, eventuell in Kombination mit einem Ultraschall, empfohlen. Routinemäßige Bestimmung von Laborwerten inkl. Tumormarkerbestimmung ist nicht angezeigt.
1 Saphner T. et al., J Clin Oncol 1996; 14:2738-46
2 Rojas M.P. et al., Cochrane Database Syst Rev. 2005 Jan 25; (1):CD001768
3 The GIVIO Investigators. JAMA 1994; 271:1587-92
4 AGO-Leitlinien Version 2011, im Internet: www.ago-leitlinien.org
5 Interdisziplinäre S3-Leitlinie für die Diagnostik, Therapie und Nachsorge des Mammakarzinoms; Version 2008, im Internet: www.krebsgesellschaft.de
6 Khatcheressian J.L et al., J Clin Oncol 2006; 24:5091-7
7 Dalberg K. et al., Breast Cancer Res Treat 1998; 49:69-78
8 Müller R.D. et al., J Comput Assist Tomogr 1998; 22:408-12
9 Fehm T. et al., Cancer Res Treat 2002; 75:97-106
10 Kokko R. et al., Eur J Cancer 2002; 38:1189-93
11 Barnett G.C. et al., J Clin Oncol 2008; 26:3310-6
12 Holmes M.D. et al., JAMA 2005; 293:2479-86 13 Smith-Warner S.A. et al., JAMA 1998 Feb 18; 279 (7):535-40