Diagnose und Therapie – Das polyzystische Ovarialsyndrom
Ungefähr 100.000 Frauen in Österreich leiden an polyzystischem Ovarialsyndrom (PCOS). Trotzdem wird es sehr oft spät oder gar nicht diagnostiziert und dadurch nicht die entsprechende Behandlung gewählt. Übergewichtige Frauen sind deutlich häufiger betroffen, wobei dies insbesondere für Amerika und etwas weniger für den europäischen Raum zutrifft. Laut Rotterdam-Kriterien (2003) liegt ein PCOS vor, wenn 2 der 3 in der Tabelle angeführten Kriterien erfüllt sind.
Diagnose
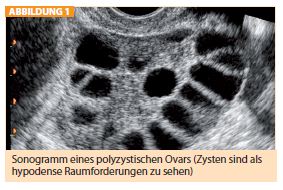
Die Diagnose eines PCOS erfolgt klinisch und ergibt sich aus den genannten Symptomen: Menstruationsstörungen und starke Körperbehaarung. Goldstandard der Diagnose ist der Ultraschall, in dem die Zysten sehr gut darstellbar sind (Abb. 1). Als biochemische Marker des PCOS sind erhöhte Testosteronn und Androstendion-Werte zu bezeichnen. DHEA-S (Dehydroepiandrosteronsulfat) und der LH/FSH-Quotient (> 2) sind bei diesen Patientinnen oft zusätzlich erhöht.
Pathophysiologie
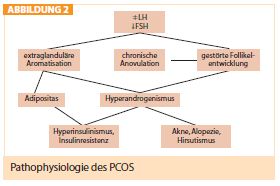
Häufige Kombination mit Insulinresistenz: Die Pathophysiologie des PCOS ist noch nicht klar (Abb. 2). Es kommt aber sehr häufig in Kombination mit einer Insulinresistenz vor, was auch das häufige Auftreten des PCOS zusammen mit einem Diabetes mellitus Typ 2 erklärt. Beim PCOS kommt es zu einer erhöhten Stimulation der Androgenproduktion in den Ovarien und Nebennieren. Gleichzeitig wird mehr LH sezerniert und die Synthese des Sexualhormon-bindenden Globulins (SHBG) in der Leber gehemmt. Daraus resultiert ein erhöhtes Angebot an Androgenen. Die Insulinresistenz, gefolgt von einer kompensatorischen Hyperinsulinämie, könnte auch als Ursache für Dyslipidämie und Hypertension verantwortlich sein und erklärt die Assoziation mit Adipositas sowie dem metabolischen Syndroms (Legro, Endocrine Reviews 2003; Palomba et al., Endocrine Reviews 2009).
Therapie
Es wird vermutet, dass ein Zusammenspiel genetischer Faktoren und des Umfelds die entscheidende Rolle in der PCOS-Entstehung hat. Allerdings ist bis jetzt kein bestimmtes Gen für PCOS detektiert worden, aber mehrere Faktoren des Lebensumfelds und Lebensstils, die die klinische Manifestation der genetischen Prädisposition steuern könnten, wie Adipositas, Ernährung oder Stress. Deshalb ist ein wichtiger Punkt bei der Therapie die Verbesserung der Insulinsensitivität und dadurch Hemmung der Insulinproduktion. Das kann durch eine Gewichtsreduktion durch eine entsprechende Diät und zusätzlich ausreichende Bewegung erzielt werden.
Weiters können – da meist eine Insulinresistenz zugrunde liegt – diese Maßnahmen ergänzend durch eine medikamentöse Therapie mit Insulinsensitizern unterstützt werden. Einige Studien konnten auch Therapieerfolge mittels Hemmung der Kohlenhydratresorption und dadurch Verminderung der postprandialen Hyperglykämie durch den Einsatz von Acarbose zeigen. Als andere Therapioptionen bieten sich antiandrogene Antibabypillen, falls kein Kinderwunsch vorliegt. Im Falle eines Kinderwunsches kommen außer der schon erwähnten Gewichtsabnahme und von Steigerung des Bewegungsausmaßes noch Medikamente wie Clomifen, Gonadotropine und Glukokortikoide zum Einsatz. Um einen Eisprung und einen halbwegs regelmäßigen Zyklus zu erzeugen, wird in der Kinderwunschbehandlung bei PCOS oft eine synthetische Eisprungauslösung (Ovulation), z. B. mit Clomifen, bevorzugt. Sollte nach 6 Zyklen kein “Erfolg” eingetreten sein, kann versucht werden, durch eine Hormontherapie mit HCG den Eisprung auszulösen.
Antidiabetika und PCOS:
Metformin gilt derzeit als Goldstandard in der medikamentösen Ersttherapie beim Typ-2-Diabetes, so keine Kontraindikationen vorliegen. Es vermindert die hepatische Glukoseproduktion und verbessert die Glukoseaufnahme. Diamanti-Kandarkis et al. (Eur J Endocrinol 1998) berichteten über den positiven Effekt von Metformin mit Verminderung der Hyperandrogenämie auch bei nicht-diabetischen PCOS-Patientinnen. Obwohl derzeit für die PCO-Therapie nicht offiziell zugelassen, wird Metformin oft in dieser Indikation eingesetzt; klinische Studien konnten allerdings zeigen, dass unter Metformin-Therapie bessere Schwangerschafts- und Ovulationsraten erreicht, im Vergleich zu Placebo jedoch keine Besserung der Lebendgeburtsraten verzeichnet wurden, wie in einem rezenten Cochrane-Review berichtet wird (Tang, Cochrane Review Database Syst Rev 2009). Eine retrospektive Analyse mit 399 Frauen, von denen 220 Metformin bekommen haben, bestätigt die oben genannten positiven Effekte (Kumbak et al., Acta Obstet Gynecol Scand 2009). Nachteile von Metformin sind die Nebenwirkungen wie Diarrhö, Dyspepsie und Übelkeit und Notwendigkeit des Absetzens bei Gravidität. Metformin sollte zur Minimierung der gastrointestinalen Nebenwirkungen in der ersten Woche nur in halber Dosierung eingenommen werden, die Dosissteigerung ggf. langsam erfolgen.
Insulinsensitizer (Glitazone): Einige Observationsstudien mit kleiner Fallzahl ergaben eine Minderung der ovariellen Androgen-Biosynthese und daraus folgend eine Besserung der Hyperandrogenämie (Aroda et al., JCEM 2009). Eine andere Studie von Ota et al. (Fertil Steril 2008) berichtet über eine 50%ige Abortrate. Den medikamentösen Ansätzen ist gegenüberzustellen, dass bei einer Gewichtsreduktion von lediglich 2-5% des Körpergewichtes eine Reduktion der Hyperinsulinämie und Hyperandrogenämie sowie des Hirsutismus erreicht und eine Ovulation ausgelöst werden konnte. In 50% der Fälle normalisierte sich der Zyklus und in 10% der Fälle kam es zur Schwangerschaft.
Postprandiale Blutzuckersenkung: Acarbose reduziert die Kohlenhydrataufnahme durch Hemmung der Aktivität der Alpha-Glukosidase in der Darmschleimhaut. Klinische Studien berichteten über eine Reduktion der Insulinresistenz und Hyperandrogenämie nach einer 3-monatigen Therapie mit Acarbose (De Leo et al., Endocrine Reviews 2003). GLP-1-Analoga: Eine interessante Studie mit 60 Frauen mit PCOS, die 24 Wochen lang entweder Exenatid, Metformin oder die Kombinationstherapie bekommen haben, konnte zeigen, dass trotz stärkerer Gewichtsreduktion unter Exenatid-Therapie die Kombination von Exenatid mit Metformin am besten geeignet war, um einen regelmäßigen Zyklus und eine Ovulation, in Kombination mit einer Verbesserung der Insulinsensitivität, zu erreichen (Elkind-Hirsch et al., JCEM 2008).
Operative Therapieoptionen: 1935 wurde erstmals von Stein und Leventhal die Keilresektion der Ovarien als mögliche Therapieoperation beschrieben, die aber heutzutage eher selten angewandt wird. Die Minilaparotomie wird dagegen vermehrt eingesetzt. Dabei erfolgt eine Laser-Stichelung der Ovarien. Minimal invasive chirurgische Verfahren wie die transvaginale Hydrolaparoskopie sind in Erprobung.
Gender und Adipositas
Obwohl die Ursache des PCOS nicht genau bekannt ist, dürfte eine genetische Komponente eine wichtige Rolle spielen, gefolgt von Lebensstil und Lebensumfeld. Das PCOS kann als eine weiblich-männliche Form des metabolischen Syndroms betrachtet werden. Genetische Faktoren, Lebensstil und mangelnde Bewegung führen zur Entwicklung einer Insulinresistenz bzw. einem Insulinsekretionsdefekt, was eine Kaskade ungünstiger Veränderungen im Körper auslöst: Es kommt zur Entwicklung von Hyperglykämie und gestörter Glukosetoleranz (so genannter Prä-Typ-2-Diabetes), Dyslipidämie (erhöhte Triglyzeride und LDL-Cholesterin, niedriges HDL-Cholesterin), arterieller Hypertension und endothelialer Dysfunktion mit Inflammation und Gerinnungsstörung. Alle diese Ereignisse führen im Endeffekt zur Gefäßschädigung mit einem erhöhten kardiovaskulären Risiko. Bei allen betroffenen Patientinnen sollte nach der Diagnosesicherung und Therapieeinleitung durch den betreuenden Gynäkologen in Kooperation mit einem Internisten frühzeitig auch eine Behandlung des metabolischen Syndroms begonnen werden, um kardiovaskulären Erkrankungen (Herzinfarkt, Schlaganfall etc.) vorzubeugen. Bei Patientinnen mit PCOS ohne begleitende Adipositas bzw. ohne metabolisches Syndrom dürfte das kardiovaskuläre Risiko nach derzeitigem Wissen eher nicht erhöht sein.
Univ.-Prof. Dr. Alexandra Kautzky-Willer, Dr. Lana Kosi
Klinische Abteilung für Endokrinologie und Stoffwechsel, Universitätsklinik für Innere Medizin III, MUW