SABCS-Highlights 2012: Weg der Wissenschaft in die Klinik
Das 35. SABCS fand vom 4. bis 8. Dezember 2012 in San Antonio statt. Jährlich trifft sich in Texas ein internationales Publikum von Medizinern und Wissenschaftlern aus über 100 Ländern, um die aktuellsten wissenschaftlichen Erkenntnisse zur Biologie, Ätiologie, Prävention, Diagnose und Therapie des Mammakarzinoms zu hören und diskutieren. Wir haben österreichische Experten um eine Auswahl ihrer Kongresshighlights gebeten.
Chirurgische Therapie
1. Kann die Sentinelbiopsie nach neoadjuvanter Chemotherapie beim nodalpositiven Mammakarzinom die Axilladissektion verhindern? Den Ergebnissen der ACOSOG-Z1071-Studie zufolge könnte bei manchen Frauen mit nodal positivem Brustkrebs, die eine neoadjuvante Chemotherapie erhalten, auf eine Axilladissektion verzichtet werden.1a
In die Studie wurden 637 Patientinnen mit histologisch verifiziertem axillärem Lymphknotenbefall eingeschlossen. Nach neoadjuvanter Chemotherapie wurde im Rahmen der Operation zuerst eine Sentinellymphknotenbiopsie gefolgt von einer kompletten Axilladissektion durchgeführt. In 60 % der Fälle wurde noch ein Lymphknotenbefall nachgewiesen, 40 % waren nodal negativ. Es ist anzunehmen, dass diese Frauen keinen Vorteil aus der Axilladissektion ziehen konnten.
Der korrekte Lymphknotenstatus konnte mittels Sentinelbiopsie in 91 % der Fälle ermittelt werden. Allerdings betrug die falsch-negative Rate 12,6 %, die somit höher war als der definierte Endpunkt von 10 %. In einer Subgruppenanalyse der Patientinnen, bei denen die duale Detektionsmethode angewandt wurde und bei denen mindestens 3 Sentinellymphknoten entfernt wurden, konnte die Falsch-negativ-Rate auf 10,8 % bzw. 9,0 % gesenkt werden. Weitere Faktoren, die mit der Falsch-negativ-Rate assoziiert sind, sollten gefunden werden, bevor die SLN-Biopsie bei diesen Patientinnen zum Einsatz kommen kann.
Eine deutsche prospektiven Studie (SENTINA)1b zu diesem Thema wurde ebenfalls am Kongress präsentiert. Den Ergebnissen von SENTINA zufolge kann bei Patientinnen, die klinisch nodal positiv und nach neoadjuvanter Chemotherapie nodal negativ erscheinen (cN1 → ycN0), aufgrund der hohen Falsch-negativ-Rate der wiederholten Sentinel-Biopsie (14,2 %) nicht auf eine Axilladissektion verzichtet werden.
Chemotherapie
2. Kein Vorteil von Eribulin im Vergleich zu Capecitabine beim fortgeschrittenen Mammakarzinom: Eribulin (Halaven®) ist derzeit als Monochemotherapie zur Behandlung des (vorbehandelten) lokal fortgeschrittenen oder metastasierten Mammakarzinoms zugelassen.
In einer Phase-III-Studie (Studie 301) mit 1.102 randomisierten Patientinnen, die mit Anthrazyklin- und Taxan-haltiger Chemotherapie vorbehandelt waren, konnte Eribulin im direkten Vergleich mit Capecitabine nicht überzeugen. Die Daten wurden in einer Plenarsitzung von Studienleiter Peter A. Kaufman vom Norris Cotton Cancer Center in Lebonon, New Hampshire, vorgestellt.2
Der Studie gelang es nicht, eine statistisch signifikante Überlegenheit von Eribulin über Capecitabine in den primären Endpunkten Gesamtüberleben (15,9 vs. 14,5 Monate; p = 0.,056) und progressionsfreies Überleben (4.1 vs. 4.2 Monate; p= .305) nachzuweisen. In bestimmten Patientensubgruppen konnte dennoch ein Trend zu einer Verlängerung der Überlebenszeit gezeigt werden, besonders bei Patientinnen mit HER2-negativem Mammakarzinom (15,9 vs. 13,5 Monate; HR 0,702) und triplenegativer Erkrankung (14,4 vs. 9,4 Monate; HR 0,702). Der Unterschied war jedoch nicht signifikant. Um genauer zu eruieren, welche Patientin von Eribulin profitieren könnte, sind weitere Studien nötig.
Unerwünschte Ereignisse entsprachen dem bekannten Nebenwirkungsprofil der beiden Zytostatika. Die Rate an schwerwiegenden Nebenwirkungen war 17,5 % in der Eribulin- und 21,1 % in der Capecitabinegruppe. Die Inzidenz von Neutropenien war bei Eribulintherapie deutlich höher (54 % vs. 16 %). Febrile Neutropenien waren hingegen auch bei Eribulin selten (2 % vs. < 1 %). Das Hand-Fuß-Syndrom trat, wie erwartet, unter Capecitabine bei 45 % (14 % Grad 3 und 4) und in der Eribulingruppe nur bei 1 % der Frauen auf. Eine Alopezie wurde unter Eribulintherapie deutlich häufiger beobachtet (34,6 % vs. 4,0 %).
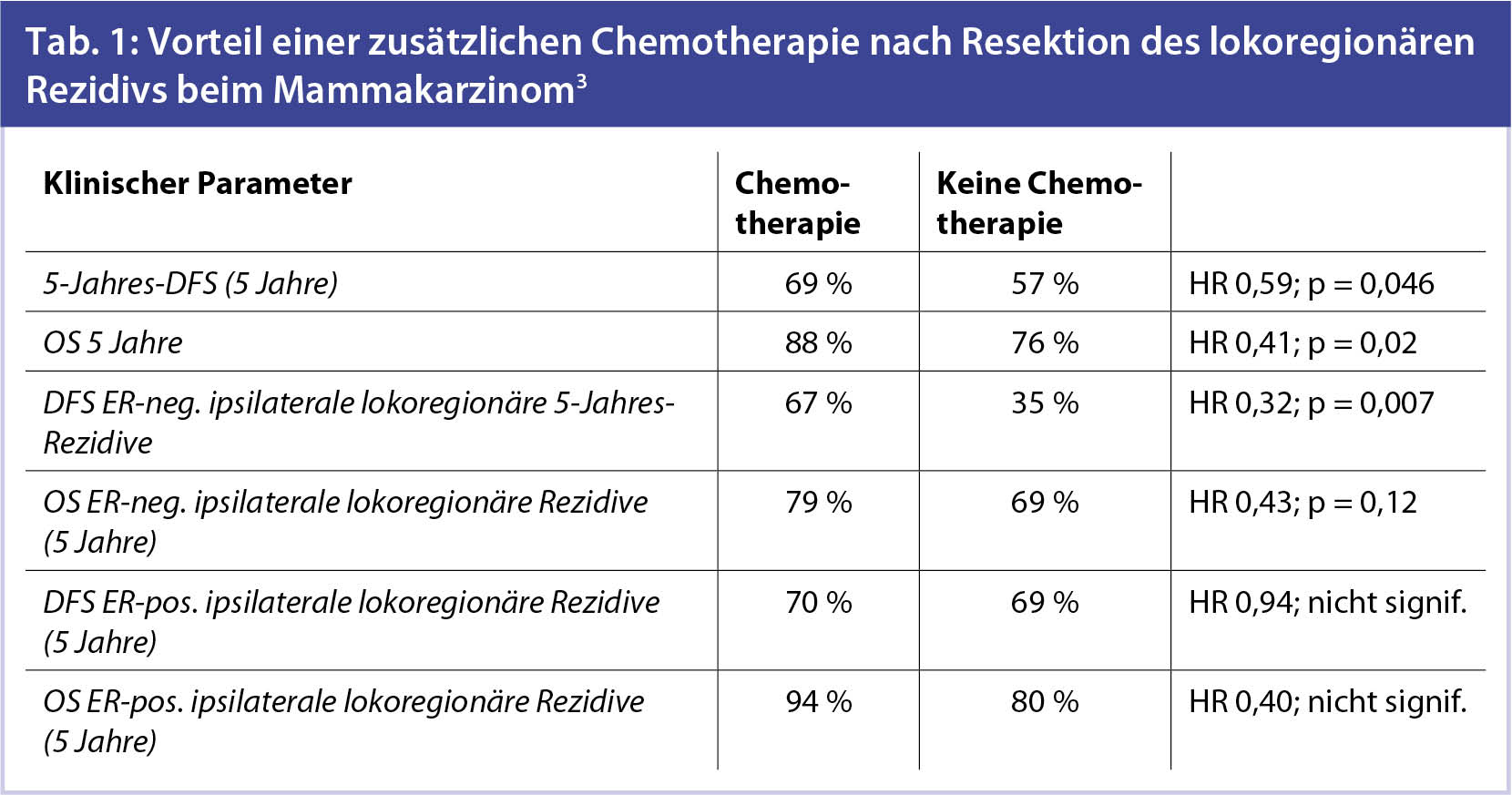
3. Chemotherapie ja oder nein nach operiertem isolierten Lokalrezidiv der Mamma – Ergebnisse der randomisierten CALOR-Studie3: In diese randomisierte Studie wurden aufgrund der niedrigen Rekrutierungsrate nur 162 Patientinnen eingeschlossen. Das mediane Alter betrug 56 Jahre und das mediane DFS 5,5 Jahre. 64 % der Patientinnen hatten eine adjuvante Chemotherapie erhalten. Das Studienkollektiv war wie folgt zusammengesetzt: Ipsilaterale Rezidive in der Brust waren bei 54 %, ipsilaterale Thoraxwandrezidive/Rezidive in der Mastektomienarbe bei 33 % und regionäre Lymphknotenrezidive bei 13 % vorhanden. Alle Rezidive waren operativ entfernt worden, bevor die Randomisierung stattgefunden hat. Die mediane Nachbeobachtung betrug 4,9 Jahre. Nach den Ergebnissen dieser Studie (Tab. 1) sollte Patientinnen nach Resektion eines lokoregionären Rezidivs eine additive Chemotherapie empfohlen werden. Dies insbesondere dann, wenn das Rezidiv hormonunempfindlich ist.
4. Mammakarzinom mit ≥ 4 positiven Lymphknoten – welche ist die effektivste Therapieoption?4 Die Randomisation der 1.284 Frauen unter 65 Jahren, die ≥ 4 positive axilläre Lymphknoten aufwiesen, erfolgte wie folgt: Arm A (experimentell): 3 x Epirubicin 150 mg/m2, Paclitaxel 225 mg/m2, Cyclophosphamid 2.500 mg/m2 alle 2 Wochen mit G-CSF-Gabe vom Tag 3–10; Arm B (Standardarm): 4 x konventionell dosiertes Epirubicin/Cyclophosphamid (90/600) gefolgt von 4 x Paclitaxel 175 mg/m2 alle 3 Wochen ohne G-CSF-Unterstützung. Im experimentellen Arm erfolgte eine 2. Randomisierung. Dabei erhielt die Hälfte der Patientinnen Erythropoetin alpha 150 E/kg s. c. 3 x/Woche, um die Zahl der Bluttransfusionen zu reduzieren. Die mediane Nachbeobachtung betrug 122 Monate. Das DFS und Gesamtüberleben (OS) war unabhängig von der Anzahl positiver Lymphknoten signifikant besser im experimentellen Therapiearm (DFS: 56 % versus 47 %; p = 0,00014; OS 69 % versus 59 %; HR 0,72; p = 0,0007). 9 versus 2 Fälle von myelodysplastischem Syndrom traten im experimentellen und Standardtherapiearm auf. Im experimentellen Arm erhielten 13 % Bluttransfusionen gegenüber 28 % im Standardtherapiearm (p < 0,0001). Das 10-Jahres-DFS betrug im experimentellen versus Standardtherapiearm 55 % und 57 % (p = 0,69) und das 10-Jahres-OS 68 % und 70 % (p = 0,45). Die dosisdichte und dosisintensivierte sequenzielle Chemotherapie mit Epirubicin/Paclitaxel/Cyclophosphamid alle 2 Wochen mit G-CSF-Untersützung vom Tag 3–10 führte beim Hochrisiko-Mammakarzinom zu einer Erhöhung des DFS und OS von ca. 10 %. Allerdings war die Rate an myelodysplastischem Syndrom erhöht.
Fazit: Beim Hochrisiko-Mammakarzinom mit ≥ 4 Lymphknotenmetastasen und gutem Karnofsky-Status stellt eine dosisintensivierte und dosisdichte Chemotherapie mit Epirubicin, Paclitaxel und Cyclophosphamid eine relevante Therapieoption dar.
5. Neoadjuvante Chemotherapie bei Frauen < 35 Jahren – Ergebnisse der Metaanalyse von 8 deutschen Studien5: In 8 neodjuvanten Therapiestudien mit operablem oder lokal fortgeschrittenem, nicht-metastatischem Mammakarzinom wurden insgesamt 8.949 Frauen behandelt. Eine Subgruppe von 704 Patientinnen war 35 Jahre oder jünger. Die Majorität der Patientinnen war 36–50 Jahre alt (n = 4.167) und 4.078 Frauen ≥ 51 Jahre alt. Es wurden die Rate an kompletter pathologischer Remission (pCR) (ypT0, ypN0) sowie das tumorfreie Überleben untersucht. In der Gruppe der sehr jungen Patientinnen < 35 Jahren war der Luminal-A-Subtyp seltener (Tab. 2). Die pCR-Rate war in der Gruppe der sehr jungen Frauen signifikant höher (24 % versus 13,5 %; p 0,001). Junge Patientinnen < 35. Lebensjahr wiesen ein signifikant schlechteres tumorfreies Überleben (DFS) auf als ältere Patientinnen (Hazard Ratio 0,83; 95%-Vertrauensintervall 0,70–0,98; p = 0,031). Das lokalrezidivfreie Überleben war ebenso ungünstiger für junge Patientinnen als für ältere (HR 0,74; p = 0,018). Frauen ≤ 35 Jahren mit hormonrezeptorpositiven, HER2-neu-negativen Karzinomen, die eine pCR erreicht haben, wiesen ein besseres DFS als Frauen < 35 Jahren mit fehlender pCR auf.
6. Neuer Wirkstoff hält drastisch fortgeschrittenen Brustkrebs auf: PD 991 ist ein von der Firma Pfizer hergestellter oraler selektiver CDK4/6-Inhibitor, der die DNA-Synthese in Zellen unterbricht, indem im Zellzyklus der Übergang von der G1- zur S-Phase gehemmt wird.
Eine Phase-II-Studie testete PD 991 in Kombination mit dem Aromataseinhibitor Letrozol versus Letrozol allein beim fortgeschrittenen Östrogenrezeptor-(ER)-positiven/HER2-negativen Mammakarzinom. Eine Zwischenanalyse6 zeigte ein beeindruckendes Ergebnis: Das mediane progressionsfreie Überleben (PFS) wurde mit Letrozol plus Prüfpräparat im Vergleich zu Letrozol allein bedeutend verlängert (26,1 Monate vs. 7,5 Monate). Die Hazard Ratio zugunsten der Kombination betrug 0,37 (95%-KI, 0,21 bis 0,63, p < 0,001).
Die Kombinationstherapie zeigte sich außerdem gut verträglich. Neutropenie und Leukopenie Grad 1 bis 3 zählten zu den häufigsten Nebenwirkungen, aber ohne klinische Relevanz. Febrile Neutropenien wurden nicht beobachtet. Eine milde Alopezie (Grad 1) verursachte dünnere Haare, nicht aber kompletten Haarverlust.
Experten am SABCS warnten vor verfrühter Begeisterung, da sich in der Vergangenheit leider nicht jede Therapie positiv entwickelte, die in einer Phase-II-Studie beeindruckend erschien, wie im Falle der PARP-(Poly[ADP-ribose]-Polymerase)-Inhibition beim triple-negativen Mammakarzinom.
Pfizer plant für 2013 eine randomisierte Phase-III-Studie mit PD 991.
Antikörper
7. Kein zusätzlicher Vorteil durch Verlängerung der Therapiedauer mit Trastuzumab: Den Ergebnissen der HERA-Studie zufolge, einer internationalen multizentrischen Phase-III-Studie, wird die Gabe von Trastuzumab über 12 Monate die Standardtherapie im adjuvanten Setting beim HER2-positiven Mammakarzinom bleiben.
In die HERA-Studie wurden 5.102 Frauen mit einem HER2-positiven Brustkrebs im Frühstadium eingeschlossen. Nach Randomisierung erhielten sie entweder Trastuzumab 3-wöchentlich über ein Jahr oder 2 Jahre. Alle Frauen komplettierten ihre Primärtherapie bestehend aus Operation, Chemotherapie und Strahlentherapie wie indiziert. Die Verlängerung der Trastuzumabtherapie zeigte nun nach einer medianen Nachbeobachtungszeit von 8 Jahren keine Verbesserung des erkrankungsfreien Intervalls oder des Gesamtüberlebens.7 Das Auftreten einer symptomatischen (kongestiven) Herzinsuffizienz (primärer kardialer Endpunkt) war vergleichbar in beiden Studienarmen. Die Rate an asymptomatischen kardialen Dysfunktionen (sekundärer kardialer Endpunkt) war deutlich höher in der 2-Jahres-Gruppe als im 1-jährigen Therapiearm (7,2 % vs. 4,1 %). Die meisten kardialen Nebenwirkungen traten unter laufender Therapie auf und der Großteil zeigte sich nach Beendigung von Trastuzumab reversibel.
8. Antikörpertherapie mit Trastuzumab plus adjuvanter Chemotherapie beim HER2-positiven Mammakarzinom – Ergebnisse der gemeinsamen Auswertung des Gesamtüberlebens der NSABP-B-31- und NCCTG-N9831-Studie:8 4.045 Patientinnen mit HER2-positivem operablem Mammakarzinom erhielten Doxorubicin plus Cyclophosphamid (60/600) gefolgt von Paclitaxel mit oder ohne Trastuzumab. 45 % der Patientinnen wiesen Hormonrezeptor-positive Karzinome und 15 % negative Lymphknoten auf. Die mediane Nachbeobachtung betrug 8,4 Jahre. Die Hazard Ratio für das DFS betrug 0,63. Die Reduktion der Fernmetastasen war unabhängig vom Hormonrezeptorstatus (minus 9,6 %). Das Gesamtüberleben war für alle Subgruppen durch die Hinzunahme von Trastuzumab verbessert (Hazard Ratio 0,60). Der Antikörper bewirkte insbesondere bei den Hochrisikokategorien wie einem Befall ≥ 10 Lymphknoten (+ 16 %) und einer Tumorgröße > 5 cm (+ 12 %) eine besonders deutliche Verbesserung der Prognose.
9. Der VEGF-Antikörper Bevacizumab + Antihormontherapie in einer Phase-III-Studie als Erstlinientherapie beim metastasierten Mammakarzinom:9 Zwei Patientinnengruppen erhielten als Erstlinientherapie entweder Bevacizumab (15 mg/kg alle 3 Wochen) in der Kombination mit endokriner Therapie (Letrozol zu 90 % bzw. Fulvestrant zu 10 %) oder eine endokrine Therapie allein. Der ECOG-Status betrug 0–1 und 44 % der Patientinnen hatten eine adjuvante Chemotherapie erhalten. Das mediane PFS betrug 18,4 Monate versus 13,8 Monate (p = 0,14), während das mediane Gesamtüberleben mit 42 versus 41 Monate nicht signifikant unterschiedlich war.
Die Prävalenz der Anämie war höher im Bevacizumab-Arm (76 % versus 44 %), ebenso Fatigue (50 % versus 31 %), Blutungen (19 % versus 2 %), Hypertension (55 % versus 12 %) und Proteinurie (21 % versus 3 %). Grad-3- und Grad-4-Thrombosen waren ebenso im Arm der zielgerichteten Therapie signifikant höher (2 % versus 0 %; p = 0,057).
10. Bedeutet BEATRICE (BEvacizumab Adjuvant therapy in TRIple Negative Breast CancEr) das Ende von Bevacizumab in der Behandlung des Mammakarzinoms? Die internationale Phase-III-Studie BEATRICE prüft den Einsatz von Avastin® in Kombination mit einer Chemotherapie in der adjuvanten bzw. postoperativen Behandlung des triplenegativen Mammakarzinoms. David Cameron von der Edinburgh University, UK, präsentierte die ersten Ergebnisse der Studie.10 Diesen zufolge zeigte Bevacizumab keine signifikante Verbesserung des erkrankungsfreien Intervalls. Nach Meinung von am SABCS 2012 teilnehmenden Experten könnte dies das Ende für Avastin® in der Brustkrebstherapie einläuten. Die Frage stellte sich, ob Angiogenese-Inhibitoren beim Brustkrebs von Bedeutung sind.
Endokrine Therapie
11. Langzeittherapie mit Tamoxifen in der ATLAS-Studie – 10 versus 5 Jahre Tamoxifen adjuvant beim ER+-Mammakarzinom:11 Zwischen 1996 und 2005 wurden 6.846 Frauen mit ER+-Mammakarzinom, die bereits 5 Jahre Tamoxifen erhalten hatten, randomisiert. Die eine Gruppe erhielt Tamoxifen weiter für 5 Jahre, die andere erhielt keine Therapie (Kontrolle). Die Compliance betrug ca. 80 % nach 2 Jahren. Die Rezidivrate war signifikant niedriger in der Gruppe von Frauen mit 10 Jahren Tamoxifentherapie (p = 0,002) mit einem größeren Effekt nach 10 Jahren. Sowohl die Brustkrebs-bedingte Mortalität als auch die Gesamtmortalität wurden durch 10 Jahre Tamoxifen signifikant verbessert. Endometriumkarzinome traten etwas vermehrt auf (2,6 % versus 1,6 %), die Mortalität dadurch war jedoch nicht erhöht (0,2 % versus 0,2 %).
Eine adjuvante Tamoxifentherapie bis 10 Jahre ab Diagnosestellung ist mit zusätzlichem Nutzen in der Rezidivprophylaxe und Verbesserung der Mortalität assoziiert. Dies insbesondere in der 2. Dekade durch einen „Carry over“-Effekt.
12. Höhere Fulvestrant-Dosis verlängert progressionsfreies Überleben beim fortgeschrittenen Mammakarzinom: Angelo di Leo aus Prato, Italien, präsentierte die endgültigen Daten der CONFIRM-Studie.12 In dieser Phase-III-Studie erhielten 736 randomisierte postmenopausale Patientinnen mit einem Östrogenrezeptor-(ER)-positiven fortgeschrittenen Mammakarzinom entweder die Standarddosis von 250 mg Fulvestrant oder die experimentelle Dosis von 500 mg. Die aktuelle Überlebensanalyse zeigte eine statistisch signifikante Überlegenheit der doppelten Dosis von Faslodex® hinsichtlich PFS und OS. Im höher dosierten Studienarm konnte eine Verlängerung des medianen Gesamtüberlebens von 4,1 Monaten erzielt werden sowie die Reduktion des Mortalitätsrisikos um 19 %. Kein statistisch signifikanter Unterschied konnte bezüglich des Nebenwirkungs-/Sicherheitsprofils nachgewiesen werden. In beiden Behandlungsarmen wurden nur wenig schwere unerwünschte Ereignisse beobachtet.
Fulvestrant 500 mg als palliative Erstlinientherapie wird bereits in der täglichen Praxis eingesetzt.
Strahlentherapie
13. START-Studie (Standardization of Breast Radiotherapie) zeigt vergleichbare Effektivität bei kürzerer und intensiverer Bestrahlung: Die Langzeitdaten der britischen START-A- und START-B-Studie wurden von John Yarnold vom Institute of Cancer Research in London, UK, präsentiert.13 Den Ergebnissen nach einer fast 10-jährigen medianen Nachbeobachtungszeit zufolge ist die Bestrahlung der Brust mit einer Gesamtdosis von 40 Gy über 3 Wochen verabreicht ebenso effektiv wie eine Dosis von 50 Gy über eine Dauer von 5 Wochen.
Das hypofraktionierte Bestrahlungsregime mit 40 Gy in 15 Fraktionen verabreicht geht mit deutlich weniger unerwünschten Nebenwirkungen und Spätfolgen/Gewebeschäden einher als die Standardtherapie von 50 Gy Gesamtdosis in 25 Fraktionen. In beiden Gruppen zeigte sich eine vergleichbare Rate an lokoregionären Rezidiven. Yarnold berichtete, dass 15 Fraktionen über 3 Wochen schonender für das Brustgewebe wären und schon seit 2009 alle Patientinnen mit invasivem Mammakarzinom nach diesem Bestrahlungsregime behandeltet werden.
Adjuvantien
14. Zoledronsäure-Studie – Vitamin D als Prognosefaktor beim Brustkrebs: Die britische AZURE-Studie, die 2011 im NEJM publiziert wurde, verglich die Standardtherapie alleine mit der Standardtherapie plus dem Bisphosphonat Zoledronsäure bei 3.360 Patientinnen mit einem Mammakarzinom Stadium II bis III.
Vorläufige Biomarker-Daten der AZURE-Studie14 deuten darauf hin, dass Brustkrebspatientinnen mit ungenügendem Vitamin-D-Spiegel eine schlechtere Prognose nach Standardtherapie plus Zoledronsäure haben. Die Höhe des Vitamin-D-Spiegels korrelierte invers mit dem Rückfallrisiko.
Studienleiter Robert Coleman von der University of Sheffield, UK, empfahl die Bestimmung von Vitamin D im Blut und gegebenenfalls entsprechende Substitution. Unsicher ist jedoch, ob die Zufuhr von Vitamin D das Outcome verändern wird.
1 a) Boughey J. et al.: The role of sentinel lymph node surgery in patients presenting with node positive breast cancer (T0-T4, N1-2) who receive neoadjuvant chemotherapy – results from the ACOSOG Z1071 trial. SABCS 2012; Abstract S2-1. b) Kuehn T. et al.: Sentinel lymph node biopsy before or after neoadjuvant chemotherapy – final results from the prospective German, multiinstitutional SENTINA-trial. SABCS 2012; Abstract S2-2
2 Kaufman P.A. et al.: A phase III, open-label, randomized, multicenter study of eribulin mesylate versus capecitabine in patients with locally advanced or metastatic breast cancer previously treated with anthracyclines and taxanes. SABCS 2012; Abstract S6-6
3 Aebi S. et al.: Chemotherapy prolongs survival for isolated local or ergional recurrence of breast cancer: The CALOR trial (chemotherapy as adjuvant for locally recurrent breast cancer (IBCSG 27-02, NSABP B-37, BIG 1-02). SABCS 2012; Abstract S3-2
4 Möbus V. et al.: Ten year follow-up analysis of intense dose-dense adjuvant ETC (epirubicin, paclitaxel and cyclophosphamide) confirms superior DFS and OS benefit in comparison to conventional dosed chemotherapy in high-risk breast cancer patients with >4 positive lymph nodes. SABCS 2012; Abstract S3-4
5 Loibl S. et al.: Neoadjuvant chemotherapy in the very young 35 years or younger. SABCS 2012; Abstract S3-1
6 Finn R.S. et al.: Results of a randomized phase 2 study of PD0332991, a cyclin dependent kinase (cdk) 4/6 inhibitor, in combination with letrozole vs letrozole alone for the first-line treatment of ER+/HER2– advanced breast cancer. SABCS 2012; Abstract S1-6
7 Piccart-Gebhart M.J. et al.: HERA trial: 2 years versus 1 year of trastuzumab after adjuvant chemotherapy in women with HER2-positive early breast cancer at 8 years of median follow up. SABCS 2012; Abstract S5-2
8 Romond E et al.: Trastuzumab plus adjuvant chemotherapy for Her2-positive breast cancer: Final planned joint analysis of overall survival from NSABP B-31 and NCCTG N9831. SABCS 2012; Abstract S5-5
9 Martin M. et al.: Phase III trial evaluating the addition of bevacizumab to endocrine therapy as first-line treatment for advanced breast cancer – First efficacy results from the LEA study. SABCS 2012; Abstract S1-7
10 Cameron D. et al.: Primary results of BEATRICE, a randomized phase III trial evaluating adjuvant bevacizumab-containing therapy in triple-negative breast cancer. SABCS 2012; Abstract S6-5
11 Davies C. et al.: ATLAS – 10 versus 5 years of adjuvant tamoxifen in ER+ disase: Effects on outcome in the first and in the second decade after diagnosis. SABCS 2012; Abstract S1-2
12 Di Leo A. et al.: Final analysis of overall survival for the phase III CONFIRM trial: Fulvestrant 500 mg versus 250 mg. SABCS 2012; Abstract S1-4.
13 Yarnold J. et al.: The UK START (Standardisation of Breast Radiotherapy) Trials: 10-Year Follow-Up Results. SABCS 2012; Abstract S4-1
14 Coleman R.E. et al.: Vitamin D, but not bone turnover markers, predict relapse in women with early breast cancer: an AZURE translational study. SABCS 2012; Abstract S6-4