Therapie und Überleben nach präoperativer Chemotherapie
Brustkrebs ist in Österreich mit einem Anteil von rund 30 % aller Tumoren seit langem die häufigste Krebserkrankung bei Frauen. Jährlich werden in Österreich um die 4.000–5.000 Patientinnen mit Brustkrebs neu diagnostiziert und es versterben zwischen 1.500 und 1.600 Frauen in Österreich an Brustkrebs.1 Die neoadjuvante Chemotherapie hat in den letzten Jahren immer mehr an Bedeutung gewonnen, da ihre Verabreichung mittlerweile als sicher gilt, zumindest zu gleichen Überlebensraten führt wie die adjuvante Chemotherapie und durch ihre Anwendung auch bei großen Brusttumoren häufig die Brusterhaltung gelingt.2 Bei bis zu der Hälfte der Patientinnen, bei denen eine brusterhaltende Operation primär nicht möglich erscheint, ist sie nach einer neoadjuvanten Chemotherapie durchführbar.3 Nicht zu vergessen ist, dass die neoadjuvante Chemotherapie auch ein wichtiger Teil der klinischen Forschung ist.
Die Wertigkeit der pathologischen Komplettremission nach präoperativer Chemotherapie: Die pathologische Komplettremission zum Zeitpunkt der Operation, also die Eradikation des Mammakarzinoms, wird als das Idealresultat einer neoadjuvanten Chemotherapie erachtet und ist mit einer sehr guten Prognose vergesellschaftet. In der klinischen Realität erreicht allerdings die Mehrzahl der behandelten Patientinnen keine pathologische Komplettremission. Bei Östrogenrezeptor-positiven Tumoren liegt die Rate an pathologischen Komplettremissionen unter 10 %. Sogar bei Tumoren wie dem triplenegativen Mammakarzinom, die als chemosensitiv gelten, ist das Erreichen einer pathologischen Komplettremission für die Mehrheit der Patientinnen immer noch unwahrscheinlich.4
Die pathologische Komplettremission wurde dabei lange Zeit als der wichtigste prognostische Faktor für das rezidivfreie, das erkrankungsfreie und das Gesamtüberleben erachtet. Patientinnen, die eine pathologische Komplettremission erreichen, haben bessere Langzeitergebnisse.5
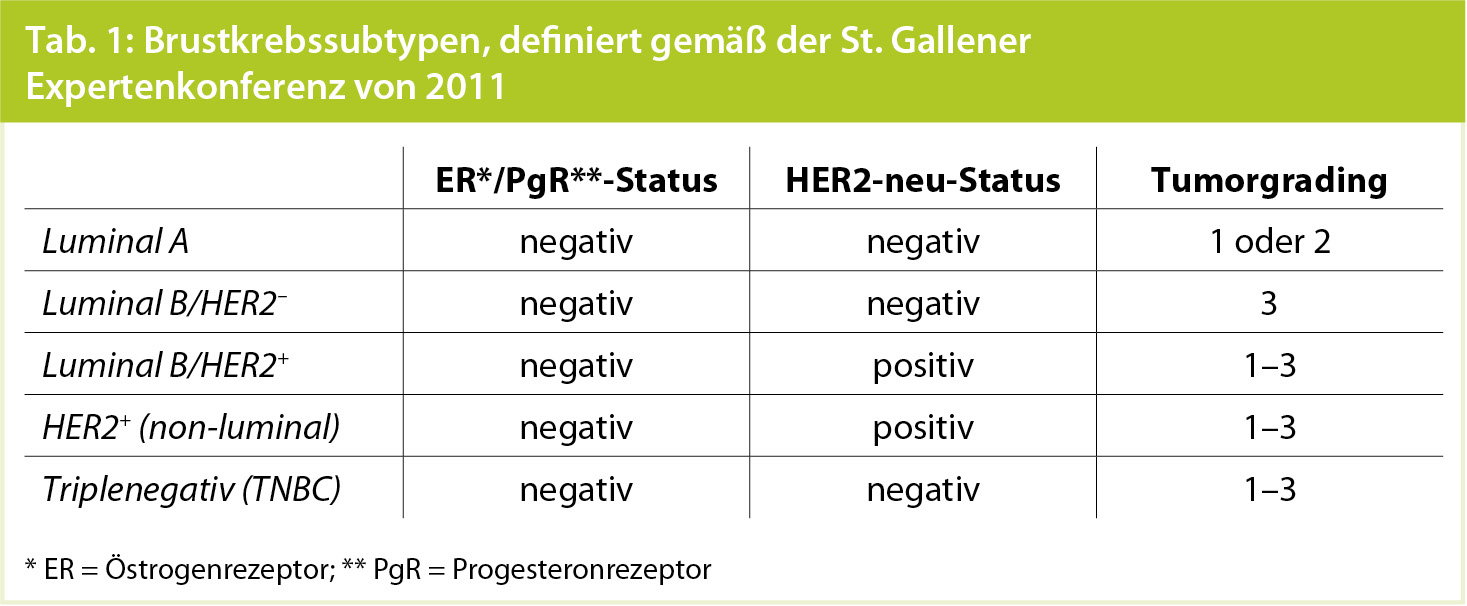
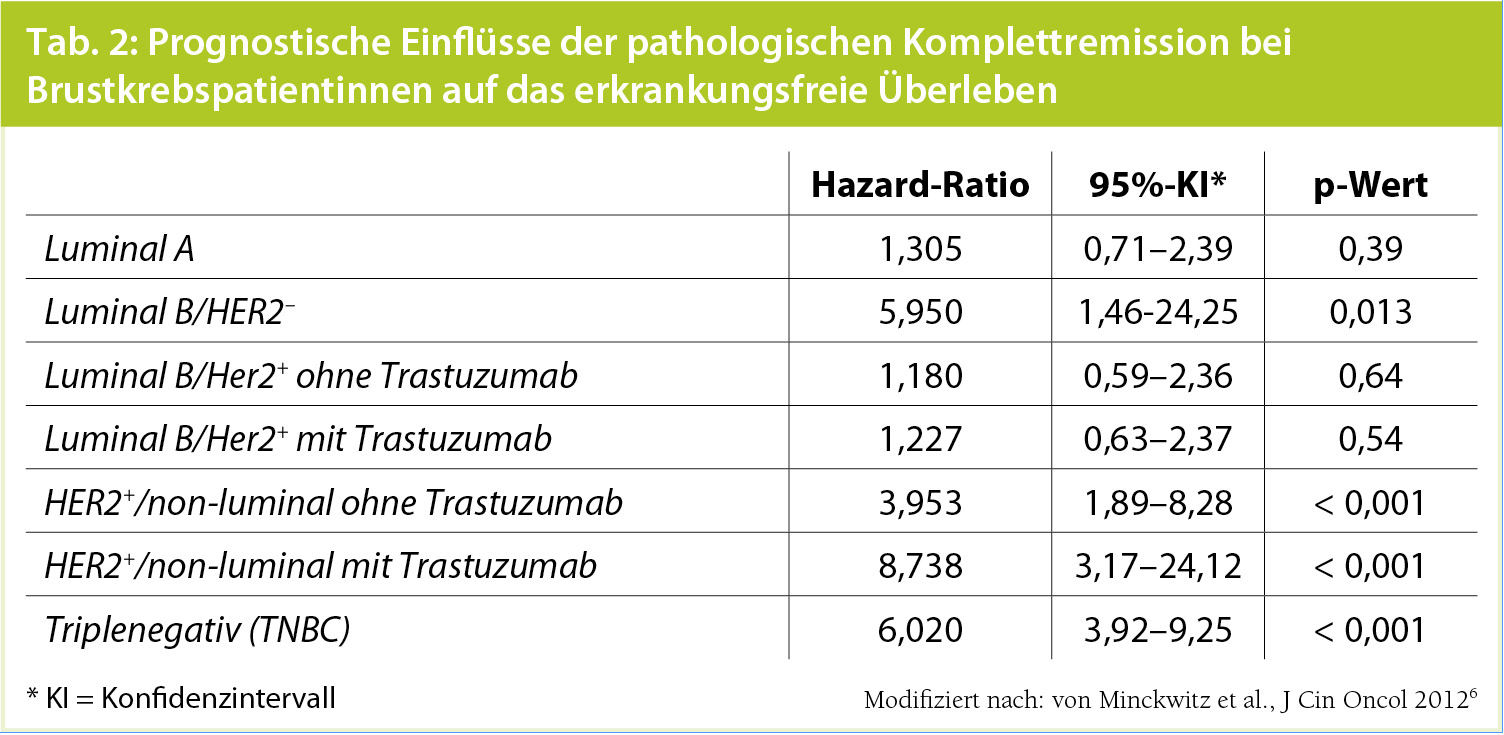
Einfluss des Brustkrebssubtyps auf die weitere Prognose: Nichtsdestotrotz impliziert das Auffinden eines residuellen Mammakarzinoms, also das Ausbleiben der pathologischen Komplettremission, nicht automatisch eine unvorteilhafte Prognose. Eine rezente Metaanalyse, die über 6.000 Frauen mit Zustand nach präoperativer Chemotherapie und Operation bei Brustkrebs einschloss und besonderes Augenmerk auf den Brustkrebssubtyp legte (Tab. 1), zeigte, dass nur Patientinnen mit Hormonrezeptor-negativen Tumoren (unabhängig vom HER2-neu-Status) oder Luminal-B/HER2-neu-negativen Tumoren tatsächlich eine signifikant schlechtere Prognose in Abwesenheit der pathologischen Komplettremission hatten (Tab. 2). Umgekehrt haben Patientinnen mit Luminal-A- oder Luminal-B/ HER2-neu-positiven Tumoren sowohl bei Erreichen als auch bei Ausbleiben der pathologischen Komplettremission eine ähnliche Prognose.6 Diese Erkenntnisse sollten Bestandteil der weiteren prognostischen Einschätzung sein, auch bezüglich der Wahl einer weiterführenden onkologischen Therapie.
Zwei mögliche Vorgehensweisen sollten bei den oben genannten Patientinnen mit erhöhtem Risiko angesprochen werden:
Erstens könnte man den betroffenen Patientinnen eine so genannte nicht-kreuzresistente adjuvante Chemotherapie anbieten. Dazu gibt es lediglich eine kleine Studie aus der Prä-Taxan-Ära, deren Ergebnisse kaum auf die heutigen Chemotherapieschemata umgelegt werden können.7 Weitere ähnliche Versuche aus der klinischen Forschung bieten ebenfalls keine Evidenz für solche Vorgehensweisen. Eine zusätzliche adjuvante Chemotherapie ist daher eine nicht evidenzbasierte klinische Maßnahme. Von ihr wird in mehreren Therapieempfehlungen abgeraten und sollte nur Patientinnen im Rahmen von klinischen Studien angeboten werden.2 Nichtsdestotrotz wählen viele Kliniker eine zusätzliche adjuvante Chemotherapie, wenn sie mit Patientinnen konfrontiert sind, die ein hohes Rezidivrisiko haben. Dabei werden häufig Schemata gewählt, die als nicht kreuzresistent zum präoperativen Schema erachtet werden. Tatsächlich gibt es sogar eine Studie, die ein solches Vorgehen als potenziell gefährlich identifiziert, mit einem möglichen nachteiligen Effekt auf das Überleben.9
Als zweite Option könnte man bereits in der präoperativen Situation einen frühzeitigen Wechsel weg von einem ineffizienten Chemotherapieschema vollziehen.2, 8 Zu dieser Fragestellung haben vor allem die Daten der zwei folgenden Studien neue Einblicke geliefert: In der „Aberdeen“-Studie konnte gezeigt werden, dass bei inadäquatem Ansprechen auf 4 präoperative Zyklen Cyclophosphamid, Doxorubicin und Vincristin ein Umstieg auf Docetaxel zu erhöhten Brusterhaltungsraten und Überlebensraten nach 3 Jahren führte.10 Aktuelle Therapieschemata beinhalten allerdings heute standardmäßig Taxane, weswegen diese Daten nur fraglich auf die derzeitige Situation umlegbar sind. Die zweite ganz aktuelle Studie, das GEPARTRIO, soll im Folgenden detailliert besprochen werden:
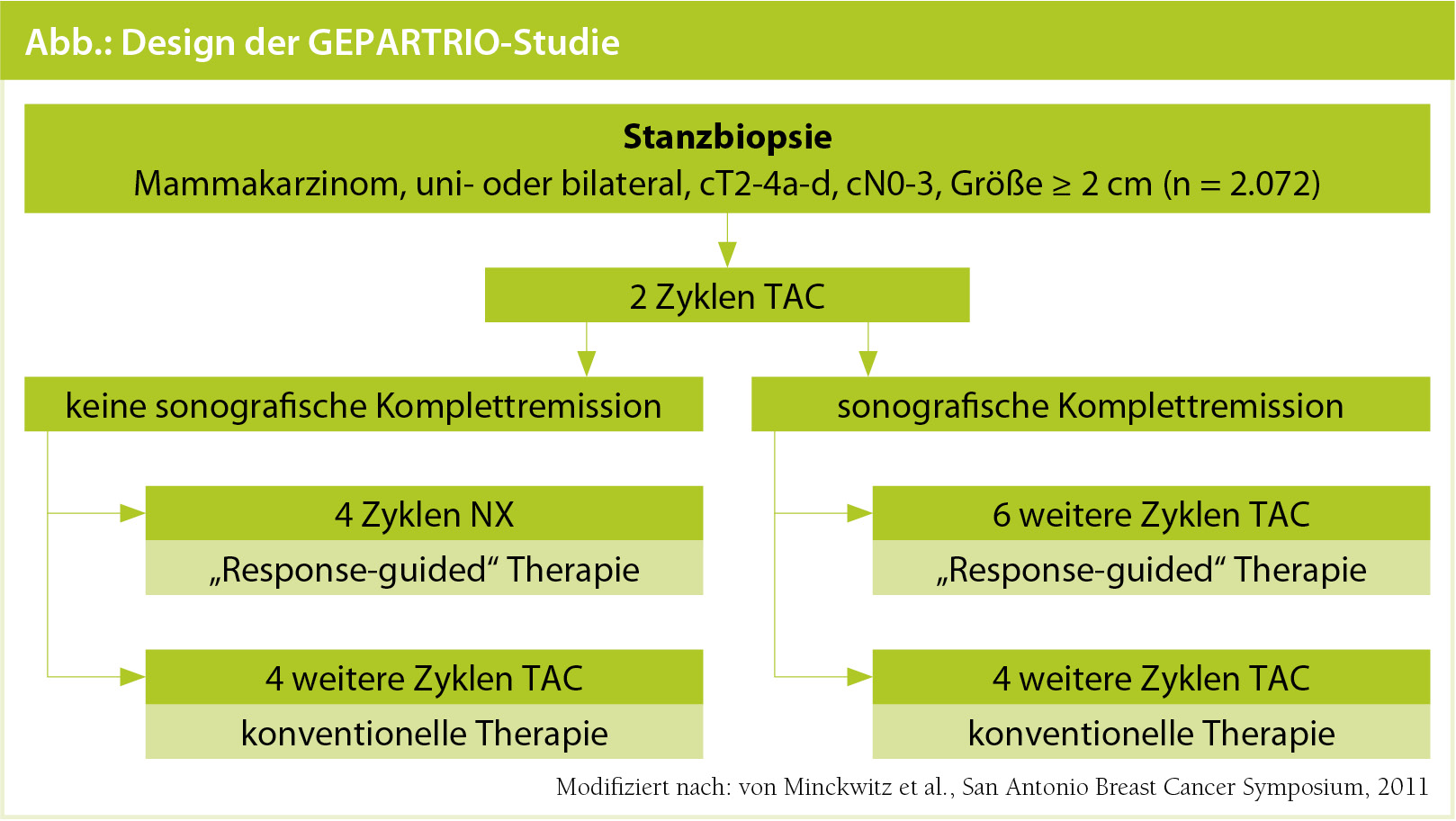
„Response-guided“ Therapie in der GEPARTRIO-Studie: In einer multizentrischen Phase-III-Studie wurde evaluiert, ob Patientinnen, die insuffizient auf 2 Zyklen präoperative Chemotherapie mit Docetaxel, Doxorubicin und Cyclophosphamid (TAC) reagiert hatten, von einer Umstellung auf Vinorelbin und Capecitabin (NX) profitieren würden. Genau gesagt, erhielten diese Patientinnen entweder 4 weitere Zyklen TAC (konventionelle Therapie) oder 4 Zyklen NX („Response-guided“ Therapie). Patientinnen mit einem adäquaten Therapieerfolg erhielten entweder weitere 4 (konventionelle Therapie) oder 6 („Response-guided“ Therapie) Zyklen TAC (Abb.). Bei den Patientinnen, die insuffizient auf die 2 initialen TAC-Zyklen reagiert hatten, führten beide Therapiearten (konventionell und „Response-guided“) zu gleichen Raten an pathologischen Komplettremissionen (TAC 5,3 % vs. NX 6,0 %). Im Hinblick auf die Nebenwirkungen wurde das NX-Schema besser toleriert. Bei Patientinnen, die auf 2 Zyklen TAC gut angesprochen hatten, führte eine verlängerte TAC-Therapie („Response-guided“ Therapie) ebenfalls zu keinen besseren Raten an pathologischen Komplettremissionen. Diese Frauen hatten allerdings mehr toxische Nebenwirkungen als diejenigen, die die Standardtherapie mit 6 Zyklen TAC erhalten hatten. Sekundärer Endpunkt der GEPARTRIO-Studie war es, das erkrankungsfreie und das Gesamtüberleben nach 6 Jahren zu evaluieren. Dabei zeigte sich allerdings, dass die „Response-guided“ Therapie das absolute erkrankungsfreie Überleben und Gesamtüberleben um 10 % und 6 % nach 6 Jahren verbesserte.6
In einer Post-hoc-Subgruppen-Analyse wurde ersichtlich, dass der Brustkrebssubtyp (definiert gemäß der St. Gallener Expertenkonferenz von 2011) signifikant mit erhöhten Raten an erkrankungsfreiem Überleben bei Patientinnen mit dem „Response-guided“-Therapiemodus assoziiert war. Tatsächlich war der Benefit der „Response-guided“ Therapie leider nicht in TNBC (triplenegativer Brustkrebs) oder Non-Luminal/ HER2-neu-negativen Tumoren zu erkennen. Diese Erkenntnis ist deswegen kritisch, da die deutsche Gruppe bereits zeigen konnte, dass der „unmet medical need“ vor allem bei eben diesen Tumoren liegt. Nur bei Luminal-B-Tumoren erscheint diese Therapiemodulation von Erfolg gezeichnet.6
ZUSAMMENFASSUNG: Die pathologische Komplettremission nach präoperativer Chemotherapie ist ein sehr guter prognostischer Faktor und ist assoziiert mit exzellenten Überlebensraten fast unabhängig vom biologischen Brustkrebssubtyp. Bei Patientinnen ohne Komplettremission sollte eine differenzierte Prognoseeinschätzung stattfinden. Diese ergibt sich einerseits aus der residuellen Tumorlast und andererseits aus dem Brustkrebssubtyp. Das Ausbleiben einer pathologischen Komplettremission nach präoperativer Chemotherapie ist bei Patientinnen mit Lum
inal-B/HER2-neu-negativen, Non-Luminal/HER2-neu-positiven und TNBC-Tumoren besonders ernst zu nehmen. Es existiert derzeit keine klinische Evidenz für eine zusätzliche postoperative Chemotherapie trotz dieses dokumentiert hohen Risikos.
Umgekehrt ist residueller invasiver Tumor in Luminal-A- oder Lumina-B/HER2-neu-positiven Tumoren vermutlich aufgrund der folgenden adjuvanten Therapien ein deutlich weniger negatives prognostisches Merkmal. Diese Erkenntnis sollte Bestandteil der weiteren prognostischen Einschätzung und Aufklärung der Patientin sein.