Neurogene orthostatische Hypotonie: eine Kurzübersicht
Der neurogenen orthostatischen Hypotonie (NOH) liegt eine Störung der peripheren und/oder zentralen noradrenergen Neurotransmission zugrunde. Das Kardinalsymptom ist der unmittelbar nach posturaler Belastung einsetzende systolische und diastolische Blutdruckabfall. Dieser ist häufig mit einem nur unzureichenden reflektorischen Herzfrequenzanstieg assoziiert. Das klinische Bild präsentiert sich mannigfaltig. Es reicht von einer asymptomatischen Präsentation bis hin zu wiederkehrenden Stürzen durch Synkopen. Daneben bemerken PatientInnen mit NOH häufig ein allgemeines Müdigkeitsgefühl, Konzentrationsschwäche, lageabhängige Dyspnoe sowie Nacken- und Schulterschmerzen1, 2 (Tab.). Die Symptomatik verschlechtert sich während Heißwetterperioden, Fieber, nach üppigen Mahlzeiten, langem Stehen sowie frühmorgens3. Interessanterweise ist die frühmorgendliche Symptomaggravation häufig durch eine nächtliche Diurese bei erhöhtem Liegendblutdruck bedingt4.
Als Hauptpathomechanismus wird die unzureichende Vasokonstriktion und die damit verbundene inadäquate periphere Widerstandserhöhung auf die physiologisch auftretende thorakale Hypovolämie im Rahmen einer posturalen Belastung diskutiert.
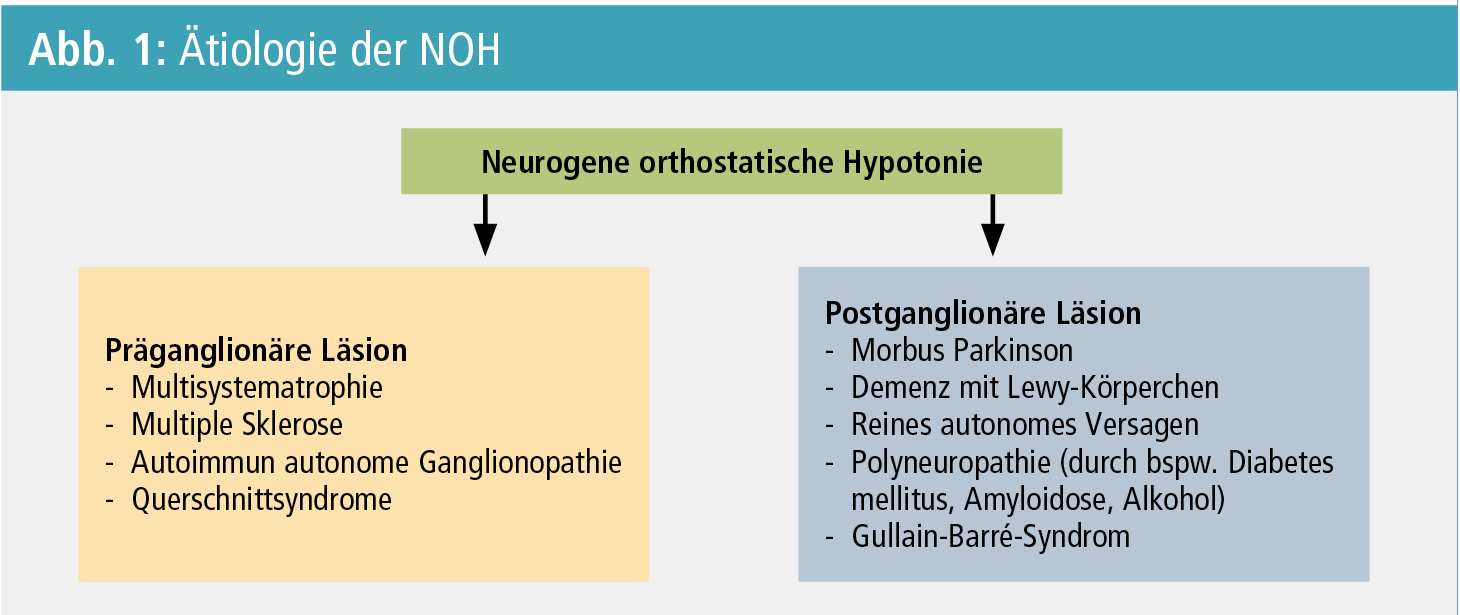
Ätiologisch kann zwischen einer präganglionären und einer postganglionären Läsion unterschieden werden. Prominente präganglionäre Beeinträchtigungen finden sich unter anderem bei der Multisystematrophie, der multiplen Sklerose sowie bei Querschnittsyndromen, wohingegen das reine autonome Versagen, der Morbus Parkinson, die Demenz mit Lewy-Körperchen, die autonome Beteiligung bei Polyneuropathie sowie das Guillain-Barré-Syndrom charakteristisch für eine postganglionäre Läsion sind (Abb. 1). Mittels kardialer 123I-Metaiodobenzylguanidin-Szintigraphie (MIBG-Szintigraphie) kann die Lokalisation der Läsion bildgebend unterschieden werden, und daher erscheint eine Durchführung der MIBG-Szintigraphie in der Differenzialdiagnose neurodegenerativer Parkinson-Syndrome sinnvoll5 (Abb. 2).
Diagnostik
Aktuelle Diagnosekriterien fordern einen Blutdruckabfall von mindestens 20 mmHg systolisch und/oder 10 mm Hg diastolisch innerhalb von 3 Minuten nach Kippung oder im verkürzten Schellong-Stehversuch6. Auf Grund der Tatsache, dass das Ausmaß des Blutdruckabfalls auch von den Ruhebedingungen beeinflusst wird, erscheint ein höherer Trennwert von 30 mm Hg systolisch bei PatientInnen mit erhöhten Blutdruckwerten in Rückenlage angebracht6. Zusätzlich kann die Diagnose einer NOH von einem Ausbleiben des reflektorischen Herzfrequenzanstiegs („Pulsstarre“) bei Lageänderung begleitet sein. Darüber hinaus scheint die Ausprägung und die Häufigkeit der OH bei präganglionären Läsionen mit dem Ausmaß der Hirnstamm-Pathologie assoziiert zu sein7.
Behandlung
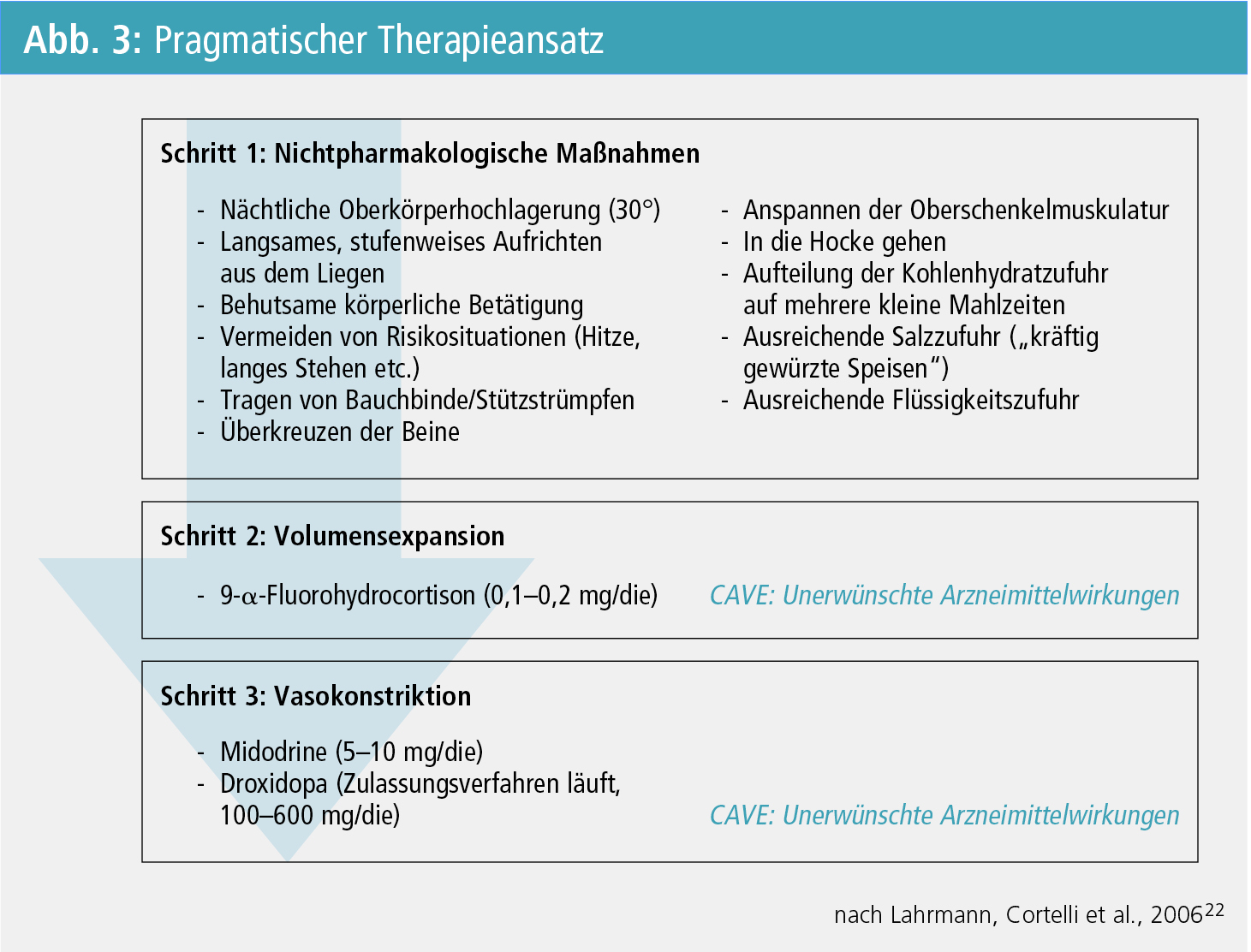
Die Behandlung der NOH ist von der klinischen Herausforderung geprägt, eine zufrieden stellende Symptomkontrolle zu erzielen, ohne iatrogene Entgleisungen des (Liegend-)Blutdrucks auszulösen – daher sollte die Therapie ausschließlich stufenweise erweitert werden8 (Abb. 3).
Nichtpharmakologische Therapieansätze: Physikalische Maßnahmen und Verhaltensmaßnahmen sind in der Behandlung der NOH unumgänglich. Insbesondere die nächtliche Oberkörperhochlagerung um 30 Grad, das Tragen einer Bauchbinde oder von Stützstrümpfen, ein langsames, stufenweises Aufrichten aus dem Liegen, regelmäßige behutsame körperliche Betätigung sowie das Vermeiden einer erschwerten Defäkation tragen zur Symptomlinderung bei9, 10. Darüber hinaus sollten PatientInnen über Möglichkeiten einer Überwindung plötzlich eintretender NOH-Symptome informiert werden. Dazu zählen das Überkreuzen der Beine, das Anspannen der Oberschenkelmuskulatur und das In-die-Hocke-Gehen11. Schließlich haben sich das Aufteilen der täglichen Kohlenhydrat-Zufuhr auf mehrere kleine Mahlzeiten12 sowie eine ausreichende Salz- und Flüssigkeitszufuhr in der Behandlung der NOH bewährt10, 13–16.
Pharmakologische Therapie: Die medikamentöse Therapie bedient sich zweier unterschiedlicher Angriffspunkte:
- der Volumensexpansion und
- der Vasokonstriktion.
Eine medikamentöse Volumensexpansion kann mit Fludrocortison (synthetisches Mineralokortikoid; 0,1–0,2 mg/d) erzielt werden; eine ausreichende Flüssigkeits- und Salzeinnahme ist hierbei unerlässlich17. Sollte dies nur einen unzureichenden Effekt bieten, ist eine Therapie mit Sympathomimetika bei NOH-PatientInnen unausweichlich. Midodrin (α1-Adrenorezeptor-Agonist; 5–10 mg/d) zeigte in zwei unabhängigen multizentrisch durchgeführten randomisiert kontrollierten Zulassungsstudien eine Reduktion des Blutdruckabfalls und eine Abschwächung der NOH-Symptomatik18, 19. Die derzeit in Phase-III-Studien geprüfte Noradrenalin-Vorläufersubstanz L-Dihydroxyphenylserine (L-DOPS, Droxidopa) konnte in Dosisfindungsstudien bei PatientInnen mit NOH im Rahmen einer neurodegenerativen Erkrankungen ihre Wirksamkeit zeigen20, 21.
Abschließend sei erwähnt, dass es weitere Medikamente gibt, die in seltenen Einzelfällen Anwendung finden. Es darf jedoch nicht außer Acht gelassen werden, dass es sich hierbei jedenfalls um Off-Label-Behandlungen handelt. Hinsichtlich ausführlicherer Informationen möchten wir diesbezüglich auf den Übersichtsartikel von Lahrmann und KollegInnen verweisen22.
Zusammenfassung: Die NOH führt zu einer erhöhten Morbidität und bedingt häufig eine deutliche Verschlechterung der Lebensqualität der Betroffenen. Die Diagnose NOH kann mithilfe eines Blutdruckmessgerätes und eines Orthostasetests (vereinfachter Schellong-Test) ohne eingehende autonome Testung diagnostiziert werden. Bei eindeutigen Symptomen und unauffälligen Orthostasetests ist eine ausführliche Kipptisch-Untersuchung jedenfalls indiziert. Die Therapie bedarf einer strukturierten Herangehensweise, wobei nichtpharmakologische Therapieoptionen die Grundlage darstellen und medikamentöse Therapieformen nur in Verbindung mit Allgemeinmaßnahmen angezeigt sind.