Bewusstseinswandel in der primären bildgebenden Diagnostik beim PCa
Kennen Sie den Unterschied zwischen einem 50-jährigen Mann mit Verdacht auf Leberkrebs und einem mit Verdacht auf Prostatakrebs? Der 50-Jährige mit Verdacht auf einen Lebertumor bekommt innerhalb kürzester Zeit eine aufwändigste bildgebende Diagnostik gefolgt von einer gezielten Biopsie – ein auch zeitlich meist mehrtägiger Aufwand. Da hat es der Patient mit Verdacht auf ein Prostatakarzinom schon besser – oder nicht? Ohne großen Aufwand wird – nahezu blind – seine Prostata 10 bis 14 Mal punktiert. Falls diese negativ ist, verlässt man sich weiter auf Labormarker.
Dieses Beispiel soll veranschaulichen, dass das Prostatakarzinom die letzte Tumorentität ist, bei der noch immer die „Random“ und nicht die gezielte Biopsie den Standard darstellt.
Ein Argument gegen die Etablierung eines zeitgemäßen Diagnosealgorithmus ist immer die sogenannte Überdiagnostik. Das heißt, dass man viele Tumoren findet, die eigentlich dem Patienten nicht mehr schaden werden. Aus diesem Gedanken heraus hat sich die Active Surveillance entwickelt. Rezente Arbeiten aus Schweden unterstreichen, dass dieser Weg sicherlich eine wichtige Säule im zukünftigen Management des PCa darstellt. So konnten einerseits Rider et al. in ihrer Untersuchung der nicht kurativ behandelten Patienten aus einer Kohorte des nationalen schwedischen Prostatakarzinomregisters bei einem Follow-up von 15 Jahren zeigen, dass vor allem bei Patienten mit einem lokalisierten Low-Risk-Karzinom die Morbidität in erster Linie von den Komorbiditäten und nicht vom Prostatakarzinom abhängt. Und etwas überraschend ist, dass diese Ausprägung am stärksten in der Gruppe < 65 Jahre zu sehen ist (prostatakrebsspezifische 10-Jahres-Mortalität 1,2 %).1 Andererseits berichten Godtman et al. die Ergebnisse der Active-Surveillance-Gruppe aus der Göteborg-Kohorte. Diese konnten zeigen, dass Active Surveillance bei Low-Risk-Patienten bei einem medianen Follow-up von 6 Jahren eine sichere Behandlungsalternative darstellt.2 Aber um einem Patienten diese Möglichkeit zu empfehlen, ist es essenziell, zu wissen, ob der aggressivste Herd der Prostata auch biopsiert wurde. Dies trifft natürlich auch zu, wenn man eine fokale Therapie plant.
Suffiziente Bildgebung vor initialer Biopsie
Aus den oben genannten Gründen geht klar hervor, dass eine suffiziente Bildgebung vor einer initialen Biopsie notwendig ist, um eine gezielte Biopsie durchführen zu können und um wirklich alle suspekten Herde auch zu biopsieren. Weiterentwicklungen der Sonographie wie die Elastographie oder die KM-Sonographie haben zwar die Sensibilität und die Spezifität der Biopsie verbessert, waren aber doch weit von Werten entfernt, die eine alleinige gezielte Biopsie zulassen würden. Darüber hinaus kam es auch nur zu einer sehr zögerlichen Verbreitung innerhalb der urologischen Community, nicht zuletzt durch die unterschiedliche Reproduzierbarkeit der Methoden. Ein Schicksal, das eine andere primär interessante Ultraschallevolution namens „HistoScanning™” teilt. 2008 erstbeschrieben finden sich bis heute in PubMed nur 4 Originalarbeiten mit einer sehr niedrigen Patientenanzahl. Rezent wird in einer Studie (31 Patienten, 6 Zentren), bei der vor einer radikalen Prostatektomie ein HistoScanning™ durchgeführt wurde, eine Sensitivität von 90 % und eine Spezifität von 72 % berichtet.3 Eine andere retrospektive Studie an 80 RPE-Patienten konnte einen möglichen Wert in der Diagnostik einer Kapselüberschreitung zur Planung einer nervenschonenden RPE feststellen.4 Nichtsdestotrotz fehlen hier klar prospektive randomisierte Studien zur Validierung dieser Trends.
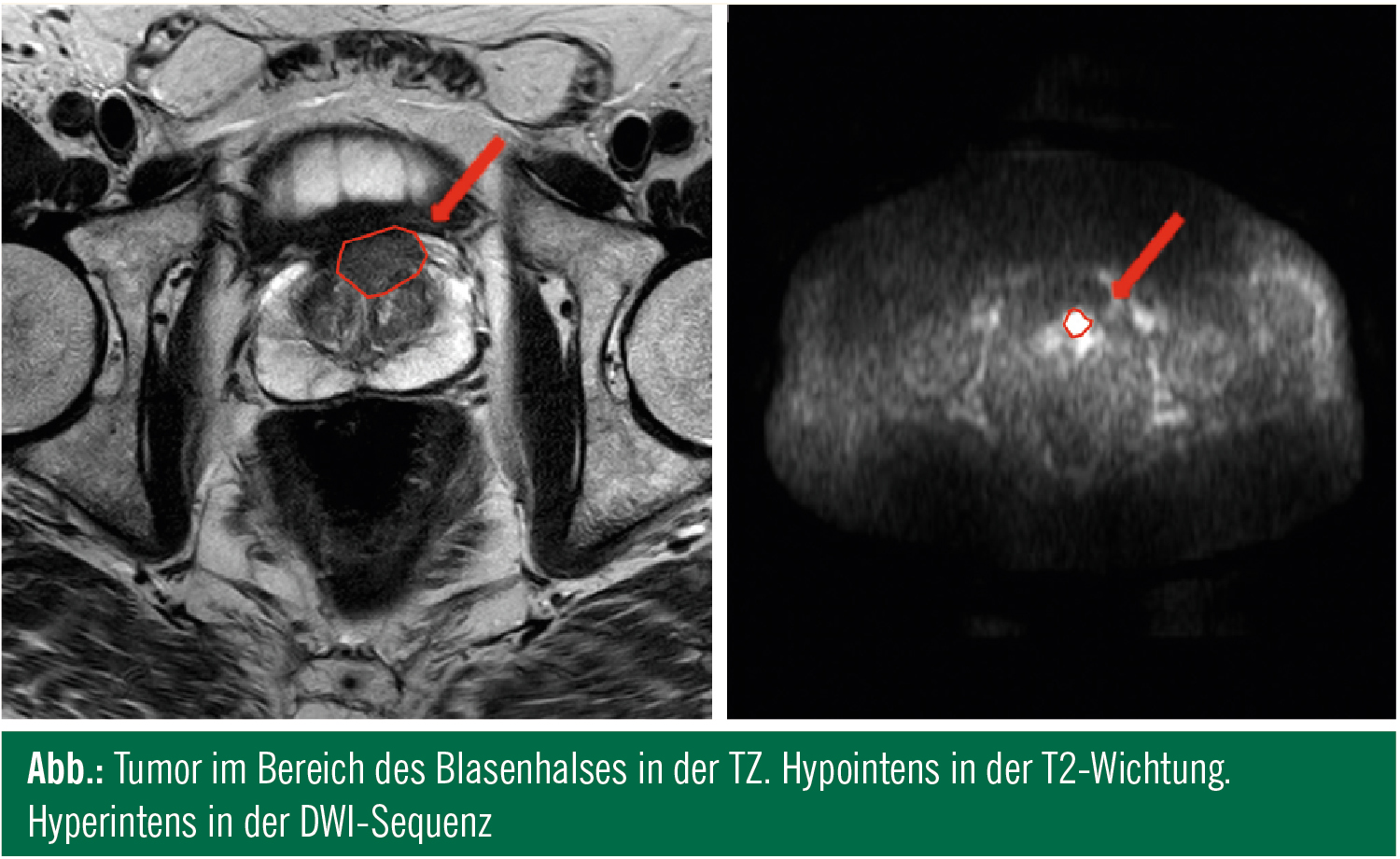
Anders beim MRI: Hier führte die Verbreitung von immer höher auflösenden MR-Tomographen zu einem deutlichen Innovationsschub. Diese Entwicklung wurde zusätzlich durch den Wegfall der Notwendigkeit der teuren und für den Patienten unangenehmen Endorektalspule getriggert. Die European Society of Urogenital Radiology hat erst kürzlich die Guidelines für die Prostatauntersuchung aktualisiert und gemeinsam mit der EAU einen Konsensus zur Interpretation und Befundung des multiparametrischen MRI der Prostata publiziert.5, 6 Eine State-of-the-Art-Untersuchung soll demnach mindestens mit einem 1,5-Tesla-Gerät durchgeführt werden und zumindest die folgenden Sequenzen beinhalten: T2-gewichtet (T2w), „dynamic contrast-enhanced“ (DCE), diffusionsgewichtet (DWI) inklusive ADC.
Die initial viel gelobte Spektroskopie wird nicht als obligat angesehen, da eine ausgesprochene Expertise des Untersuchers wie auch eine Endorektalspule notwendig sind. Die Sensitivität bei der Kombination der verschiedenen MR-Parameter liegt heute zwischen 70 und 80 %, aber die Spezifität – was wesentlich wichtiger ist – erreicht rund 97 %, wie erst kürzlich im BJUI in einer Studie an 57 Patienten, die sich einer radikalen Prostatektomie unterzogen, berichtet wurde.7 Bemerkenswert ist dabei, dass es sich in dieser Studie um ein 1,5-Tesla-Gerät handelte. Mittlerweile ist aber bereits das 3-Tesla-Zeitalter angebrochen. Hier konnte die Gruppe um Jelle Barentz bei 438 Patienten, die zu einer MRI-gezielten Rebiopsie der Prostata vorstellig wurden, eine Detektionsrate von 41 % berichten. Zusätzlich war bei dieser Studie interessant, dass 87 % dieser Tumoren als klinisch signifikant einzustufen waren.8
MRI-Histologie?
Eine Gruppe an der Weil-Cornell-Universität in New York berichtete kürzlich über die erste Anwendung eines 7-Tesla-MRI ex vivo an 12 Prostatektomiepräparaten. In beeindruckenden Bildern konnten sie zeigen, dass sich mittels dieser Methode Stroma, Gefäße, Drüsengänge und Karzinome wie in der klassischen Histologie darstellen und mittels der bekannten MR-Parameter sogar charakterisieren lassen. Sie schließen, dass die sogenannte „virtuelle Histologie“ eine Hilfe für den Pathologen wie auch für den Urologen sein kann und insgesamt zu einem neuen, besseren Verständnis für die Krankheit führen wird.9
TRUS/MRI-Fusion
Die bereits oben erwähnten Diagnoseleitlinien wurden jetzt erstmals aufwändig validiert. Eine französische Arbeitsgruppe evaluierte in einer prospektiven Studie 129 Patienten, die zu einer Rebiopsie zugewiesen wurden. Nach Durchführung eines 1,5-Tesla-mpMRI wurden die Patienten mit Hilfe von KoelisTM, einem System, das TRUS/MRI-fusionierte Bildgebung, Navigation und Dokumentation vereint, biopsiert. 1.514 Stanzen konnten so analysiert werden. Bei einer Detektionsrate der gezielten Biopsien von 37 %, welche frühere Studien bestätigt, wurde gezeigt, dass der ESUR-Score einen positiven Vorhersagewert (PPV) von 56,7 % und einen negativen Vorhersagewert (NPV) von 95 % hat. Die Gesamtgenauigkeit wurde mit 89,1 % angegeben.10
Diese beschriebene Biopsiemethode ist darüber hinaus auch ein Argument gegen die oft geäußerte Verlustangst der diagnostischen Prozedur. Eine direkt MRI-gezielte Biopsie ist aufwändig und wird aufwändig bleiben. Speziell die Patientenpositionierung, Echtzeitverfolgung der Nadel sowie das Erreichen sämtlicher Bereiche der Prostata sind hier ein Thema. Obwohl vordergründig attraktiv, ist diese Methode noch immer nur unter Spezialisten mit ausreichend zeitlichen Ressourcen verbreitet. Wir Urologen hingegen haben die Fähigkeit, insbesondere mit der perinealen Biopsie, TRUS-gezielt alle Bereiche der Prostata problemlos zu erreichen. Neue Technologien, wie das oben beispielhaft beschriebene KoelisTM System oder das auch bereits am Markt erhältliche BiopSee®-System, bei denen man ein MRI-Volumen mit zuvor markierten suspekten Herden in Echtzeit über das TRUS-Bild legen kann (TRUS/MRI-Fusion), ermöglichen uns bereits heute wie gewohnt, aber gezielt zu biopsieren.11, 12 Darüber hinaus speichern Systeme wie diese jede Biopsie ab und ermöglichen damit exakte Rebiopsien – wie zum Beispiel im Rahmen einer Active Surveillance – oder eine Markierung für eine fokale Therapie.
Zusammenfassend haben sich die apparative Ausstattung wie auch die Datenlage bei der bildgebenden Primärdiagnostik in den letzten Jahren dramatisch verbessert. Ob die Zeit für einen Bewusstseinswandel oder gar einen Paradigmenwechsel reif ist, wie ihn auch Urs Studer, Peter Albertsen oder Bertrand Tombal in äußerst lesenswerten Editorials fordern?13, 14 Die Antwort liegt in der nahen Zukunft. Diese mitzugestalten liegt – noch – in den Händen von uns Urologen. Die Betroffenen – die Patienten – werden den Ansatz einer gezielten individualisierten Diagnostik jedenfalls einfordern.
1 Rider JR et al., EurUrol 2012; Epub ahead of print
2 Godtman RA et al., Eur Urol 2012; Epub ahead of print
3 Simmons LA et al., BJU Int 2011; 110:28–35
4 Salomon G et al., BJU Int 2012; Epub ahead of print
5 Barentsz J et al., Eur Radiol 2012; 22:746–757
6 Dickinson L et al., Eur Urol 2012; 59:477–494
7 Delongchamps NB et al., BJU Int 2010; 107:1411–1418
8 Hoeks C et al., Eur Urol 2012; Epub ahead of print
9 Durand M et al., Eur Urol 2012; Epub ahead of print
10 Portalez D et al., Eur Urol 2012; Epub ahead of print
11 Kuru TH et al., Urologe A 2012; 51(1):50–6
12 Ukimura O et al., J Urol 2012; 187:1080–1086
13 Studer UE, Albertsen PC, Eur Urol 2012; Epub ahead of print
14 Tombal B, Eur Urol 2012; Epub ahead of print