ESMO 2012: Aktuelle Daten zum Nierenzell- und Prostatakarzinom

Wenige Monate nach dem ASCO wurden auf der Jahrestagung der European Society of Medical Oncology (ESMO) neue Daten zu uroonkologischen Tumoren, insbesondere Nierenzell- und Prostatakarzinomen, präsentiert, die das Potenzial haben könnten, die uroonkologische Praxis zu ändern. Wesentliche Durchbrüche beim Blasenkarzinom sind ausständig, die Diskussion hinsichtlich adjuvanter/neoadjuvanter Therapie geht weiter, Studien mit zielgerichteten Therapien beim metastasierten Blasenkarzinom laufen und sind in dieser Entität noch nicht angekommen, hieß es im Rahmen der Highlight-Sitzung des Kongresses. Zum Hodentumor hieß es, er sei „Opfer seines eigenen Erfolgs“: Surveillance im Stadium I sei mit einem exzellenten Outcome verbunden, die PEB-Standardtherapie in der First-Line-Behandlung sei schwer zu verbessern, und um randomisierte Second-Line-Studien durchzuführen, würde es mehr Patienten, heißt Kollaborationen, benötigen.
Nierenzellkarzinom
COMPARZ-Studie (first line): Gemäß den ESMO-Guidelines 2012 gibt es für Patienten mit gutem/intermediärem Risiko nach MSKCC-Klassifikation drei Optionen in der Erstlinientherapie: Sunitinib oder Bevacizumab + Interferon-α oder Pazopanib. Für Patienten mit ungünstigem Risikoprofil stellt Temsirolimus die Therapie der Wahl dar1. Auf die Frage, ob auf dem ESMO die Frage der Selektion der drei Therapieoptionen für Patienten mit gutem/intermediärem Risiko geklärt wurde, präsentierte Univ.-Prof. Dr. Manuela Schmidinger, Medizinische Universität Wien, die mit Spannung erwartete Phase-III-Studie COMPARZ2, in der erstmals Sunitinib (n = 553) und Pazopanib (n = 557) in einem Head-to-Head-Trial im Noninferiority-Design beim mRCC-Patienten verglichen wurden. Die Studie zeigte, dass die Wirksamkeit der beiden Substanzen im Sinne einer Nichtunterlegenheit hinsichtlich des primären Studienendpunkts progressionsfreies Überleben (PFS) in der Erstlinientherapie des metastasierten Nierenzellkarzinoms die gleiche ist. Das mediane PFS unter Pazopanib betrug 8,4 Monate verglichen mit 9,5 Monaten unter Sunitinib (HR = 1,047; 95%-KI: 0,898–1,220). Die objektive Ansprechrate (ORR) betrug im Pazopanib-Arm 31 %, im Sunitinib-Arm 25 %. Erwartungsgemäß fielen die Daten zur Lebensqualität zugunsten von Pazopanib aus. Für Pazopanib kann laut Schmidinger festgehalten werden, dass Pazopanib statistisch gesehen bezogen auf PFS und OS Sunitinib zumindest nicht unterlegen, und aufgrund der geringeren Off-Target-Toxizität besser verträglich ist. Als Limitation wird der Vergleich zwischen einer kontinuierlichen (Pazopanib) und intermittierenden (Sunitinib) Therapiedosierung gesehen. So wäre die Lebensqualität am schlechtesten Tag des Sunitinib-Zyklus (Tag 28; damit genau vor der 2-wöchigen Pause) erhoben worden. Des Weiteren handelte es sich bei einem Drittel der Patienten um Asiaten, die eine geringe Toleranz gegenüber TKI-assoziierten Nebenwirkungen zeigen würden.
RECORD-2/INTORACT (first line): Weiters wurde von Schmidinger die Frage in den Raum gestellt, ob nach dem ESMO die Frage geklärt ist, dass das bisher in der Erstlinientherapie Erreichte (PFS, OS) durch die Kombination der neuen Substanzen verbessert werden kann. Derzeit können mit den verfügbaren Erstlinienoptionen ein PFS von rund 11 Monaten und ein OS von bis zu 26,4 Monaten erzielt werden. Könnten diese Ergebnisse zum Beispiel mit der immer wieder angestrebten gleichzeitigen Inhibition verschiedener Targets im selben Pathway (vertikales Targeting) verbessert werden? Wenngleich Phase-I-Studien vielversprechend erschienen, wurden auf dem ESMO eine Phase-II- (RECORD-2; Ravaud A et al., #7830) und eine Phase-III-Studie (INTORACT; Rini BI et al., LBA21) präsentiert, die das Tor einer Kombinationstherapie in der Erstlinie nun doch wieder geschlossen haben. Beide (Negativ-)Studien untersuchten die Kombination von Bevacizumab mit einem mTor-Inhibitor vs. Bevacizumab + Interferon-α. Keine dieser Kombinationstherapien, d. h. weder die Kombination von Everolimus + Bevacizumab (RECORD-2) noch die Kombination von Temsirolimus + Bevacizumab (INTORACT) war hinsichtlich objektiver Ansprechrate, PFS oder OS der Standardtherapie Bevacizumab + Interferon-α überlegen.
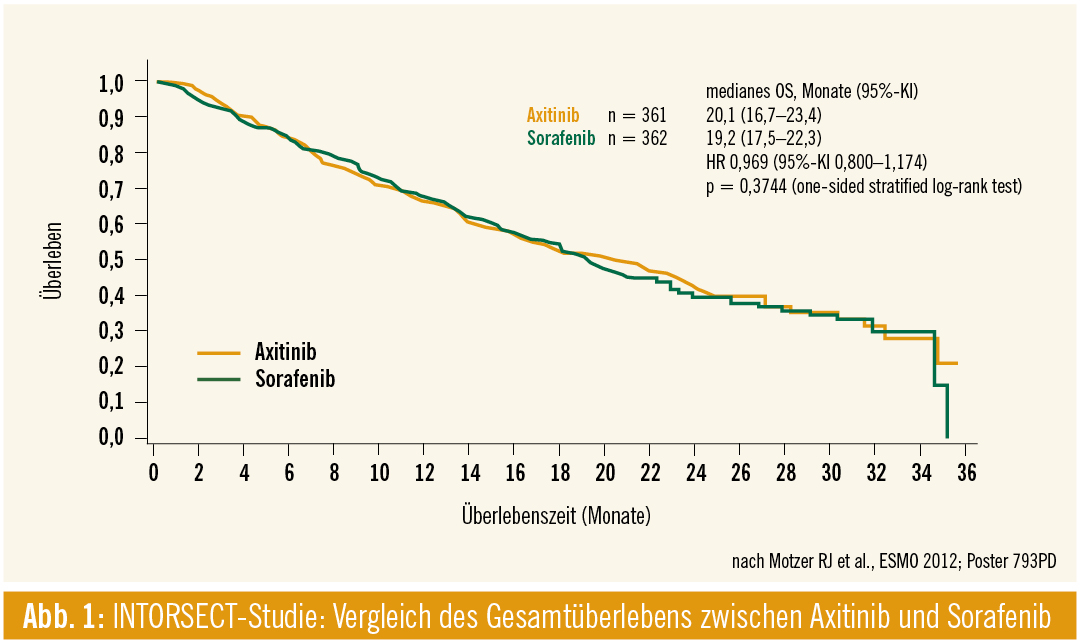
INTORSECT (second line): Derzeitige Zweitlinientherapieoptionen stellen Everolimus und Axitinib dar, beide sind nach TKI-Versagen zugelassen. Wird Everolimus eingesetzt, bedeutet dies eine Veränderung des Wirkmechanismus (TKI → mTOR-Inhibitor), kommt Axitinib zum Einsatz, wird der Wirkmechanismus beibehalten (TKI → TKI). Ein direkter Vergleich zwischen den Substanzen steht noch aus. Auf dem ESMO wurden nun die Phase-III-Ergebnisse der INTORSECT-Studie (Hutson T et al., #LBA22) präsentiert, die sich als weitere Negativstudie erwies. Zum direkten Vergleich gelangten die Zweitlinientherapieoptionen nach Sunitinibversagen, der mTor-Inhibitor Temsirolimus und der VEGF-TKI Sorafenib. Primärer Endpunkt war das PFS, sekundärer Endpunkt das OS. Das mediane PFS unter Temsirolimus betrug 4,28 Monate verglichen mit 3,91 Monaten unter Sorafenib. Unerwartet war, dass Patienten, die zu Sorafenib randomisiert wurden, signifikant länger überlebten (16,6 Monate) als jene unter Temsirolismustherapie (12,3 Monate) (p = 0,014). Basierend auf diesen Ergebnissen zeigt Temsirolimus keine Überlegenheit gegenüber Sorafenib, weder im progressionsfreien noch im Gesamtüberleben. Dies könnte die Schlussfolgerung zulassen, dass die Strategie TKI nach TKI-Versagen die bessere Option ist. Eine folgende Fragestellung lautet somit: Sorafenib oder Axitinib nach Sunitinibversagen? (Axitinib wurde als Zweitlinientherapie nach Sunitinib-Versagen aufgrund der Überlegenheit im PFS vs. Sorafenib zugelassen).
Geht man nach den OS-Daten einer randomisierten Phase-III-Studie zu Axitinib vs. Sorafenib second line, sind die Überlebenskurven ident. Im Axitinibarm betrug das mediane OS 20,1 Monate (95%-KI: 16,7–23,4), im Sorafenibarm 19,2 Monate (95%-KI: 17,5–22,3; HR 0,969, 95%-KI: 0,800–1,174, p = 0,3744; Abb. 1). Es gilt zu bedenken, dass Analysen zu OS-Daten insbesondere der Zweitlinientherapie aufgrund der Aufeinanderfolge aktiver Therapien einen Konfundierungseffekt erfahren.
Als wesentliche Conclusio nach dem ESMO 2012 hält Schmidinger fest, dass aus heutiger Sicht Kombinationen bisher wenig gelungen sind. Sowohl aus toxischer als auch aus ökonomischer Perspektive bleibt zu hinterfragen, ob Kombinationen viel Zukunft haben werden. In der Zweitlinientherapie unterstützen die Phase-III-Daten Temsirolimus vs. Sorafenib die Sequenzierung TKI → TKI.
Prostatakarzinom
Die primäre Therapie des hormonsensitiven metastasierten Prostatakarzinoms stellt die Androgendeprivationstherapie dar. Diese führt bei ca. 90 % der Patienten zu einem Ansprechen. Die Chemotherapie mit Docetaxel/Prednison gilt seit 2004 als Standard in der Behandlung des hormonrefraktären metastasierten Prostatakarzinoms. Die neuen Hormontherapien Abirateron und Enzalutamid wurden jüngst nach Versagen der Chemotherapie zugelassen, sind aber im Begriff, früher im Erkrankungsprozess eingesetzt zu werden. Zu den neuen Substanzen zählen auch Cabazitaxel und der Alpha-Strahler Alpharadin für den Einsatz nach Chemotherapie.
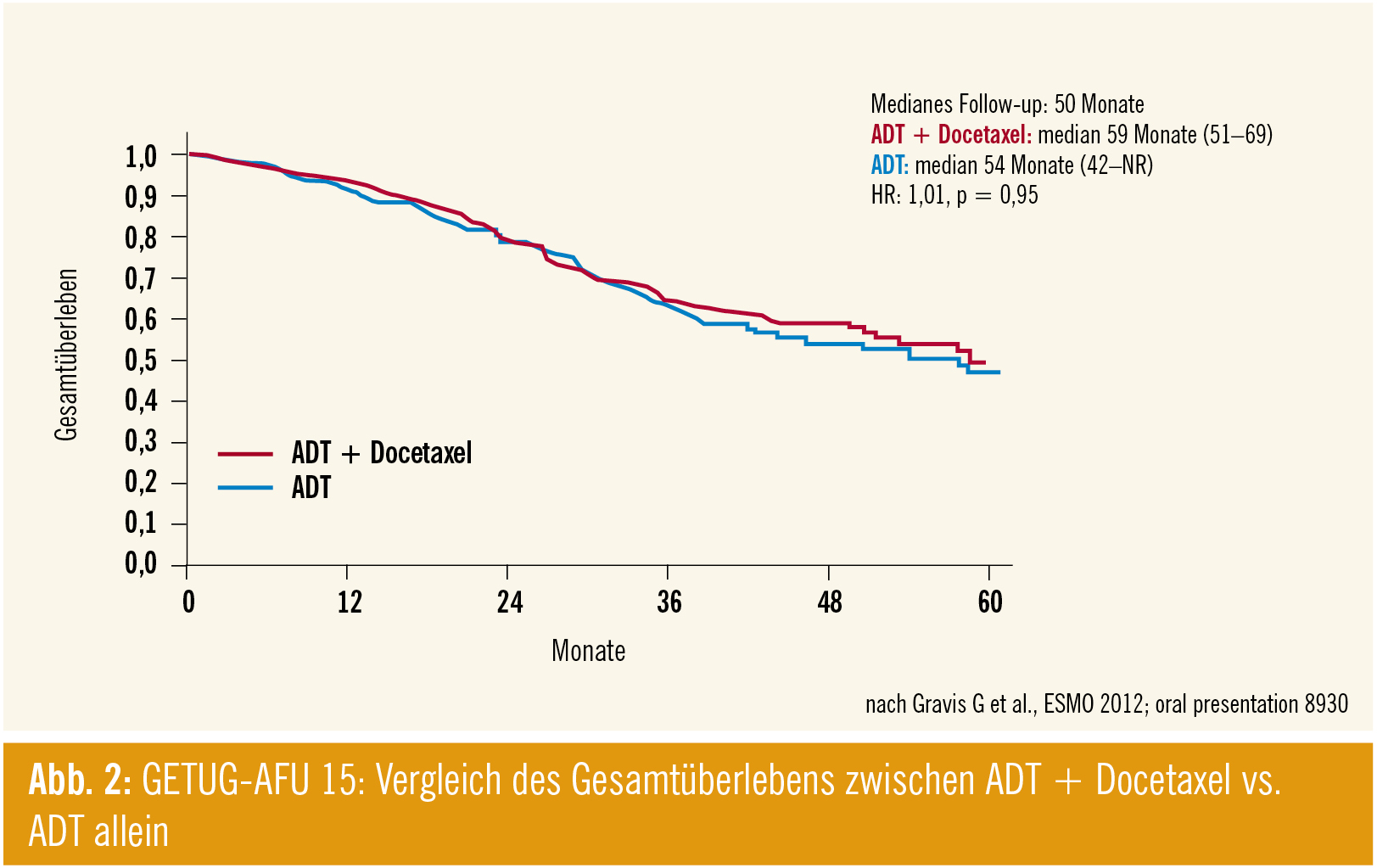
Frage der frühen Chemotherapie (GETUG-AFU 15): Prof. Ian Tannock, University of Toronto, Kanada, präsentierte die Ergebnisse der französischen Multicenter-Phase-III-Studie GETUG-AFU 15. Gravis G et al. (ESMO 2012; #893O) untersuchten in dieser Studie, ob die Kombination der ADT-Therapie mit Docetaxel verglichen mit ADT allein einen Überlebensvorteil bei hormonsensitiven metastasierten PCa-Patienten bringt.
Die OS-Daten zeigen, dass der frühe Einsatz von Docetaxel zu keinem signifikanten Überlebensvorteil in diesem Erkrankungsstadium führt (Abb. 2), ein Vorteil der Kombination konnte hinsichtlich des biochemischen und klinischen PFS verzeichnet werden. Die primäre ADT-Therapie sollte laut Tannock daher beim hormonsensitiven metastasierten PCa Standard bleiben.
MAINSAIL-Trial (Kombination Lenalidomid + Docetaxel): In der Phase-III-Studie von Petrylak et al. (ESMO 2012; #LBA24) wurde der Frage nachgegangen, ob die Kombination von Docetaxel/Prednison mit einer zielgerichteten Therapie (in dem Fall mit dem Immunmodulator Lenalidomid) einen Überlebensvorteil gegenüber der alleinigen docetaxelbasierten Chemotherapie beim mCRPC bringt. Diese Studie ist eine von mehreren Studien, die eine Kombination von Docetaxel mit einer zielgerichteten Therapie zum Untersuchungsgegenstand gemacht haben. All diese Studien waren negativ. Auch die MAINSAIL-Studie stellte keine Ausnahme dar. Die Kombination führte sogar zu einem schlechteren Überleben bei gleichzeitig stärkerer Toxizität.
Zu den bereits bekannten Studien neuer Substanzen wie Abirateron und Enzalutamid und Alpharadin (Radium-223-Chlorid) wurden weitere Analysen präsentiert:
Abirateron – Schmerz/Leistungsabbau: E. Basch präsentierte die Daten hinsichtlich des Einflusses von Abirateron/Prednison auf Schmerz und Leistungsabbau (sekundäre Studienendpunkte der Studie COU-AA-302) bei Patienten mit metastatischem, kastrationsresistentem PCa, die noch keiner Chemotherapie unterzogen wurden (Basch E et al., ESMO 2012; #8950). Die Therapie mit Abirateron/Prednison lässt in diesen sekundären Endpunkten im Vergleich zum Kontrollarm (Placebo/Prednison) signifikante Verbesserungen, insbesonders langfristig, vermuten. Die mediane Zeit für den Opiateinsatz aufgrund tumorbedingter Schmerzen wurde im Abirateronarm nicht erreicht und lag bei 23,7 Monaten im Kontrollarm (p = 0,0001). Die mediane Zeit bis zur Verschlechterung des Leistungsstatus (FACT-P gesamt) betrug 12,7 Monate für den Abirateronarm gegenüber 8,3 Monate für den Kontrollarm (p = 0,003).
Enzalutamid – Zeit bis zum ersten skelettalen Ereignis/Schmerz: K. Fizazi präsentierte die Ergebnisse der Phase-III-Studie AFFIRM hinsichtlich schmerzbezogener Lebensqualitätsendpunkte (Fizazi K et al., ESMO 2012; #8960). Demnach führt Enzalutamid zu Verbesserungen in der mittleren Reduktion der Schmerzstärke und der Schmerzbeeinträchtigung in der Tagesaktivität. Eine durch Schmerztagebücher erhobene Schmerzlinderung konnte bei 45 % der Patienten unter Enzalutamidtherapie erzielt werden, vs. 7 % in der Placebogruppe (p = 0,0079). Enzalutamid bewirkte eine Reduktion der Schmerzprogression um 44 % (HR = 0,564; p < 0,0001) und reduzierte das Risiko eines ersten skelettalen Ereignisses (SRE) um 31 % (HR = 0,688; p = 0,0001): Die Zeit bis zum ersten SRE unter Enzalutamid betrug 16,7 Monate (Placebo: 13,3 Monate; Abb. 3).
Alphardin – Update SRE/Lebensqualität: C. Parker präsentierte ein Update zu Alpharadin, das die sekundären Endpunkte SRE und Lebensqualität bei Patienten mit metastasiertem CRPC erfasste. Demnach verlängert der Alphastrahler die Zeit bis zum ersten SRE: Diese betrug im Alpharadinarm 12,2 Monate und war damit etwa doppelt so lang wie im Placeboarm (6,7 Monate). Patienten unter Alpharadintherapie berichteten von einer signifikant besseren Lebensqualität (EQ-5D). Damit, so Parker, verbessert Alpharadin nicht nur das Gesamtüberleben bei Männern mit metastasiertem CRPC, sondern erhöht auch deren Lebensqualität. Bedenke man, dass die meisten Männer in diesem Stadium innerhalb weniger Jahre versterben, sei die Bewahrung einer guten Lebensqualität von enormer Bedeutung.
1 Escudier B et al., Ann Oncol 2012; 23(suppl 7):vii65–vii71
2 Motzer RJ et al., ESMO oral presentation, #LBA8