Vesikoureteraler Reflux: Maturation?
Maturationstherorie
Wenngleich wir heute wissen, dass primär männliche Feten bzw. Säuglinge mit höhergradigen Refluxen das höchste Risiko kongenitaler wie postpartal erworbener Nierenschäden bis hin zur Niereninsuffizienz aufweisen, so sind es vor allem Mädchen mit niedriggradigeren Refluxen, welche einer hohen Morbidität ausgesetzt sind (Coulthard MG, Pediatr Nephrol, 2009). Dies erklärt sich nicht nur durch die genuin durch den Reflux bedingten rezidivierenden Harnwegsinfektionen, sondern vor allem durch die Langzeitantibiotikaprophylaxe sowie die wiederholte (invasive) Refluxdiagnostik. Vor allem die transurethralen Katheterisierungen stellen für das wachsende Kind einen nachweisbaren Stressfaktor dar, dieser lässt sich durch Speichelkortisolmessungen wie durch Verhaltensauffälligkeiten verifizieren. Ein konservatives Therapieregime, d.h. sowohl die klassische antibiotische Langzeittherapie als auch die Wait-and-see-Strategie, birgt ein hohes Risiko der erworbenen Nierenschädigung. Grund dafür ist die anatomische Konfiguration der Nierenpapillen in den Polbereichen. Ein zur Parenchymzerstörung führender intrarenaler Reflux wird durch die Verschmelzung zweier Papillen (“compound papillae”) ermöglicht, dies konnte auch bei (adulten) Transplantatnieren bestätigt werden (Coulthard MG et al., Transplantation, 2006). Die so genannten spontanen Resolutionsraten betragen ca. 15%, einem Zeitraum von ca. 5 Jahren (median) entsprechend (Elder JS et al., J Urol, 1997). Umgerechnet auf Grad-III-V-Refluxe bedeutet dies, dass über einen Zeitraum von ca. 8 Jahren mit rezidivierenden Harnwegsinfekten und konsekutiv Nierenparenchymschäden gerechnet werden muss. Die konservative Langzeittherapie des VUR begründet sich auf der Maturationtheorie des Refluxes. Definiert wird diese “Maturation” durch eine negative radiologische Befundung eines Miktionszystourethrogramms (MCUG) im Follow-up. Eine typische Kasuistik soll die Problematik der Maturationstheorie demonstrieren:
Kasuistik
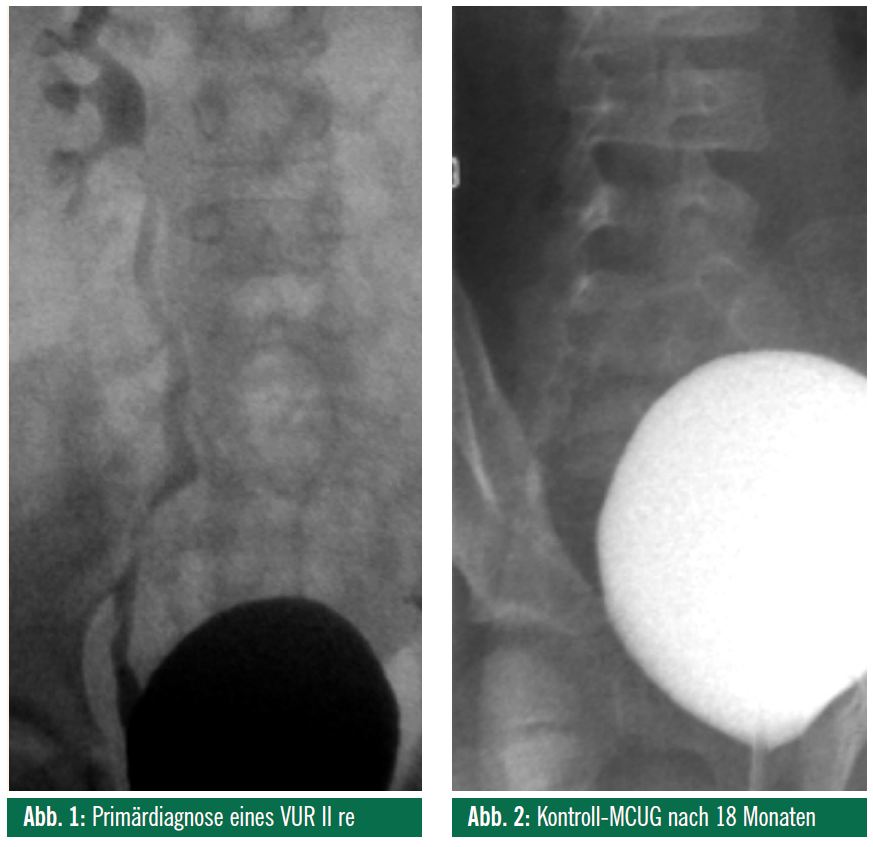
Ein zum Zeitpunkt der MCUG-Abklärung an einer pädiatrisch-radiologischen Abteilung 3-jähriges Mädchen wurde mit rezidivierenden, meist afebrilen Harnwegsinfekten vorstellig: Im Ultraschall wurden seitengleiche, parenchymatös unauffällige Nieren diagnostiziert, das MCUG zeigte einen Grad-II-Reflux. Nach einer Langzeitantibiotikatherapie über 18 Monate konnte im MCUG kein Reflux mehr nachgewiesen werden, eine so genannte Maturation wurde postuliert (Abb. 1, 2).
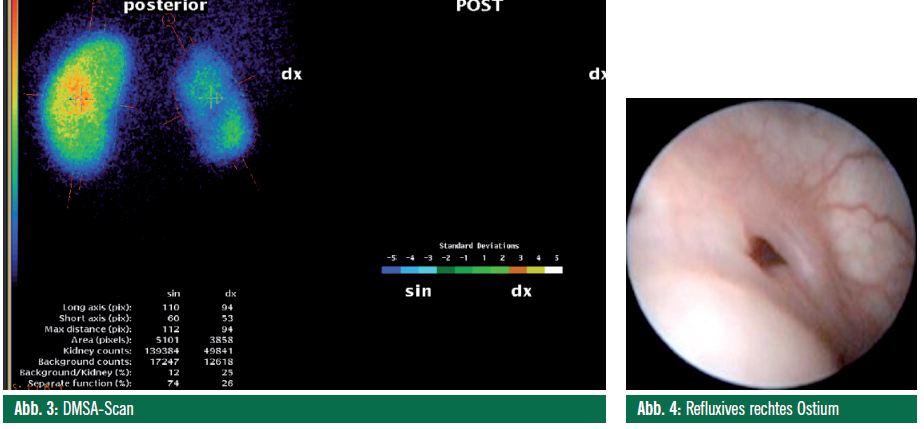
Nach einem knapp 3-jährigen symptomlosen Verlauf traten erneut – nun fieberhafte – Harnwegsinfekte auf. Eine Blasenfunktionsstörung wurde ausgeschlossen, im Ultraschall der Verdacht auf eine verkleinerte Niere gestellt. Der daraufhin durchgeführte DMSA-Scan zeigte eine stark parenchymgeschädigte, verkleinerte Niere rechts sowie Parenchymnarben links (Abb. 3).
In der daraufhin durchgeführten Zystoskopie fanden sich refluxive, lateralisierte sowie aufspülbare Ostien rechts wie links (HIT II nach Kirsch: Abb. 4), worauf die Deflux®-Unterspritzung in der HIT-STING-Technik erfolgte.
Maturation?
Im Follow-up von über nun knapp 4 Jahren traten keine Harnwegsinfektionen mehr auf. Gibt es nun eine Maturation des pathologischen ureterovesikalen Überganges – klinisch wie histologisch? Zuerst gilt es den Terminus Maturation (lat: “reif werden”) zu definieren: Ist unter einer Maturation – definiert durch eine negative MCUG-Untersuchung – eine restitio ad integrum der vesikoureteralen Übergangszone (VUÜZ) zu verstehen? Ist es möglich, dass ein kongenital insuffizienter Verschlussmechanismus singulär ausreift, oder handelt es sich vielmehr um eine Defektheilung? Unter der Prämisse einer kongenitalen Unreife der VUÜZ wird Eltern betroffener Kinder üblicherweise ein mögliches “Auswachsen” der “Klappe” bzw. des intravesikalen “Tunnels” erklärt. Der Terminus “Klappe” ist vor allem mit dem so genannten passiven Verschlussmechanismus assoziiert. Dieser als intravesikaler Teil des ureteralen Tunnels bezeichnete Abschnitt des ureteralen Durchtrittes durch die Blase wurde als der wesentliche Teil des Antirefluxmechanismus angesehen. Insbesondere die Relation der Tunnellänge zum Ureterquerschnitt wird als Bedingung eines passiv wirksamen Verschlussmechanismus betrachtet, vorzugsweise bei Anstieg des intravesikalen Druckes. Eine Bestätigung dieser These deduzierte sich von einem überaus erfolgreichen Grundprinzip der Antirefluxplastik: eine ureterale Tunnel-Kaliber-Ratio von 4 oder 5 : 1 gilt hier als Standardrelation. Prä- und postnatale Messungen der Relation zwischen vesikaler Durchtrittslänge und Ureterdurchmesser zeigten jedoch ein deutlich geringeres Verhältnis als bisher angenommen. Dies bedeutet, dass ein insuffizienter passiver Antirefluxmechanismus im Rahmen der Maturationstheorie eine untergeordnete Rolle spielt, weiters würde ein postpartales “Auswachsen” des kurzen kongenitalen subvesikalen Tunnels ein “Catch-up”- Wachstum der ureterovesikalen Übergangszone voraussetzen. Viele histologische Untersuchungen zeigten jedoch, dass es nur ein synchrones Wachstum der beteiligten anatomischen Strukturen gibt. Dies widersprach der These eines exponenziellen isolierten Wachstums des transvesikalen Ureterabschnittes. Für eine Maturationsentwicklung müssen also weitere, wesentlichere Faktoren wie der so genannte aktive muskuläre Verschlussmechanismus, der intravesikale Druck und der so genannte trigonale Anschluss bzw. die intertrigonale Verbindung für eine kompetente ureterovesikalen intermittierende Okklusion verantwortlich sein. Tanagho et al. postulierten in einer experimentellen Arbeit erstmals 1965 einen zentralen muskulär kontrollierten Antirefluxmechanismus. Um eine hypothetische Maturation eines refluxiven, muskulär dysplastischen Ureterostiums zu erklären, muss ein Umbauprozess, das so genannte “Remodeling” der extrazellulären Matrix, angenommen werden. Dieses führt letztendlich über eine veränderte Muskel-Kollagen-Ratio zu einer Volumensänderung des extrazellulären Raumes, dies vor allem durch den H20-Verlust von alternden Kollagenen. Eine “Schrumpfung” des ureteralen Durchmessers könnte somit zu einer antirefluxiven Durchmesser-Länge-Relation des intravesikalen Harnleiters und somit zu einer “Maturation” eines pathologischen Ostiums führen.
Neben der organisch diskutierten Maturation gibt es auch die These der “funktionellen Maturation” der Blasenfunktion, insbesondere der Koordination zwischen Detrusor und Blasenauslass bzw. Beckenboden. Der Einfluss dieser Blasenfunktionsstörung (LUTD) auf eine Refluxmaturation wird aber ebenfalls kontrovers diskutiert: Eine kleinkapazitäre Blase mit Überaktivität und hohen Entleerungsdrücken wurde bei Kindern mit höhergradigen Refluxen beschrieben, andere Studien wiesen diese Instabilitäten jedoch auch bei Kindern ohne Reflux nach (Bachelard M et al., J Urol 1999). Auch die Therapie von Kindern mit Reflux und einer überaktiven Blase erbrachte keine höhere Maturationsraten im Vergleich zu Kindern ohne anticholinerge Therapie. Andererseits fanden sich bei Kindern mit einer Dyskoordination und VUR niedrigere Maturationsraten (Van Gool et al., J Urol 1992). Als gesichert gilt lediglich, dass ca. 50% der Kinder mit funktionellen Blasenentleerungsstörungen diese auch noch nach 2 Jahren aufweisen und einen negativen Prädiktor bei Nichtbehandlung eines VUR III und IV darstellen (Sillen et al., J Urol 2010).
Zusammenfassung
Neben der klassischen Refluxdiagnostik durch das MCUG muss der klinischen wie laborchemischen Diagnose von Harnwegsinfekten eine größere Bedeutung beigemessen werden.
Nur so sind permanente Nierenschädigungen zu vermeiden. Minimalinvasive Therapieansätze wie die endoskopische Therapie stellen heute nicht nur die First-Line-Therapie des Refluxes dar, sie reduzieren auch signifikant rezidivierende (febrile) Harnwegsinfekte aufgrund eindeutig diagnostizierter wie auch okkulter VUR (Hagerty J et al., Urology 2008).
Die Frage der Maturation des vesikoureteralen Überganges bleibt nach wie vor eine akademische. Sie steht derzeit im Mittelpunkt der histologischen wie pathophysiologischen Forschung.