Fibrosehemmung bei chronischer Niereninsuffizienz
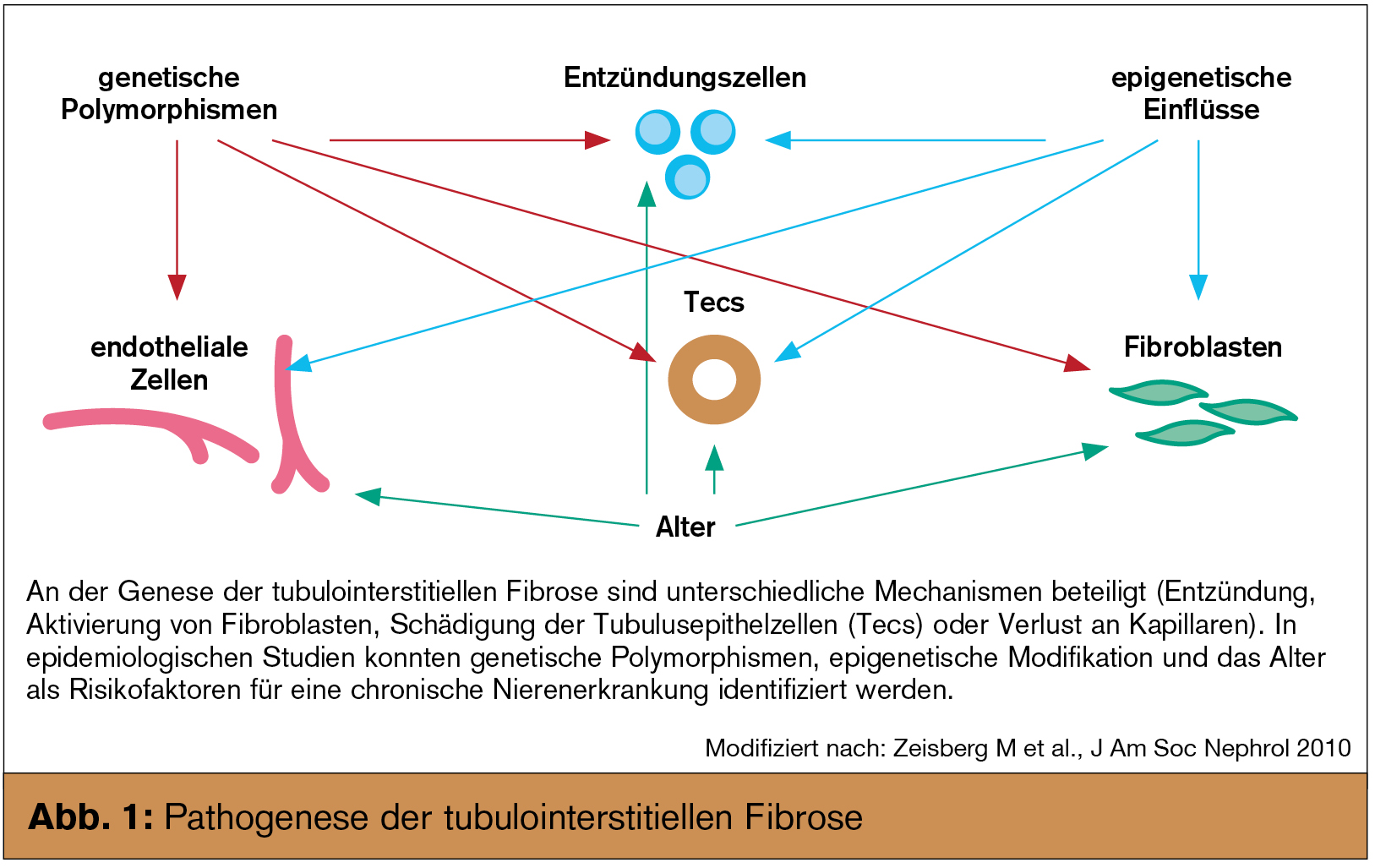
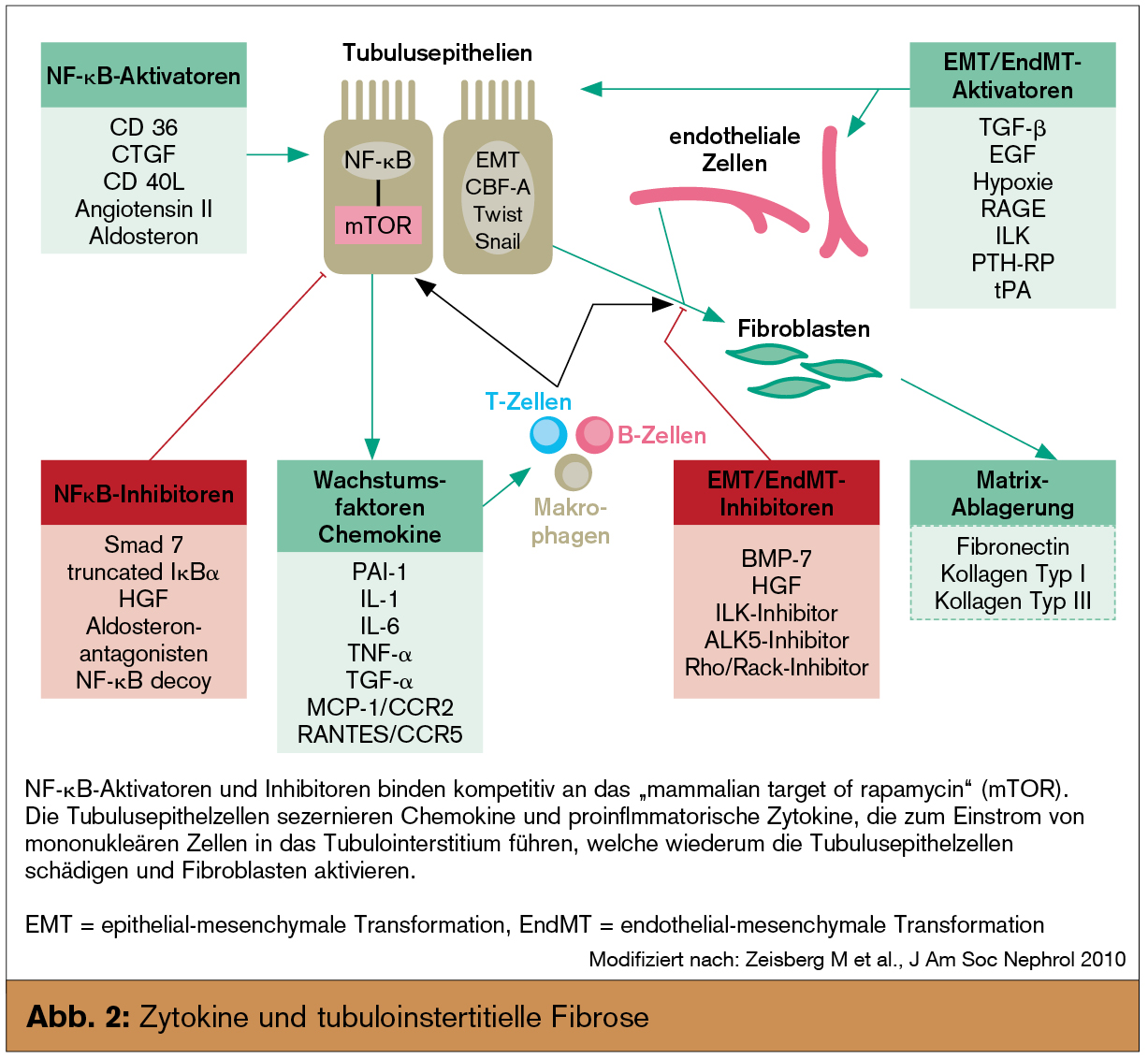
Die gemeinsame Endstrecke chronisch fortschreitender Nierenerkrankungen ist, weitgehend unabhängig von der auslösenden Ursache, eine progrediente tubuläre Atrophie und interstitielle Fibrose. Letztere ist nicht als einfache „Narbe“ zu verstehen, vielmehr handelt es sich um einen dynamischen und konzertierten Vorgang, der neben der extrazellulären Matrix auch alle residenten und/oder infiltrierenden Zellen miteinbezieht (Abb. 1). In den letzten Jahren hat sich unser Wissen über die Pathophysiologie und die in diesen Prozess involvierten Regelkreise deutlich erweitert (Abb. 2). Basierend darauf werden nun Versuche unternommen, in den Ablauf modulierend einzugreifen. Obwohl auch etablierte Therapien (wie z. B. die Blockade des Renin-Angiotensin-Aldosteron-Systems) zumindest indirekt antifibrotisch wirken, stellen diese neuen Medikamente einen völlig neuen Ansatz in der Therapie chronischer Nierenerkrankungen dar. Während einige Substanzen bisher nur im Tiermodell eingesetzt wurden, gibt es zu anderen bereits erste klinische Studien.
Tierexperimentelle Studien
Transforming Growth Factor (TGF) β dürfte auch bei der renalen Fibrose ein zentrales Zytokin sein. Viele – aber nicht alle – der im Folgenden besprochenen Substanzen beeinflussen daher entweder die TGF-Produktion oder -Aktivität direkt oder verstärken die Wirkung von endogenen Antagonisten.
ONO-1301 ist ein lang wirksames Prostazyklinanalogon, das intravenös appliziert wird. Die Substanz ist interessant, weil sie nicht nur die TGF-β-induzierte profibrotische Signalkaskade unterbricht, sondern auch die Expression von HGF (hepatocyte growth factor) fördert. HGF antagonisiert die epithelial-mesenchymale Transformation (also die Umwandlung von renalen Tubuluszellen in Myofibroblasten), ein Prozess, der wesentlich zur tubulointerstitiellen Atrophie und Fibrose beitragen dürfte. In einem Tiermodell (unilaterale obstruktive Nephropathie) reduziert ONO-1301 die Fibrose, die Akkumulation von Typ-I- und Typ-III-Kollagen sowie die Zahl der Fibroblasten und Monozyten/Makrophagen.
HGF hat auch per se als Antagonist von TGF-β eine deutliche antifibrotische Wirkung. Intrarenal fördert HGF auch die Expression der matrixabbauenden Enzyme Metalloproteinase 2 und 9 und fördert in der Zellkultur die Apoptose von Myofibroblasten.
Tamoxifen: Ebenfalls über eine Reduktion der TGF-β-Aktivität dürfte der nephroprotektive Effekt von Tamoxifen, einem Östrogenrezeptormodulator, in einem hypertensiven Tiermodel zu erklären sein. Neben einer reduzierten Fibrosierung wurden auch die Glomerulosklerose und die Proteinurie günstig beeinflusst, ohne dass es zu einer Reduktion des Blutdruckes kam.
Suramin blockiert relativ unspezifisch die Interaktion von verschiedenen Zytokinen und Wachstumsfaktoren mit ihren jeweiligen Rezeptoren. Auch durch Suramin kann bei unilateraler Obstruktion die Fibrosierung reduziert werden.
Weitere positive Effekte wurden mit Cytoglobin (einem in Fibroblasten exprimierten Protein, welches den oxidativen Stress und die Kollagensynthese reduziert), BMP 7 und Norcantharidin (beide TGF-β-Antagonisten) berichtet.
Klinische Studien
Bardoxolon ist ein so genanntes Triterpenoid, welches den Nuclear Respiratory Factor 2 (NRF2) aktiviert. Damit verbunden ist eine verstärkte Funktion verschiedener antioxidativer Faktoren wie SOD, GPX oder Katalase. Interessanterweise gibt es zu dieser Substanz relativ wenige präklinische Daten. In einer ersten klinischen Untersuchung bei Typ-2-Diabetikern mit einer chronischen Nierenerkrankung sank unter 25 bis 150 mg Bardoxolon pro Tag das Serumkreatinin signifikant ab, dementsprechend nahm die eGFR zu, die Proteinurie wurde nicht beeinflusst. Da der Effekt allerdings bereits 2 Wochen nach Therapiebeginn nachweisbar war, kann eine hämodynamische Komponente der Wirkung nicht ausgeschlossen werden. Neben der antioxidativen Wirkung stimuliert Bardoxolon auch noch AMPK (ein Enzym, das die NF-κB-Aktivierung und die NADPH-Oxidaseproduktion verhindert), bindet an mTOR und verbessert im Mausmodell die Stoffwechselkontrolle. Eine große prospektive randomisierte Studie mit harten Endpunkten musste allerdings kürzlich wegen einer erhöhten Nebenwirkungsrate in der Verumgruppe abgebrochen werden.
Pirfenidon, welches die Produktion und die Wirkung von TGF-β, aber auch anderer Zytokine (TNF‑α, Interleukin-1 und -6 sowie Interferon gamma) reduziert, wurde bei experimenteller diabetischer Nephropathie erfolgreich eingesetzt. In einer relativ kleinen randomisierten Studie beim Menschen verbesserte die Substanz die eGFR im Vergleich zu Placebo, ohne die Proteinurie zu verändern. Allerdings ist derzeit die Frage nach der optimalen Dosierung offen, da in der Studie keine klare Dosis-Wirkung-Beziehung nachgewiesen wurde.
TGF-β-Antikörper: In Anbetracht der zentralen Rolle von TGF-β wurden natürlich auch direkt gegen dieses Zytokin gerichtete Therapieformen evaluiert. Antikörper verhindern in Tiermodellen die interstitielle Matrixakkumulation, ohne dass sich die Proteinurie verändert. Derzeit wird eine multizentrische Phase-II-Studie mit dem TGF-β1-spezifischen Antikörper LY2382770 bei 400 Patienten durchgeführt.
Pyridorin (Pyridoxamindihydrochlorid) verhindert die Bildung von „advanced glycation endproducts“, ist ein Sauerstoffradikalfänger und bindet toxische Karbonyle. 317 Patienten mit Proteinurie und Typ-2-Diabetes-mellitus erhielten 2-mal 150 mg oder 2-mal 300 mg Pyridorin oder Placebo pro Tag für ein Jahr. In der gesamten Gruppe fand sich kein Vorteil für die aktive Therapiegruppe, in einer Sekundäranalyse konnte jedoch gezeigt werden, dass im Tertil jener Patienten mit den niedrigsten Serumkreatininwerten bei Studienbeginn unabhängig von der Proteinurie das Serumkreatinin signifikant weniger anstieg als unter Placebo.
Pentoxifyllin (ein Methylxanthin) ist ein Phosphodiesterasehemmer mit günstigen Effekten auf den Blutfluss in der Mikrozirkulation. Die Substanz beeinflusst aber auch die interstitielle Inflammation, reduziert die Expression von MCP-1 und weiterer mitogener und profibrotischer Gene sowie die Proliferation interstitieller Fibroblasten. In einer Cochrane-Analyse, in die 17 Studien mit 991 Patienten mit diabetischer Nephropathie eingeschlossen wurden, wirkte Pentoxifyllin im Vergleich zu Placebo antiproteinurisch, die Serumkreatininwerte sanken (allerdings nahm die Kreatininclearance nicht zu) und es gab keine signifikanten Nebenwirkungen. Eine antiproteinurische Wirkung konnte auch noch nachgewiesen werden, wenn Pentoxifyllin zusätzlich zu ACE-Hemmern oder Angiotensin-Rezeptorblockern gegeben wurde.
Resümee
Bereits bisher ist es gelungen, durch spezifische Maßnahmen wie eine Blockade des Renin-Angiotensin-Aldosteron-Systems den Verlauf von chronischen Nierenerkrankungen günstig zu beeinflussen. Obwohl auch diese Maßnahmen die tubulointerstitielle Fibrose und Atrophie reduzieren, tritt die terminale Niereninsuffizienz noch immer bei vielen Patienten ein. Therapieoptionen, die direkt die fibrosefördernden Mechanismen hemmen, werden sich wahrscheinlich in naher Zukunft als weitere Möglichkeit etablieren.