Wann muss man an eine Glomerulonephritis denken?
Im Jahr 2010 wurde in Österreich bei 11 % der inzidenten und 16 % der prävalenten Dialysepatienten eine Glomerulonephritis (GN) als Ursache der dialysepflichtigen Niereninsuffizienz angegeben (Jahresbericht 2010, www.nephro.at). Damit stellen die GN nach der diabetischen und der vaskulären Nephropathie die dritthäufigste Diagnose (abgesehen von Schrumpfnieren unklarer Genese) bei Dialysepatienten dar.
Unterschätzte Bedeutung
Diese Zahlen, die auf den ersten Blick niedrig erscheinen, unterschätzen vermutlich jedoch die psychologische, individuelle und sozioökonomische Bedeutung der Diagnose „Glomerulonephritis“ aus verschiedenen Gründen:
- Die Literatur zur Inzidenz und Prävalenz einzelner GN als auch zur Prognose ist aufgrund der Assoziation bestimmter GN mit bestimmten Ethnien (z. B. IgA-Nephritis in Asien) und Unterschieden in Biopsiegewohnheiten einzelner Zentren bzw. Länder schwierig zu interpretieren (z. B. 10-mal so hohe Inzidenz der IgA-Nephritis in Australien u. a. vermutlich aufgrund einer überdurchschnittlichen Biopsiefrequenz).
- GN repräsentieren eine sehr heterogene Gruppe an Erkrankungen, die nicht nur die Niere betreffen, sondern auch im Rahmen von systemischen Erkrankungen auftreten können.
- Die meisten GN treten in einem sehr produktiven Lebensabschnitt auf, nämlich zwischen der 2. und der 5. Dekade. Insofern haben GN nicht nur bei der Progression zur dialysepflichtigen Niereninsuffizienz, sondern auch durch die häufig nebenwirkungsreiche und auch kostenintensive Therapie eine oft verheerende Auswirkung auf den individuellen Patienten, seine/ihre Familie und die Gesellschaft.
- Die Diagnose wird nicht selten bei fortgeschrittener chronischer Niereninsuffizienz gestellt, bei der eine immunsuppressive Therapie nicht mehr zielführend ist, oder systemische Nebenwirkungen der Niereninsuffizienz oder der GN selbst zu lebensgefährlichen Komplikationen führen können.
Aufgrund dessen ist eine frühe Diagnose unter Berücksichtigung der klinischen Symptomatik und bei Verwendung einer wohlüberlegten Serum- und Harndiagnostik zielführend.
Symptomatik richtig interpretieren
GN verursachen insbesondere am Anfang der Erkrankung gar keine oder nur geringe Symptome. Zu den häufigsten Symptomen zählen eine intermittierende Makohämaturie, schäumender Harn als Ausdruck der Proteinurie, Ödeme (v. a. an den unteren Extremitäten und an den Augenlidern), Symptome einer Hypertonie (z.B. Kopfschmerzen, Sehstörungen) und natürlich Urämiesymptome (Anämie, Hypertonie, Übelkeit und Erbrechen etc.) bei fortgeschrittener Niereninsuffizienz. Tritt eine GN im Rahmen einer systemischen Erkrankung auf wie z. B. bei einer ANCA-assoziierten Vaskulitis oder beim systemischen Lupus erythematodes, so sind Hauterscheinungen (palpable Purpura, Schmetterlingserythem) oder Gelenkbeschwerden im Sinne einer Arthritis nicht selten. Allerdings können Vaskulitiden sehr unterschiedliche Organe betreffen, weswegen bei einer unklaren oder atypischen Symptomatik immer an eine Autoimmunerkrankung gedacht werden sollte.
Drei-Säulen-Diagnostik
Die nicht-invasive diagnostische Abklärung einer GN fußt auf drei Säulen:
Harnanalyse: Die Analyse des Urins umfasst die Quantifizierung der Proteinurie entweder aus dem 24-h-Harn oder (leichter) anhand des Protein/Kreatinin-Quotienten aus dem Spontanharn. Dabei entspricht der Protein/Kreatinin-Quotient in g/g oder mg/mg ungefähr der Proteinurie pro 24 h. Zusätzlich ist ein quantitatives Harnsediment unerlässlich, bei dem Erythrozyten und Akanthozyten (früher „dysmorphe Erythrozyten“) mikroskopisch quantifiziert werden. Finden sich im Harnsediment Zylinder (Leuko-, Erythrozyten- oder granuläre Zylinder), so sind das ebenfalls Hinweise für das Vorliegen einer GN oder einer interstitiellen Nephritis (siehe unten).
Serologische Marker: Es existieren nur wenige serologische Marker für eine GN. Zu den bekanntesten zählen jedoch die antineutrophilen zytoplasmatischen Antikörper (c-ANCA = PR3-ANCA = Anti-Proteinase 3; p-ANCA = MPO-ANCA = Anti-Myeloperoxidase) und die antinukleären Antikörper (ANA) inklusive der verschiedenen Subtypen sowie seit 2011 auch die Phospholipase-A2-Rezeptor-Antikörper (PLA2R-Ak) zur Diagnose und zur Monitorisierung des Therapieverlaufs bei membranöser GN. Eine Erniedrigung der Serumspiegel der Komplementfaktoren C3 und C4 deutet ergänzend auf eine Aktivierung des Komplementsystems hin, welche bei bestimmten GN auftreten kann.
Abdomensonografie: Obwohl eine GN sonografisch nur unspezifische Veränderungen erkennen lässt (z. B. echodichtes Nierenparenchym), so zählt eine Abdomensonografie zum Standard der nephrologischen Abklärung einer GN, da damit strukturelle Pathologien (Tumor, Zysten, Nierensteine oder Nephrokalzinose, Hufeisenniere, Einzelniere etc.) ausgeschlossen werden können. Ebenso kann die Abschätzung der Größe der Nieren als Anhaltspunkt für ein akutes Geschehen (große Nieren) oder für eine chronisch progrediente Niereninsuffizienz (Schrumpfnieren) dienen.
Nephritis oder Nephrose?
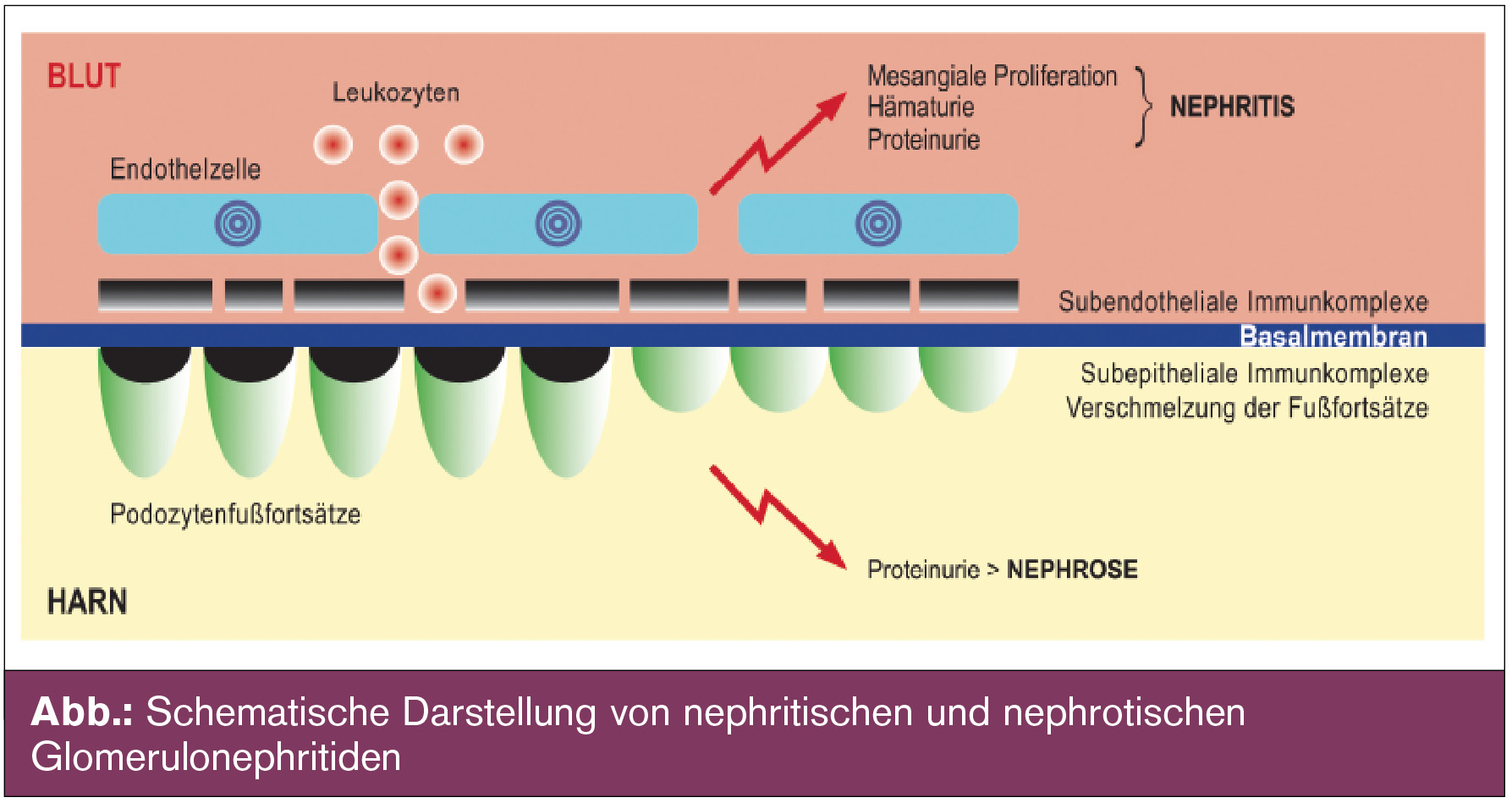
Bei den GN unterscheidet man nephritische und nephrotische Erkrankungen. Bei einer Nephritis kommt es in den meisten Fällen zu einer Pathologie auf der Blutseite der glomerulären Kapillaren, z. B. zu einer subendothelialen Ablagerung von Immunkomplexen (Abb.). Es kommt zu einer Komplementaktivierung und zur Chemotaxis von Leukozyten von der Zirkulation in den subendothelialen und in den mesangialen Raum. Durch Schädigung der Basalmembran tritt im Urin sowohl eine Hämaturie (± Akanthozyten, Erythrozytenzyinder) als auch eine Proteinurie auf. Typische nephritische Glomerulonephritiden sind IgA-Nephropathie (IgAN), Lupus-Nephritis Klasse III und IV, ANCA-assoziierte Vaskulitiden oder membranoproliferative Glomerulonephritis.
Im Gegensatz dazu findet sich die Pathologie bei nephrotischen Erkrankungen auf der podozytären Seite des Glomerulums (Abb.). Die Podozytenschädigung (direkt durch zirkulierende Faktoren oder indirekt durch Immunkomplexablagerungen) kann zwar auch zu einer Komplementaktivierung führen, aber durch den fehlenden Kontakt mit der Blutseite kommt es in den meisten Fällen zu keiner mesangialen Proliferation. Klinisch präsentieren sich die Patienten mit einer isolierten Proteinurie bis hin zum nephrotischen Syndrom. Als nephrotisches Syndrom wird eine Proteinurie > 3,5 g Protein/g Kreatinin, Ödeme, Hypertonie, Hypoalbuminämie und Hyperlipidämie bezeichnet. Typische nephrotische GN sind Minimal Change Disease (MCD), fokale segmentale Glomerulosklerose (FSGS) oder membranöse Glomerulonephritis (MN).
Histologie: Eine GN kann letztendlich nur histologisch verifiziert werden. Bei einem nephritischen Harnbefund sind die therapeutischen Konsequenzen einer bioptischen Diagnosesicherung oft beträchtlich, weswegen in den meisten Fällen eine Nierenbiopsie durchgeführt wird. Liegt jedoch eine isolierte Proteinurie vor, so hängt die Dringlichkeit der Biopsieindikation von dem Ausmaß der Proteinurie ab. Bei einer Proteinurie < 1 g Protein/g Kreatinin sind die therapeutischen Konsequenzen bis auf eine RAAS-Blockade gering, es ist für gewöhnlich keine immunsuppressive Therapie indiziert. Auf der anderen Seite stellt ein nephrotisches Syndrom eine zwingende Biopsieindikation dar. Ebenso stellt eine rapide Verschlechterung der Nierenfunktion oder ein akutes Nierenversagen unklarer Genese eine Biopsieindikation dar.
Neue Therapierichtlinien
Ganz rezent wurden „Cinical practice“-Richtlinien der KDIGO (Kidney Disease Improving Global Outcomes) zur Therapie verschiedener Glomerulonephritiden publiziert, welche online über www.kdigo.org zugänglich sind.