Fettleber: Risikofaktor metabolisches Syndrom – Neue Antidiabetika, Gallensäure-Derivate und Kernrezeptor-Liganden bieten Therapie-Perspektiven
Epidemiologie: Im Gegensatz zu anderen Ursachen chronischer Lebererkrankungen ist die Prävalenz der nAFLD in den letzten 20 Jahren stark im Anstieg begriffen, womit sie derzeit eine der häufigsten Ursachen für erhöhte Leberwerte ist (ca. 25 % der Patienten in der Leberambulanz eines tertiären Zentrums). Epidemiologische Daten zeigen eine Prävalenz in der westlichen Gesamtbevölkerung von ca. 20 % für die nAFLD (6–35 %) und ca. 5 % für die nASH. In Risikogruppen (z. B. Adipositas; DM 2) liegen diese Daten allerdings deutlich höher (70–90 % nAFLD, 20–30 % nASH). nASH ist in den USA mittlerweile die dritthäufigste Indikation zur Transplantation und weist als einzige eine steigende Inzidenz auf (1,2 % in 2001, 9,7 % in 2009).
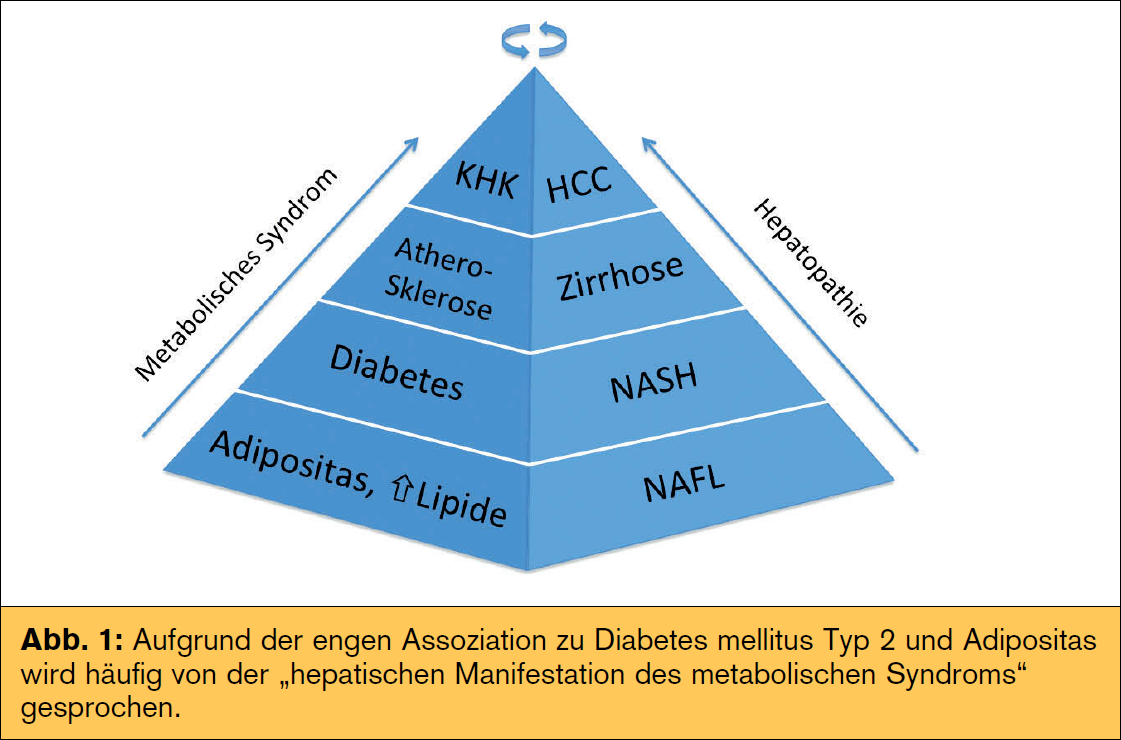
Risikofaktoren und Verlauf: Das metabolische Syndrom (v. a. die Insulinresistenz) ist einer  der Hauptrisikofaktoren für Erkrankung und Progression der nAFLD, wobei hierbei die Frage nach Henne oder Ei noch nicht abschließend geklärt werden konnte. neben metabolischen (Tab.) spielen auch genetische Faktoren eine große Rolle im Krankheitsprozess. Speziell ein Polymorphismus im Adiponutrin-Gen (PnPLA3) zeigte eine erhöhte Prädisposition für nAFLD und nASH mit Progression zur Fibrose. Andere Polymorphismen (z. B. APO C3, GCKR) zeigen eine Assoziation mit Steatose und metabolischen Faktoren wie Insulinresistenz oder Dyslipidämie. Unklar ist weiterhin, ob Patienten konsekutiv die verschiedenen Krankheitsstadien durchlaufen („two hit/multiple hit
der Hauptrisikofaktoren für Erkrankung und Progression der nAFLD, wobei hierbei die Frage nach Henne oder Ei noch nicht abschließend geklärt werden konnte. neben metabolischen (Tab.) spielen auch genetische Faktoren eine große Rolle im Krankheitsprozess. Speziell ein Polymorphismus im Adiponutrin-Gen (PnPLA3) zeigte eine erhöhte Prädisposition für nAFLD und nASH mit Progression zur Fibrose. Andere Polymorphismen (z. B. APO C3, GCKR) zeigen eine Assoziation mit Steatose und metabolischen Faktoren wie Insulinresistenz oder Dyslipidämie. Unklar ist weiterhin, ob Patienten konsekutiv die verschiedenen Krankheitsstadien durchlaufen („two hit/multiple hit 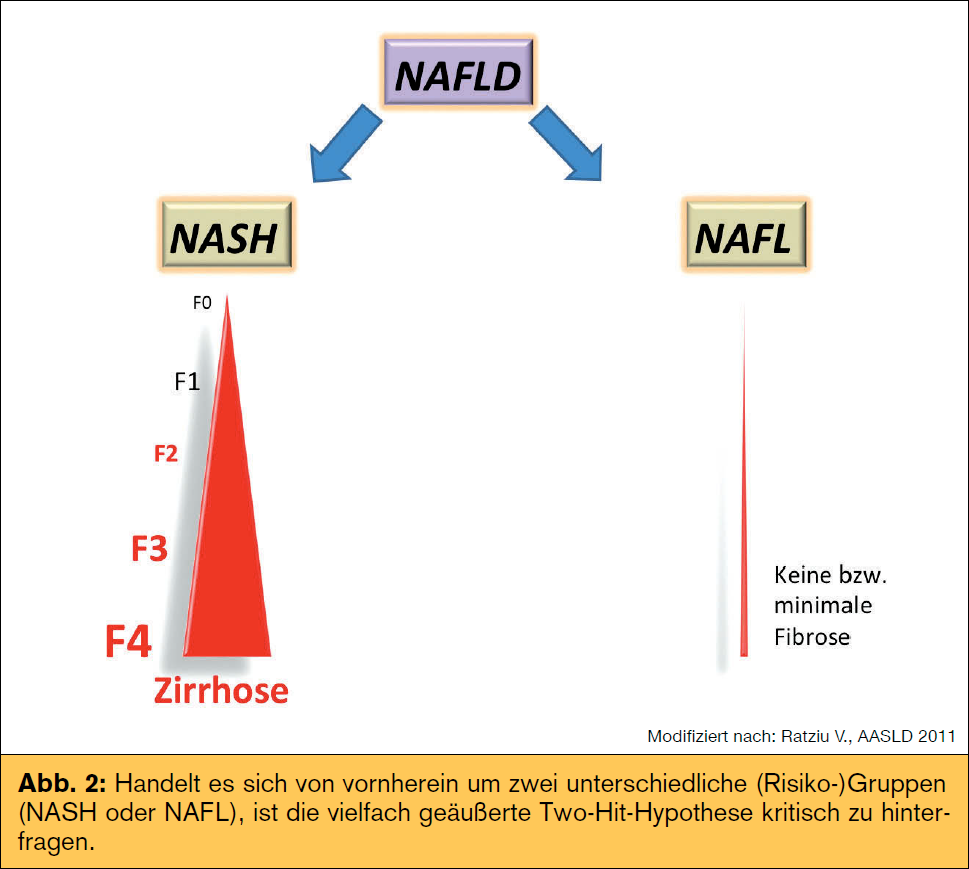 hypothesis“) oder vielmehr von vornherein eine reine Fettleber oder nASH entwickeln. Wenn es sich um zwei unterschiedliche (Risiko-)Gruppen und weniger um zwei konsekutive Krankheitsstadien handelt (Abb. 2), muss man die vielfach geäußerte Two-Hit-Hypothese kritisch hinterfragen. Diese umfasst in einem „first hit“ ein gesteigertes Angebot an freien Fettsäuren durch vermehrte Lipolyse und De-novo-Lipogenese im Rahmen einer Insulinresistenz und gestörten β-Oxidation sowie einen gestörten Export von Triglyzeriden als VLDL (Very Low Density Lipoprotein). Oxidativer Stress und proinflammatorische Zytokine stellen einen Teil des „second hit“ dar. neueren Daten zufolge spielen erhöhte Endotoxine im Blut eine wichtige Rolle im Entzündungsprozess, wofür möglicherweise eine erhöhte Darmpermeabilität und so genannte PAMPs (Pathogen-associated Molecular Patterns) als Teil des Mikrobioms mitverantwortlich sind. Der Konsum von nahrungsmitteln mit hohem glykämischen Index und hohem Anteil an Fruktose (z. B. Softdrinks) steht hierbei als wichtige Einflussgröße im Fokus. Die Diagnose HCC wird immer häufiger auch ohne vorhandene Leberzirrhose gestellt, womit auch hier nicht immer die klassische Progression beobachtet wird. Risiko für einen pathologischen Krankheitsverlauf haben. Metabolische Faktoren wie Adipositas und DM 2 erhöhen zusätzlich das Risiko eines HCC. Unabhängig vom metabolischen Syndrom zeigt sich bei nAFLD-Patienten ein erhöhtes kardiovaskuläres Risiko, was auch die häufigste Mortalitätsursache darstellt. Auf den Plätzen 2 und 3 folgen extrahepatische und hepatische Ursachen, wobei gerade nASH-Patienten gegenüber der normalbevölkerung ein überproportional erhöhtes Risiko für hepatische Komplikationen haben (2,8 vs. 0,2 %). Der Schweregrad der nAFLD/nASH stellt zusätzlich einen unabhängigen Risikofaktor für kardiovaskuläre Komplikationen dar, was sich in einer erhöhten Gesamtsterblichkeit in nAFLD-Patienten widerspiegelt (Abb. 1). Erste Studien zeigen auch ein erhöhtes Risiko für fortgeschrittene kolorektale Adenome (inkl. serratierter Adenome) und neoplasien bei nAFLD, weshalb bei diesen Patienten vermehrt Augenmerk auf die Vorsorgekoloskopie gelegt werden sollte, welche möglicherweise schon vor dem 50. Lebensjahr erfolgen sollte.
hypothesis“) oder vielmehr von vornherein eine reine Fettleber oder nASH entwickeln. Wenn es sich um zwei unterschiedliche (Risiko-)Gruppen und weniger um zwei konsekutive Krankheitsstadien handelt (Abb. 2), muss man die vielfach geäußerte Two-Hit-Hypothese kritisch hinterfragen. Diese umfasst in einem „first hit“ ein gesteigertes Angebot an freien Fettsäuren durch vermehrte Lipolyse und De-novo-Lipogenese im Rahmen einer Insulinresistenz und gestörten β-Oxidation sowie einen gestörten Export von Triglyzeriden als VLDL (Very Low Density Lipoprotein). Oxidativer Stress und proinflammatorische Zytokine stellen einen Teil des „second hit“ dar. neueren Daten zufolge spielen erhöhte Endotoxine im Blut eine wichtige Rolle im Entzündungsprozess, wofür möglicherweise eine erhöhte Darmpermeabilität und so genannte PAMPs (Pathogen-associated Molecular Patterns) als Teil des Mikrobioms mitverantwortlich sind. Der Konsum von nahrungsmitteln mit hohem glykämischen Index und hohem Anteil an Fruktose (z. B. Softdrinks) steht hierbei als wichtige Einflussgröße im Fokus. Die Diagnose HCC wird immer häufiger auch ohne vorhandene Leberzirrhose gestellt, womit auch hier nicht immer die klassische Progression beobachtet wird. Risiko für einen pathologischen Krankheitsverlauf haben. Metabolische Faktoren wie Adipositas und DM 2 erhöhen zusätzlich das Risiko eines HCC. Unabhängig vom metabolischen Syndrom zeigt sich bei nAFLD-Patienten ein erhöhtes kardiovaskuläres Risiko, was auch die häufigste Mortalitätsursache darstellt. Auf den Plätzen 2 und 3 folgen extrahepatische und hepatische Ursachen, wobei gerade nASH-Patienten gegenüber der normalbevölkerung ein überproportional erhöhtes Risiko für hepatische Komplikationen haben (2,8 vs. 0,2 %). Der Schweregrad der nAFLD/nASH stellt zusätzlich einen unabhängigen Risikofaktor für kardiovaskuläre Komplikationen dar, was sich in einer erhöhten Gesamtsterblichkeit in nAFLD-Patienten widerspiegelt (Abb. 1). Erste Studien zeigen auch ein erhöhtes Risiko für fortgeschrittene kolorektale Adenome (inkl. serratierter Adenome) und neoplasien bei nAFLD, weshalb bei diesen Patienten vermehrt Augenmerk auf die Vorsorgekoloskopie gelegt werden sollte, welche möglicherweise schon vor dem 50. Lebensjahr erfolgen sollte.
(Differenzial-)Diagnostik: Da die meisten Patienten seitens nAFLD asymptomatisch sind, wird die Diagnose häufig als Zufallsbefund im Rahmen von Gesundenuntersuchungen, Versicherungsdurchuntersuchungen oder Krankenhausaufenthalten anderer Ätiologie gestellt. Eine meist im Abdomen-Ultraschall diagnostizierte Steatose kann neben der alkoholischen und vor allem der nicht-alkoholischen Fettlebererkrankung viele Ursachen haben, welche vor der endgültigen Diagnose abgeklärt werden müssen. neben der üblichen Alkoholgrenze von 20–30 g pro Tag werden zum Ausschluss einer alkoholischen Genese vor allem CDT, MCV, GGT und spezielle Fragebögen (AUDIT) herangezogen. Bei der BAFL oder BASH („both alcoholic and non-alcoholic“) ist eine oftmals ohnehin schon schwierige Unterscheidung in der Genese nicht möglich. Im Fokus der Differenzialdiagnose stehen die viralen Hepatitiden, die Speichererkrankungen (Hämochromatose, α1- Antitrypsin-Mangel, Mb. Wilson) und die medikamentös- toxische Genese.
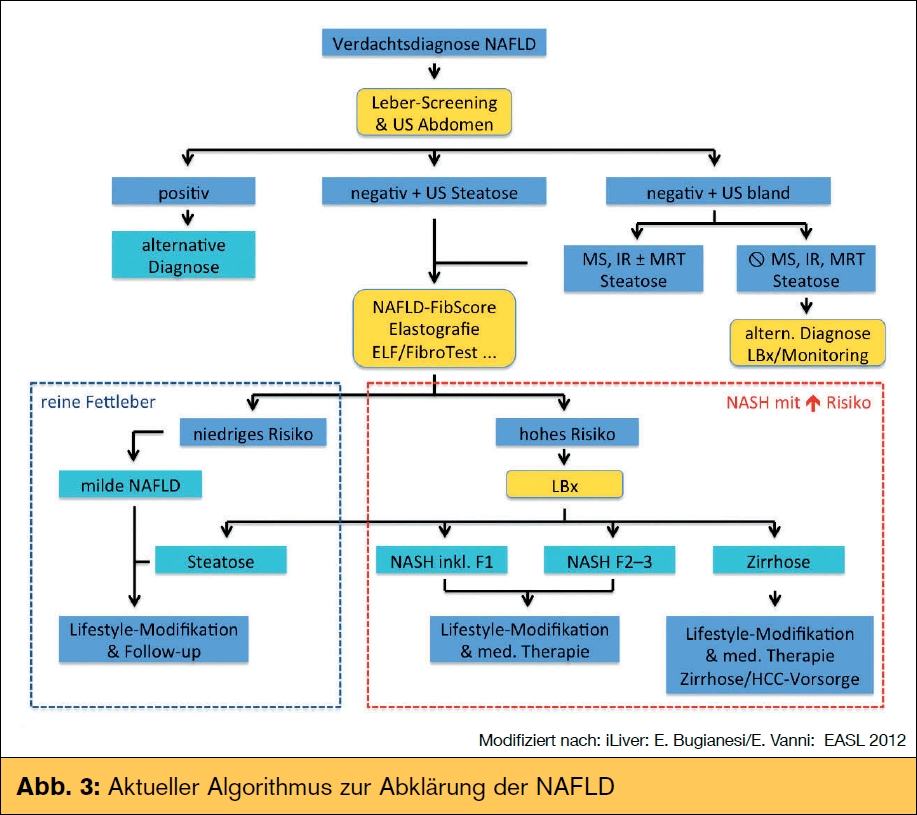
Die Patienten präsentieren sich im Wesentlichen asymptomatisch, wobei teilweise ein dumpfer Schmerz im rechten oberen Quadranten oder ein unbestimmtes Organgefühl an selbiger Stelle geäußert wird. Die Erstdiagnose wird häufig im Abdomen-US gestellt, der gute Ergebnisse in der Vorselektion liefert (Sensitivität 93,6 % [60,5–99,3], Spezifität 80,1 % [53,3–93,4]). Studien zeigen allerdings, dass anhand normaler Transaminasen eine nASH und selbst eine beginnende Fibrose nicht ausgeschlossen werden können und somit eine definitive Unterscheidung zwischen reiner Fettleber und nASH erst mittels Leberbiopsie (Goldstandard) möglich ist. Diese ermöglicht außerdem den Ausschluss anderer Ätiologien und die Unterscheidung zwischen Fibrose und Zirrhose, um ein optimales Management der Patienten zu gewährleisten. Gerade die Unterscheidung zwischen reiner Fettleber und progressiver Lebererkrankung mitAls klassische Hepatopathie zeigt die NAFLD im Vergleich zur Hepatitis C ein geringeres Zirrhose- und HCC-Risiko, weshalb es bei steigender Prävalenz eine große Herausforderung der nächsten Jahre sein wird, diejenigen Patienten herauszufiltern, welche ein erhöhtes Fibrose ist wichtig, um der Schlüsselfrage näherzukommen: Progression ja oder nein. Die MR-Spektroskopie könnte hier als virtuelle metabolische Leberbiopsie speziell im Forschungsbereich an Bedeutung gewinnen. Mittels der transienten Elastografie (Fibroscan®) lässt sich in der Klinik der Fibrosegrad grob einschätzen, wobei vor allem zwischen leichtund höhergradiger Fibrose unterschieden werden kann. Erste Ergebnisse zur zusätzlichen Einschätzung des Steatosegrades durch den neuen Zusatz CAPTM (Controlled Attenuation Parameter) sind vielversprechend, müssen aber in weiteren Studien bestätigt werden. Im Rahmen des letzten International Liver Congress 2012 in Barcelona wurde ein aktueller Algorithmus zur Abklärung der nAFLD vorgestellt, welcher in Abb. 3 dargestellt ist.
Zur Abschätzung des nAFLD/nASH-Risikos (z. B. Steato-Test, nASH-Test) oder des Fibrosegrades werden derzeit viele verschiedene Bluttests und Scores in Studien evaluiert (z. B. Fibrose: ELFTM-Test, FibroTest, FIB-4, nAFLD Fibrosis Score, FibroMeter nAFLD), wobei sich bisher kein Verfahren eindeutig durchsetzen konnte.
Therapie: Die wichtigste Säule des Managements der nAFLD ist weiterhin die Lifestyle- Modifikation (Diät, Ausdauertraining, Gewichtsreduktion). Bei nASH-Patienten mit maligner Adipositas konnte nach bariatrischen Eingriffen eine Verbesserung der Histologie gezeigt werden. Trotz positiver Effekte auf DM 2 und anderer metabolischer Effekte kam es weder unter Glitazonen noch unter Metformin gegenüber Placebo zu einer Verbesserung der Fibrose in der Histologie bei nAFLD/nASHPatienten, so dass der Einsatz aus rein hepatologischer Sicht kritisch gesehen werden muss. Das Design von Studien zu Omega- 3-Fettsäuren war sehr heterogen, weshalb bisher keine Empfehlung ausgesprochen wurde. Vitamin E ist weiter umstritten, da es zwar zu einer Verbesserung der Histologie kam, aber Bedenken zu möglichen nebenwirkungen (fraglich erhöhte Gesamtmortalität/erhöhtes Prostatakrebsrisiko) bisher nicht endgültig ausgeräumt werden konnten. Ursodesoxycholsäure wird derzeit nicht empfohlen, da auch hierbei keine positiven Effekte auf die Histologie gezeigt werden konnten. Erste Ergebnisse zu neuen Gallensäure-(GS)-Derivaten (z. B. nor-Ursodesoxycholsäure) und GS-Rezeptor- Agonisten (z. B. Farnesoid-X-Rezeptor-Liganden) in Mäusen sind vielversprechend und derzeit in klinischer Erprobung. Zur alleinigen Behandlung der nASH mittels Statinen fehlen derzeit die Daten. Zur Behandlung der Dyslipidämie bei nAFLD-Patienten kommen Statine selbst bei leicht erhöhten Transaminasen/GGT (< 3 x ULn) zum Einsatz, um das kardiovaskuläre Risiko zu senken. In der so genannten GREASE-Studie kam es im Verlauf sogar zu einem Abfall der Transaminasen. Bisher gibt es noch keine klinischen Daten zu GLP-1-Analoga oder DPP-4-Inhibitoren bei nASH, welche über einen positiven Einfluss auf die Insulinsekretion eine interessante Perspektive darstellen. Einen weiteren Therapieansatz könnte die derzeitige Erforschung des intestinalen Mikrobioms mit sich bringen.
FACT-BOX
Bei steigender Pravalenz und erhohter Gesamtmortalitat nimmt die Bedeutung der NAFLD aus hepatologischer als auch gesamtinternistischer Sicht weiter zu.
Die größte Herausforderung ist die Entwicklung von geeigneten Prognosemarkern für das Vorliegen einer progressiven Lebererkrankung im Sinne einer NASH und neuen Therapiekonzepten.
Statine sind wichtiger Bestandteil der kardiovaskularenRisikosenkung und auch beivVorliegen einer NAFLD sicher.
Neue Therapieansatze wie Kernrezeptor-Liganden, Gallensaure-Derivate und die neuen Antidiabetika versprechen interessante Losungsansatze und Perspektiven.