Hypoglykämie und Gewicht – Nebenwirkungen als Indikation
In den USA kam es in den letzten Jahren überraschenderweise zu einer Abnahme der Lebenserwartung bei gleichzeitiger Zunahme der Diabetesprävalenz.1 Als kausaler Faktor lässt sich der Anstieg der Adipositas, welche in enger Beziehung zum Diabetesrisiko steht, vermuten. Sowohl Typ-2-Diabetes als auch Adipositas erhöhen das Risiko für eine nichtalkoholische Fettlebererkrankung (NAFLD) und schließlich die nichtalkoholische Steatohepatitis (NASH). Letztere ist die häufigste Ursache für die Entwicklung einer Zirrhose und ist zudem mit dem hepatozellulären Karzinom assoziiert.2 In einem diabetischen Kollektiv kann die Prävalenz der NAFLD bis zu 76 % und jene der NASH bis zu 56 % betragen.3
Gewichtsreduktion als ausschlaggebendes Entscheidungskriterium
Diesen Tatsachen entsprechend stellt die Gewichtsreduktion durch Umstellung von Ernährungsgewohnheiten und Förderung von körperlicher Aktivität die erste Maßnahme in der Therapie des Typ-2-Diabetes dar – vor und neben einer medikamentösen Therapie. Paradoxerweise führen jedoch manche Antidiabetika wie Sulfonylharnstoffe, Pioglitazon und Insulin zu mitunter beträchtlichen Gewichtszunahmen bzw. erschweren die Gewichtsreduktion.4 Daher ist es sinnvoll und wünschenswert, Antidiabetika zu entwickeln, welche nicht nur den Blutzucker senken, sondern auch das Körpergewicht reduzieren.
Vielseitige Wirksamkeit: Glucagon-like Peptide 1 (GLP-1) erhöht die glukoseabhängige Insulinsekretion, vermindert die Glukagonausschüttung, verzögert die Magenentleerung und vermindert den Appetit mit Steigerung des Sättigungsgefühls.5 Zudem werden diesem Peptid noch protektive vaskuläre Eigenschaften durch Bindung an GLP-1-Rezeptoren in verschiedenen Organen zugeschrieben. Diese vielfachen Wirkungen erklären nicht nur die potente antidiabetische Wirksamkeit, sondern auch die Risikoverminderung für kardiovaskuläre und renale Endpunkte in Studien mit verschiedenen Vertretern dieser Substanzklasse.
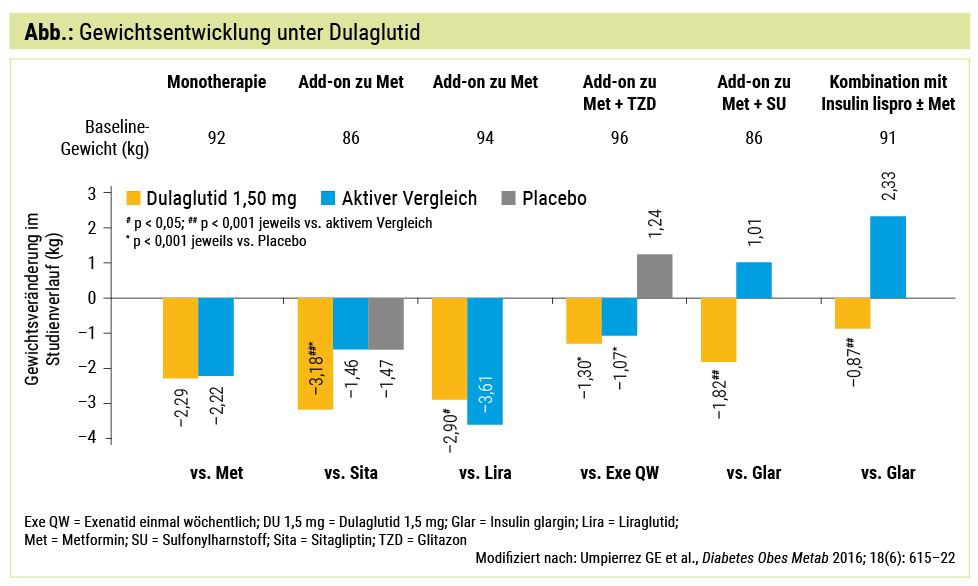
Betrachtet man nun die Gewichtsentwicklung in Studien mit Dulaglutid in Monotherapie oder Kombination mit anderen Antidiabetika, so finden sich Reduktionen des Körpergewichts von bis zu 3 kg im Mittel (Abb.).6 Das Ausmaß der Verminderung des Körpergewichts erscheint auf den ersten Blick nicht groß, allerdings muss man bedenken, dass über diesen relativ langen Zeitraum bei den meisten Interventionen dieser Effekt oft nicht mehr nachgewiesen werden kann. Aus der praktischen Erfahrung gibt es jedoch auch Patienten, die weitaus höhere Gewichtsreduktionen aufweisen. Interessanterweise berichten sie von einem verminderten Heißhunger auf Kohlenhydrate (Carbohydrate Craving).
Bezüglich der Therapie der NASH findet sich in kleinen Pilotstudien ein Hinweis auf die Wirksamkeit eines GLP-1-Rezeptoragonisten, in diesem Fall Liraglutid, hinsichtlich Verminderung der Steatose, des Ballooning und der Fibrose.7 So ist es nicht verwunderlich, dass derzeit eine Reihe von Studien mit GLP-1-Rezeptoragonisten hinsichtlich ihrer Wirksamkeit bei NASH durchgeführt wird.
Sodium-Glucose-Transporter-(SGLT-)2-Hemmer vermindern die Glukose- und Natriumreabsorption im proximalen Tubulus. Dies führt zu einer täglichen renalen Glukoseausscheidung von 70 g, was einem Verlust von 280 kcal pro Tag entspricht.8 Als Folge findet sich neben der Verminderung der Hyperglykämie eine Gewichtsreduktion von bis zu 3 kg. Diese Limitation dieses Gewichtsverlusts wird durch eine kompensatorische Hyperphagie erklärt. Eindrucksvoll ist bei dieser Substanzklasse nicht nur die Verminderung kardiovaskulärer Ereignisse, sondern auch die Renoprotektion, die durch die Reduktion des intraglomerulären Drucks verursacht wird.9
Vermeidung von Hypoglykämien
Hypoglykämien bedeuten nicht nur für die Patienten eine enorme Belastung, sondern führen über gegenregulatorische Maßnahmen zur Sympathikusaktivierung sowie über QT-Zeit-Verlängerung, endotheliale Dysfunktion und Blutgerinnungsanomalien vermutlich zu einem erhöhten Mortalitätsrisiko.10 In der ADVANCE-Studie konnte gezeigt werden, dass die Mortalität innerhalb eines Jahres nach Auftreten einer schweren Hypoglykämie erhöht ist.11 Bei Patienten mit Typ-2-Diabetes und Insulintherapie treten Hypoglykämien häufiger als bisher vermutet auf. So konnte die multizentrische HAT-Studie an 19.563 Menschen mit Typ-2-Diabetes zeigen, dass im Mittel bis zu 28 Episoden schwerer Hypoglykämien pro Jahr auftreten.12 Aus diesen Gründen ist der Einsatz von Medikamenten ohne hypoglykämischem Potenzial auch der Vorzug zu geben.
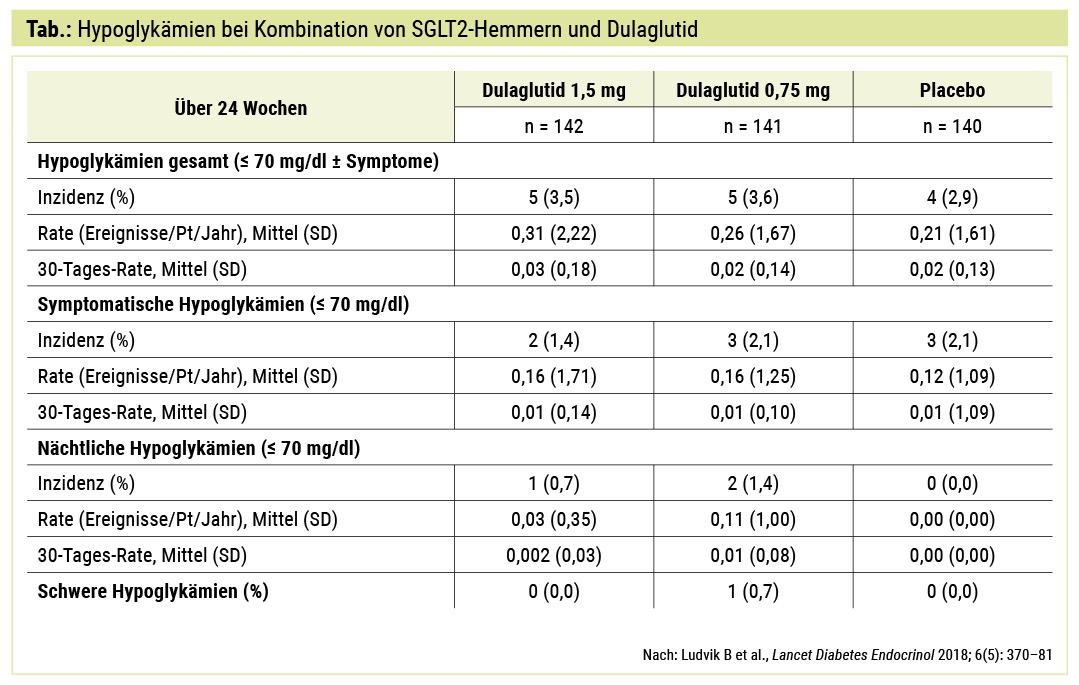
Sowohl GLP-1-Rezeptoragonisten als auch SGLT2-Hemmer weisen kein erhöhtes Risiko für Hypoglykämien auf. Die Wirkung von GLP-1 auf den Blutzucker ist nur bei hyperglykämischen Werten gegeben, und SGLT2-Hemmer haben keinen Einfluss auf die Insulinsekretion. In der AWARD-10-Studie, welche die Kombination von Dulaglutid mit SGLT2-Hemmern untersuchte, fand sich ein Hypoglykämierisiko auf Placeboniveau (Tab.).13
Resümee
Zusammenfassend finden sich sowohl für GLP-1-Rezeptoragonisten als auch für SGLT2-Hemmer günstige Effekte auf das Körpergewicht ohne Erhöhung des Risikos für Hypoglykämien. Es ist daher auch in Anbetracht der positiven kardiovaskulären Endpunktstudien diesen Substanzen – in Kombination mit Metformin – der Vorzug bei der Behandlung von Menschen mit Typ-2-Diabetes zu geben, wie dies auch in aktuellen Leitlinien abgebildet wird.