RET als Treiberalteration
Die Entdeckung der Rezeptor-Tyrosinkinase (RTK) RET im Jahr 1985 führte zu einem Paradigmenwechsel im Verständnis diverser physiologischer und Entwicklungsprozesse. Der Einfluss von Mutationen im RET-Gen spielt bei einer Reihe von Erkrankungen des Organsystems, wie beispielsweise der Hirschsprung-Krankheit, der multiplen endokrinen Neoplasie Typ 2 (MEN 2) sowie bei Karzinomen der Schilddrüse und der Lunge, eine Rolle. Zusätzlich wurde eine RET-Expression bei anderen Tumorerkrankungen identifiziert (invasiver Brustkrebs, duktales Pankreas-Adenokarzinom, Kolorektal-Adenokarzinom, Melanom, kleinzelliges Bronchialkarzinom, Neuroblastom, neuroendokrine Dünndarm-Tumoren). Die RET-Mutation ist nachweislich mit der Tumorproliferation, Invasion und Migration assoziiert (Abb. 1).1, 2 Das RET-Gen kodiert für eine transmembrane RTK mit protoonkogener Funktion, die Bezeichnung RET – REarranged during Transfection – stammt von der Entdeckung durch NIH/3T3-Zellen-Transfektion mit humaner Lymphom-DNA.1, 2 Die Aktivierung des RET–Gens erfolgt über onkogene Mutationen in familiären sowie sporadischen Tumorerkrankungen. Die RET-Aktivität trägt dabei zur tumorassoziierten Inflammation bei, durch Erhöhung von proinflammatorischen Zytokinen und Chemokinen innerhalb des Tumor-Microenvironments.3
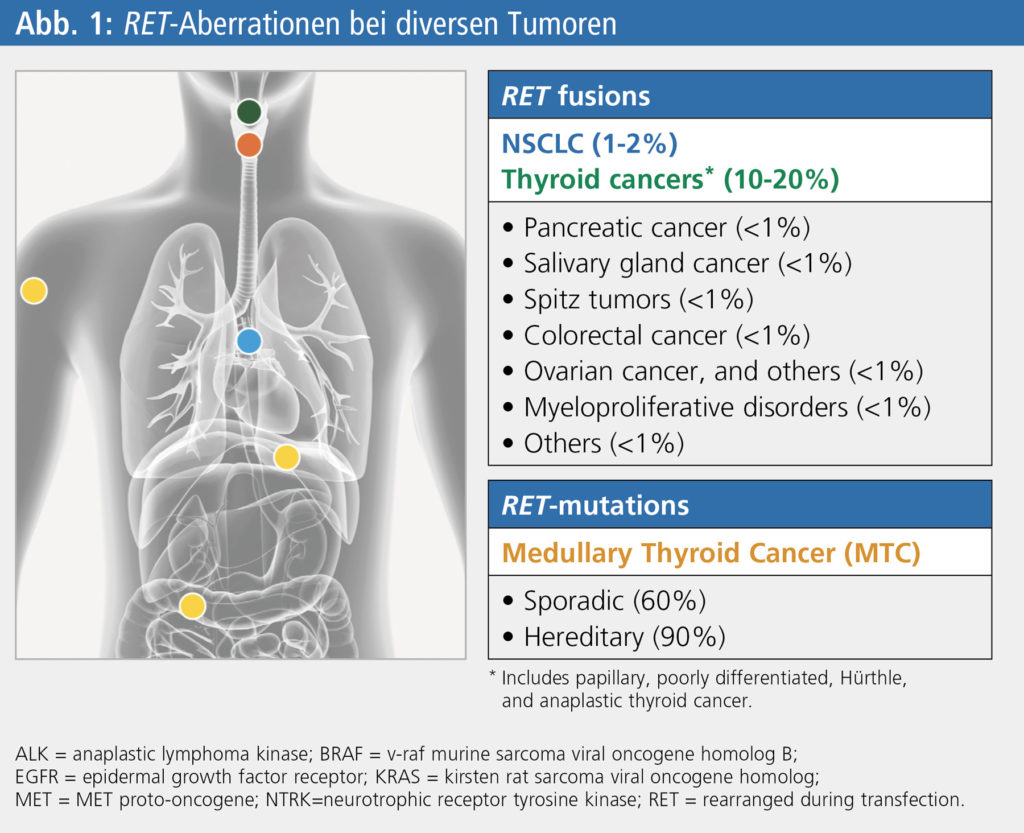
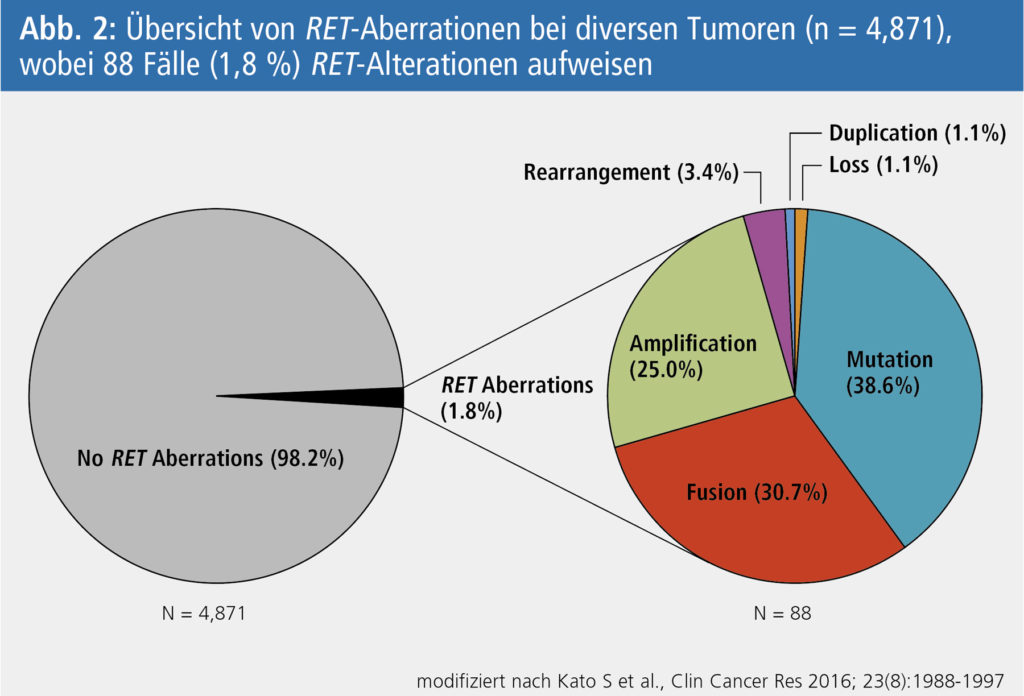
RET-Aberrationen
bei einigen häufigen und seltenen Karzinomen wurden mittels Next-Generation Sequencing (NGS) bei 4.871 Patienten untersucht (Abb. 2). Bei 88 Patienten (1,8 %) konnten RET-Alterationen detektiert werden, wobei Mutationen am häufigsten auftraten (38,6 %), gefolgt von Fusionen (30,7 %) und Amplifikationen (25 %). Bei den meisten dieser Patienten lagen zusätzlich zur RET-Anomalie andere koexistierende Aberrationen vor (81,8 %): p53-assoziierte Gene (59,1 %), zellzyklusassoziierte Gene (39,8 %), PI3K Signal Pathway (30,7 %), MAPK-Effektoren (22,7 %), andere Tyrosinkinase-Familien (21,6 %). Im Detail traten RET-Fusionen ausschließlich mit MAPK-Effektoren auf.4
Selektive Tyrosinkinase-Inhibitoren (TKI)
zielen spezifisch auf Targets wie RET ab und können als Therapeutika bei RET-assoziierten Erkrankungen (RET-Mutationen/RET-Fusion-positiv) eingesetzt werden.1, 2 Aktuell befinden sich die selektiven RET-Inhibitoren LOXO-292 (Selpercatinib)5 und BLU-667 (Pralsetinib)6 bereits in Phase-III-Studien.




















































































