Indikation: Blasenkarzinom
Metastasiertes Blasenkarzinom
IMvigor-130-Studie
In den finalen Gesamtüberlebensanalysen der „late-breaking abstracts“ #440 von Enrique Grande und #441 von Aristotelis Bamias der negativen IMvigor-130-Studie konnte weder für den Kombinationsarm Atezolizumab/Platin/Gemcitabin noch für den Atezolizumab-Monotherapie-Arm ein statistisch signifikanter Benefit gegenüber dem Kontrollarm Placebo/Platin/Gemcitabin in der Erstlinientherapie des fortgeschrittenen Blasenkarzinoms gezeigt werden. Cisplatin mit Atezolizumab zeigte ein besseres Ansprechen als Carboplatin und scheint dabei immunmodulatorische Effekte aufzuweisen.
Mit einem Gesamtüberleben von 13,4 Monaten in den Kontrollarmen gab es zwischen den beiden Platingruppen (Cisplatin/Gemcitabin vs. Carboplatin/Gemcitabin) keinen Unterschied. Lediglich in der für Cisplatin-nichtgeeigneten Gruppe mit hoher PD-L1-Expression war die Atezolizumab-Monotherapie signifikant besser. Atezolizumab wurde allerdings im November 2022 freiwillig als Erstlinie-Indikation durch die Firma Roche zurückgezogen.
Quelle: Grande E et al., ASCO GU 23, LBA #440,
Bamias A et al., ASCO GU 23, LBA #441
Lokalisiertes muskelinvasives Blasenkarzinom
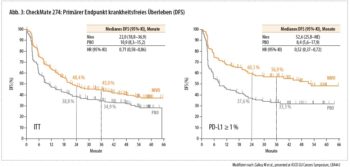
CheckMate 274
Bekannt ist: Die beiden primären Endpunkte der CheckMate-274-Studie wurden erreicht: Nivolumab adjuvant verbesserte das krankheitsfreie Überleben (DFS) im Vergleich zu Placebo in der ITT-Population sowie bei Patienten mit PD-L1-positiven Tumoren.
Matt Galsky berichtete nun die Follow-up-Daten (LBA #443). Nach einem medianen Follow-up von 36 Monaten zeigte das DFS in der ITT- und PD-L1-positiven Kohorte konsistente Ergebnisse mit einem Vorteil von ca. 11 Monaten verglichen zur Erstanalyse. Eine ca. 6-fache Verlängerung des progressionsfreien Überlebens (PFS) auf 52 vs. 8 Monate zeigte sich in der PD-L1-positiven Kohorte (Abb. 3). Die Kaplan-Meier- Kurven des OS verlaufen weiterhin separiert mit einer HR von 0,7 für die ITT und von 0,52 für die PD-L1-positive Gruppe, sind aber hinsichtlich der statistisch notwendigen Events noch immer nicht maturiert.
In einer Subgruppen-Analyse profitierten die Patienten mit Tumoren des oberen Harntraktes nicht von einer adjuvanten Nivolumab-Therapie.
Insgesamt traten keine neuen unerwarteten Nebenwirkungen auf, und die Grad-3-Rate lag für Nivolumab bei 18 %.
BCG-refraktäres nicht-muskelinvasives Blasenkarzinom (NMIBC)
KEYNOTE-057
Die Ergebnisse von Kohorte A (Carcinoma in situ +/– papilläre Tumore) der KEYNOTE-057 haben zur Zulassung von Pembrolizumab für die Behandlung von High-Risk-nicht-muskelinvasiven-Blasenkarzinom (-HR-NMIBC)-Patient:innen in den USA geführt. In der nun am ASCO GU von A. Necchi vorgestellten Kohorte B, die nur die papillären BCG-refraktären Tumoren umfasste und die sich in etwa zur Hälfte aus pT1- und pTa-High-Grade-Tumoren zusammensetzte, war Pembrolizumab nach einem Follow-up von 45 Monaten mit einer 12- monatigen DFS-Rate von 43,5 % ebenso effektiv wie bereits in der Kohorte A. Diese hinsichtlich des Umfanges und der langen Beobachtungszeit äußerst robusten Daten bestätigen Pembrolizumab als effektive systemische Therapieoption für Patient:innen mit einem unter BCG progredienten High-Risk-NMIBC, die nicht für eine Zystektomie in Frage kommen.
Quelle: Necchi A et al., ASCO GU23; LBA #442