Die Highlights vom ASCO 2010
Urogenitaltumoren
“Advancing quality through innovation” – unter diesem Motto kamen vom 4. bis zum 8. Juni 2010 rund 30.000 Onkologen aus aller Welt nach Chicago zum Jahrestreffen der American Society of Clinical Oncology (ASCO), um die neuesten Entwicklungen in der Krebsforschung und -therapie darzulegen. Die Fülle an neuen Daten wurde ausführlich und kritisch diskutiert, ebenso wie viele innovative Ansätze gezeigt und neue Ansätze für künftige Projekte angeregt wurden.
Nierenzellkarzinom
First-Line: Für die Erstlinientherapie beim metastasierten Nierenzellkarzinom sind nun insgesamt 6 verschiedene Medikamente bei der FDA zugelassen. Es gibt keine spezielle Referenz, welche Therapie für welche Patientenpopulation ideal ist. Lediglich für Everolimus ist diese definiert. Diese Situation überlässt den Therapeuten, mehr aus subjektiven als aus objektiven Kriterien, “die richtige Therapie” auszuwählen. Therapiealgorithmen, wie sie von ASCO determiniert wurden, sind diesbezüglich eine hilfreiche, jedoch keine absolute Unterstützung. Auch beim ASCO 2010 konnte diesbezüglich keine Richtung weitergegeben werden. Für “favourable” und “intermediate Risk” empfiehlt man Sunitinib, Pazopanib oder die Kombination Bevacizumab mit Interferon alpha. “Poor-Risk”-Patienten erhalten Temsirolimus. Da es bis dato keine Vergleichsstudien gibt (Head-to-Head), kann der Kliniker lediglich aus den Nebenwirkungsprofilen die Therapie für den Patienten individualisieren. Ein wesentlicher Punkt ist jedoch die Exposition des Patienten mit der eigentlichen Therapie. Diese ist sehr wohl abhängig von der Dosis und vom Dosierungsschema. Nebenwirkungen führen immer wieder zu Unterbrechungen, Verzögerungen und Dosisreduktionen. Die optimalen Daten beruhen jedoch auf dem Zusammenhang mit idealen Plasmakonzentrationen der einzelnen Medikamente. Dies impliziert auch ein optimales Management der Nebenwirkungen.
Aufgrund der vielen Zulassungsstudien mit so genanntem Cross-over-Design konnte gezeigt werden, dass eine sofortige vs. eine verzögerte Therapie im Gesamtüberleben keine signifikanten Unterschiede erbrachte. Dies sollte man überlegen, wenn man einen asymptomatischen Patienten mit Minimal Disease vor sich hat.
Second Line: Auch bei der Second-Line-Therapie gab es beim ASCO 2010 wenig Neuigkeiten. Die dafür zugelassene Therapie ist Everolimus. Alle anderen Studien mit Second-Line-TKI sind noch nicht abgeschlossen.
Neue Kombinationen: Bernard Escudier präsentierte die Ergebnisse der so genannten TORAVA-Studie, in der Bevacizumab und Temsirolimus kombiniert wurden. Die Kombination Temsirolimus/Bevacizumab konnte das primäre Studienziel progressionsfreies Überleben nicht verbessern. Über 50% der Patienten unterbrachen die Therapie, davon 40,9% wegen Toxizitäten. Im Gegensatz zu dieser Kombinationstherapie ist Bevacizumab in Kombination mit Everolimus voll dosierbar. Derselbe Autor konnte jedoch keinen positiven Effekt für das Überleben feststellen. Auch alle neoadjuvanten Studien sind derzeit nicht abgeschlossen, so dass die zytoreduktive Nephrektomie nach wie vor als Standardtherapie anzusehen ist.
Darüber hinaus …
Insgesamt wurde durch mehrere Autoren immer wieder festgestellt, dass die ungezielte Verwendung von Targeted Therapies derzeit Standard of Care ist und so genannte Profilstrategien in der Zukunft unbedingt notwendig sind, um auch die hohen Kosten der Möglichkeiten zu rechtfertigen.
Kriterien zum Messen des Ansprechens der Therapie von TKI: Seit Jahren werden RECIST-Kriterien 1.0 und 2.0 dafür herangezogen, diese sind jedoch unbefriedigend für die Therapie mit TKI. Chor et al. haben 2007 Kriterien eingeführt, die Veränderungen von Diametern und/oder Radiodichte von Herden in der Computertomographie verwenden (Veränderung der Radiodichte in Hounsfield-Einheiten). 2010 wurde anlässlich des ASCO Meetings nun von der Gruppe um Heng ein Ansprechen bestätigt, das durch eine Abnahme von 10% der Summe des längsten unidimensionalen Diameters als Prädiktor für das progressionsfreie Überleben und Gesamtüberleben definiert. Dieselbe Gruppe wiederum konnte diese Kriterien für das Ansprechen auch von Second-Line-TKI-Therapien darstellen.
Harnblasenkarzinom
Eine spanische Gruppe um Paz-Ares wollte mit einem Phase-III-Protokoll die Wirkung einer adjuvanten Chemotherapie mit Paclitaxel, Gemcitabine und Cisplatin vs. Beobachtung bewerten. Das Protokoll verlangte 340 Patienten, schlussendlich konnten in 7 Jahren nur 142 Patienten randomisiert werden. Die Studie ist damit deutlich underpowered. Das Gesamtüberleben war in der Therapiegruppe zum Zeitpunkt der Analyse noch nicht erreicht, im Beobachtungsarm 60%, hoch signifikant, aber wissenschaftlich von geringem Wert; somit ist ein neuerlicher Versuch, die adjuvante Therapie nach Zystektomie einzuführen, misslungen.
Ein EORTC-Protokoll für “Cisplatin-Chemotherapie-unfitte” Patienten wurde von DeSantis et al. vorgestellt. DeSantis verglich in einer Phase-II-III-Untersuchung Gemcitabin + Carboplatin mit Methotrexat+Carboplatin + Vinblastin. Bei 238 randomisierten Patienten konnte nach einer medianen Beobachtung von 4,5 Jahren kein signifikanter Unterschied in der Effektivität der Therapie festgestellt werden. Vom Nebenwirkungsprofil war das Triplet etwas toxischer als das Doublet.
Prostatakarzinom
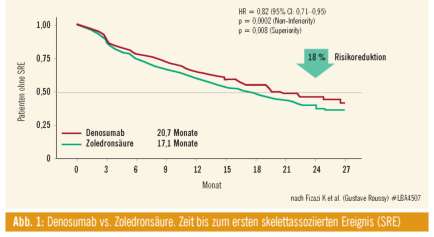
Fizazi et al. stellte bei den Late-breaking Abstracts (LBA 4507) eine Studie mit Denosumab vs. Zoledronsäure bei der Behandlung von Knochenmetastasen beim kastrationsrefraktären Prostatakarzinom vor. Diese Studie lief unter österreichischer Beteiligung. Sämtliche Endpunkte wurden erreicht. Der erste Endpunkt war die Zeit zum ersten skeletal relevanten Event (SRE), die Hazard Ratio war 0,82, die Risikoreduktion damit 18% (Abb. 1). Selbiges galt für das zweite Studienziel “Zeit zu weiteren Knochenevents”: Es wurde eine Risikoreduktion um 18% erzielt. Enttäuschend fiel auf, dass Overall Survival und Cancer Specific Survival dadurch nicht beeinflusst wurden. Sehr positiv ist zu bemerken, dass Denosumab bei Niereninsuffizienz gegeben werden kann. Die Hauptnebenwirkungen sind Hypokalzämie, ähnlich der Zoledronsäure, allerdings doppelt so viele Fälle von Osteonekrose im Kiefer (1,3% vs. 2,3%). In jedem Fall sollte der Patient vor Therapie mit Zoledronsäure oder Denosumab einem Zahnarzt vorgestellt werden.
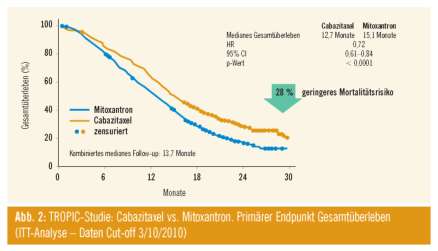
De Bono stellte das TROPIC-Protokoll vor. Hier wurden Cabazitaxel 25 mg/m2 3-wöchentlich vs. Mitoxantron 12 mg/m2 3-wöchentlich verglichen. Das mediane Gesamtüberleben war 15,1 vs. 12,7 bei einer HR von 0,72, damit eine Risikoreduktion von 28% (Abb. 2). Das progressionsfreie Überleben war mit 1,4 vs. 2,8 Monate ebenfalls signifikant. Enttäuschend war, dass schmerzmäßig kein Ansprechen festgestellt werden konnte. Vom Nebenwirkungsprofil gab es ähnliche Nebenwirkungen und Komplikationen wie bei Docetaxel. Auffällig war, dass insgesamt 10 von 371 Patienten an der Therapie verstorben sind (4,9%). Dies wird noch weiter zu analysieren sein. Das Protokoll wurde als Second-Line-Therapie nach Docetaxel eingesetzt. Die Überlebensraten waren damit sehr hoch. Das Präparat ist in den USA daraufhin zugelassen worden. In Europa erwartet man die Zulassung für Anfang 2011.
Kelly et al. stellten die Kombinationstherapie Docetaxel plus Bevacizumab vs. Docetaxel-Monotherapie vor. Hier konnte kein Vorteil beim Gesamtüberleben gefunden werden. Das Progression Free Survival konnte von 7,5 auf 9,9 signifikant verbessert werden. Sowohl PSA-Abfall unter 50% als auch objektives Ansprechen waren signifikant besser, unterschiedlich aber auch hier die Nebenwirkungen. Diese traten deutlich mehr und häufiger unter der Kombination auf. Behandlungsbezogene Todesfälle waren 3,8 vs. 1,1.
Scher et al. berichteten von der ASCENT-2-Studie, die Standard 3 Wochen Docetaxel mit Docetaxel 1 Woche + hochdosiertes Calcitriol verglich. Letzteres erbrachte ein signifikant kürzeres Gesamt- und krankheitsspezifisches Überleben (16,8 vs. 19,9 Mo medianes Gesamtüberleben). Die wöchentliche Gabe von Docetaxel ist wie bei der Zulassungsstudie der dreiwöchentlichen Gabe unterlegen.
Immuntherapie: Philip Kantoff stellte beim ASCO 2010 eine neuartige Immuntherapie beim Prostatakarzinom vor. Diese autologe zelluläre Immuntherapie wurde in einer Phase-III-Studie (IMPACT) untersucht. Das mediane Gesamtüberleben für den Therapiearm war 25,8 Monate, für den Placeboarm 21,7 Monate (HR: 0,759). Dieses Präparat wurde nun von der FDA zugelassen, nachdem es primär abgelehnt wurde. Die Kosten in den USA belaufen sich für 3 Infusionen = 1 Zyklus um 93.000 Dollar. Die Einführung in Europa ist derzeit noch nicht geplant.
Prim. Dr. Wolfgang Loidl
Prostatazentrum Krankenhaus Barmherzige Schwestern Linz