CMV-Infektionen nach allogener hämatopoetischer Stammzelltransplantation
Das humane Cytomegalovirus (CMV) wird in der Literatur auch als humanes Herpesvirus Typ 5 bezeichnet und gehört zur Familie der Herpesviridae, Subfamilie Betaherpesviridae, Genus Cytomegalovirus. Diese Viren haben die Eigenschaft, zur Vergrößerung von infizierten Zellen beizutragen (Cytomegalie) und können charakteristische Einschlusskörperchen bilden.
Es handelt sich bei CMV um ein weltweit verbreitetes Virus, welches in ungefähr der Hälfte der europäischen Bevölkerung nachgewiesen werden kann. Altersabhängig steigt der Durchseuchungsgrad und korreliert mit dem sozioökonomischen Status.1 Nach einer Primärinfektion kommt es zu einer lebenslangen Viruspersistenz, was eine typische Eigenschaft der Herpesviren ist. Zu CMV-Reaktivierungen kann es dann kommen, wenn das Immunsystem geschwächt ist, besonders bei einer eingeschränkten T-Zell-Antwort.
Klinik und Pathogenese
Bei Immunkompetenten verlaufen die meisten CMV-Primärinfektionen asymptomatisch oder mit leichten, wenig charakteristischen Symptomen und zum Teil unter dem Bild einer Mononukleose. Das Virus gelangt über Schleimhautkontakte oder parenteral über zellhaltige Blutkomponenten, durch Stammzell- oder Organtransplantationen in den Organismus. Besonders bei Immunsupprimierten kann CMV, wenn es nicht rasch behandelt wird, zu einer generalisierten Infektion mit Organbeteiligung wie Enzephalitis, Pneumonie, Retinitis, Hepatitis, Nephritis, Splenomegalie und Colitis führen.
Die Virusreplikation kann in vielen Zellen und Geweben erfolgen, wie z. B. in epithelialen Zellen, Endothelzellen, verschiedenen Parenchymzellen und mononuklären Blutzellen. In der Virämiephase kann CMV über Körperflüssigkeiten wie Speichel, Urin, Ejakulat und vaginale Sekrete ausgeschieden werden. CMV hat die Fähigkeit, sich in zelluläre Reservoire zurückzuziehen. Hier werden vor allem das Knochenmark mit der CD34+-myeloiden Vorläuferzelle und die im Blut vorkommenden CD14+-Monozyten diskutiert.1
Spezielle Population – Stammzelltransplantierte: Zu einem besonders gefährdeten Kollektiv zählen Empfänger von allogenen hämatopoetischen Stammzelltransplantaten nach Chemo- oder Radiochemo-Konditionierung. Nachdem ein optimaler HLA-(Human Leukocyte Antigen-)Stammzellspender gefunden wurde, sollte im nächsten Schritt u. a. auch der CMV-Status gematcht werden, denn die Konstellation des CMV-Serostatus von Spender und Empfänger beeinflusst die Inzidenz und den Schweregrad der klinischen Manifestation von CMV-Infektionen bzw. -Reaktivierungen.3 Das Risiko einer CMV-Infektion steigt dabei mit dem Grad und der Dauer der Immunsuppression und ist in der ersten Phase nach Transplantation besonders hoch.4 Im Idealfall sollten CMV-seronegative Empfänger auch ein CMV-seronegatives Transplantat erhalten. In diesem Fall ist die Inzidenz einer CMV-Infektion am geringsten. Weiters sollte unbedingt auf leukozytendepletierte Blutkonserven geachtet werden. Das Risiko steigt etwas, wenn der seronegative Empfänger ein CMV-positives Transplantat bekommt. In diesem Fall ist das Virus dem sich entwickelnden Immunsystem schon bekannt. Wenn der Empfänger CMV-seropositiv ist, dann steigt das Risiko einer CMV-Erkrankung auf 36 bis 50 %, je nach Spenderstatus.
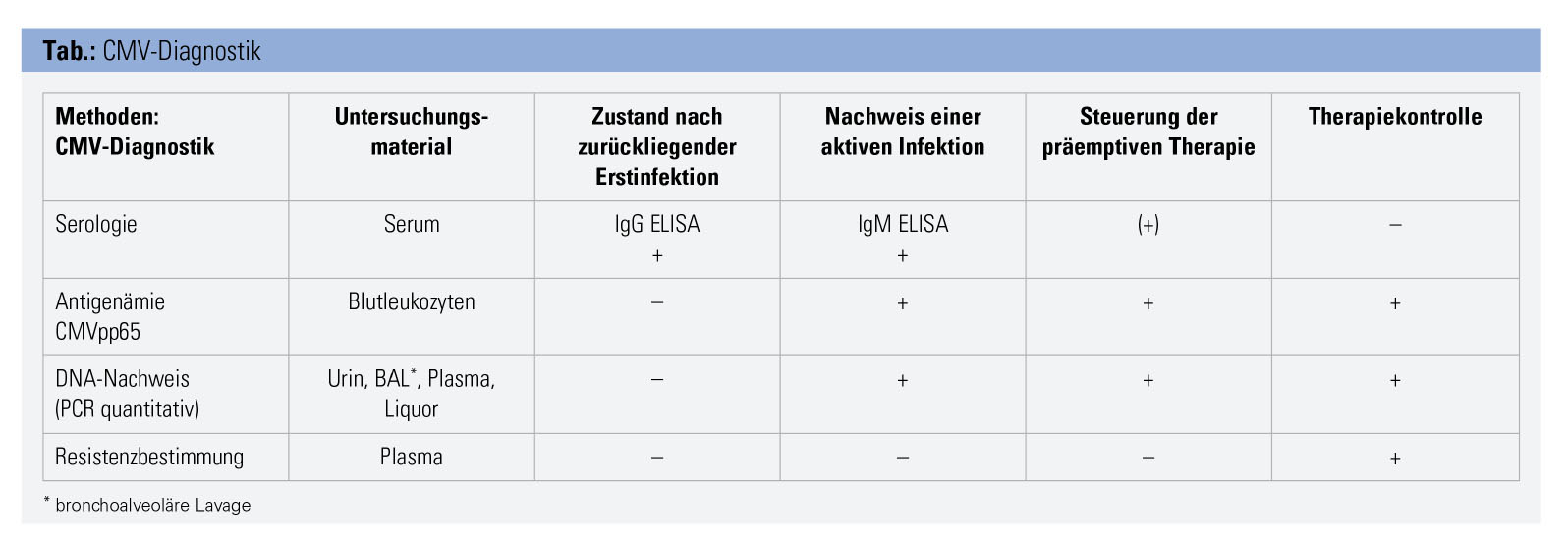
Diagnostik
Heutzutage stehen hochsensitive quantitative Nukleinsäure-Amplifikationstechniken (NAAT) aus Plasma oder Vollblut zur Verfügung, die es ermöglichen, auch niedrigste Virusmengen zu detektieren (Tab.). Regelmäßige (in der Regel wöchentliche) Viruslastmessungen ermöglichen den stammzelltransplantierten Patienten eine präemptive Therapie (siehe unten) bei einem Viruslastanstieg. Weiters soll der nun von der WHO eingeführte Standard IU/ml die Heterogenität der verschiedenen NAAT-Methoden reduzieren und die Viruslastmessungen vergleichbarer machen.3
Eine etwas weniger sensitive Methode stellt der Antigennachweis des viralen Tegumentproteins pp65 in Blutleukozyten von Patienten mit akuten CMV-Infektionen dar. Der Nachteil dieses Tests: Er ist einerseits abhängig von der Gesamtleukozytenzahl des Patienten und erfordert andererseits für die optimale Sensitivität eine rasche Probenverarbeitung (binnen 24 Stunden).
Weitere wichtige Methoden in der CMV-Diagnostik sind die Bestimmung der virusspezifischen IgG- und IgM-Antikörper mittels ELISA-Technik. Der Hauptstellenwert der Serologie liegt in der Feststellung des Infektionsstatus von Spender und Empfänger. Die Reaktivierung (oder Sekundärinfektion) kann serologisch durch Nachweis eines signifikanten Titer-Anstiegs von CMV-spezifischen Antikörpern festgestellt werden. Ein zusätzliches Tool stellt die Aviditätsbestimmung der IgG-Antikörper dar. Mit diesem Test kann zwischen einer primären Infektion (niedrige Avidität bei Bindung gegen multivalentes Antigen) und einer sekundären Infektion (hohe Avidität) unterschieden werden.
Eine alleinige Infektionsüberwachung von stammzelltransplantieren Patienten mit Hilfe von serologischen Methoden muss allerdings als unzureichend betrachtet werden.
Prophylaxe und Therapie
Das Management von CMV-assoziierten Erkrankungen ist nach wie vor eine große Herausforderung bei stammzelltransplantierten Patienten.5 Es stehen verschiedene antivirale Substanzen für die Prophylaxe und für die Therapie zur Verfügung, die jedoch auch mit einem erheblichen Nebenwirkungsspektrum behaftet sind. Prophylaktische Maßnahmen können bei Patienten begonnen werden, bei denen Virus und Erkrankung nicht nachweisbar sind. Als präemptive Therapie wird die Behandlung mit antiviralen Substanzen bei Patienten definiert, bei denen eine CMV-Virämie, nicht jedoch eine manifeste Erkrankung diagnostiziert wurde. Um das sich entwickelnde Knochenmark möglichst wenig zu hemmen, wird heutzutage eher der präemptiven Therapie der Vorzug gegeben.6
DNA-Polymerase-Inhibitoren: Ein wichtiger Vertreter ist das Ganciclovir, ein Nukleosid-Analogon, welches intravenös verabreicht wird. Als Valganciclovir kann dieses Präparat auch für die orale Behandlung verwendet werden. Diese Substanzen haben jedoch ein relativ enges therapeutisches Fenster, da sie in höheren Dosen myelotoxisch wirken. Wird zu niedrig dosiert, erhöht sich die Gefahr der Resistenzentwicklung.
Alternativen dazu sind einerseits das Nukleotidanalogon Cidofovir sowie der nicht nukleosidische Polymeraseinhibitor Foscarnet. Diese beiden Substanzen können zum Teil schwerwiegende nephrotoxische Arzneimittelwirkungen haben.
CMV-DNA-Terminasekomplex-Inhibitoren: Gute Erfolge konnten nun mit Letermovir erzielt werden, welches den viralen Terminasekomplex hemmt. Dieses bereits für die CMV-Prophylaxe bei stammzelltransplantierten Patienten zugelassene Virostatikum7 zeigte zu Woche 24 eine signifikante Reduktion der Mortalität von Letermovir-behandelten Patienten gegenüber der Placebogruppe (10,2 % vs. 15,9 %, p = 0,03). Die Substanz hat ein vorteilhaftes Nebenwirkungsprofil, da sie spezifisch ein CMV-Enzym hemmt, ohne Aktivität gegen humane Enzyme. In der Zulassungsstudie konnte gezeigt werden, dass Letermovir-behandelte Patienten gleich häufig Nebenwirkungen hatten wie die Placebogruppe. Für die prophylaktische Therapie erhielten die Patienten 480 mg Letermovir täglich. Bei gleichzeitiger Gabe von Ciclosporin musste die Dosis halbiert werden. Weiters weist Letermovir keine Kreuzresistenzen mit den DNA-Polymerase-Hemmern auf, weil es das Terminase-Subunit UL-56 inhibiert.
Im Gegensatz dazu kann es unter der Therapie der oben erwähnten DNA-Polymerase-Inhibitoren (Ganciclovir, Cidofovir und Foscarnet) vor allem bei längerem und wiederholtem Einsatz zu Resistenzen kommen, welche die Region UL-54 und UL-97 betreffen. Die Resistenzmutationen in diesen Genabschnitten sind gut charakterisiert und können mittels Sequenzanalyse erfasst werden. Wenn es in seltenen Fällen zu Kreuzresistenzen im Polymerase-Gen kommt, dann sind die Substanzen Ganciclovir, Cidofovir und Foscarnet wirkungslos.
Ausblick
Aus diesem Grund ist die Entwicklung neuer antiviraler Arzneimittel für die Behandlung von CMV besonders bei stammzelltransplantierten Patienten von großer Bedeutung. Derzeit werden zum Beispiel Maribavir und Brincidofovir in großen Studien getestet, jedoch mit unterschiedlichen Erfolgen.8 Auch an der Entwicklung von Impfstoffen wird gearbeitet. Der latente Infektionszyklus von CMV, die stammspezifischen Variationen sowie eine mangelnde Induktion des Impfschutzes sind Gegenstand der aktuellen Forschung.9
Die adoptive Immuntherapie mit CMV-spezifischen CD8+-zytotoxischen T-Zellen hat sich in den letzten Jahren zunehmend als nebenwirkungsarme Therapieoption zu antiviralen Arzneimitteln entwickelt.10 Dabei werden dem Empfänger vom Transplantatspender aktivierte T-Zellen und immunologische Gedächtniszellen durch Transfusion übertragen. Diese Form von Therapie ermöglicht dem Empfänger einen raschen Wiederaufbau der zellulären Abwehr gegen CMV.