Zollinger-Ellison-Syndrom
Das Zollinger-Ellison-Syndrom (ZES) wurde 1955 erstmals durch die Chirurgen Robert M. Zollinger und Edwin H. Ellison in Columbus, Ohio, beschrieben. Nach dem Insulinom ist es das zweithäufigste funktionelle Syndrom unter den gastroenteropankreatischen neuroendokrinen Tumoren (GEP-NETs) und bedingt durch die ektope Produktion von Gastrin durch ein Gastrinom, welches insbesondere im Duodenum oder im Pankreas lokalisiert ist.
Sporadische und hereditäre Gastrinome
Die Inzidenz des Gastrinoms ist mit 0,1 bis 3 Personen pro 1 Mio. pro Jahr sehr gering, wobei ein Altersgipfel zwischen 40 und 50 Jahren zu beobachten ist und Frauen häufiger betroffen sind als Männer.
Etwa 75 % der ZES-Fälle treten sporadisch auf. Entgegen der früheren Annahme, dass Gastrinome hauptsächlich im Pankreas lokalisiert sind, belegen aktuelle Daten, dass sie dreimal häufiger im Duodenum als im Pankreas vorkommen, womit Gastrinome die einzigen endokrin aktiven GEP-NETs des Duodenums darstellen.
Sporadische duodenale Gastrinome sind meist sehr klein (< 1 cm im Durchmesser) und primär in der Submukosa lokalisiert. Bei größeren Tumoren ist häufig auch eine Infiltration von Mukosa und Muscularis propria zu beobachten. Zum Zeitpunkt der Erstdiagnose liegen bei 60–80 % der Fälle bereits periduodenale und peripankreatische Lymphknotenmetastasen vor, welche generell ein schnelleres Wachstum aufweisen als das Primum. Pankreatische Gastrinome sind allgemein größer als duodenale, weisen eine höhere Proliferationsrate auf und metastasieren in einem höheren Prozentsatz in die Leber, weshalb sie auch eine generell schlechtere Prognose haben.
Etwa 25 % der ZES-Fälle sind durch ein hereditäres Gastrinom im Rahmen des MEN1-(Multiple Endokrine Neoplasie Typ 1-)Syndroms bedingt, das durch das Auftreten einer Hyperplasie oder eines Tumors in Hypophyse, Nebenschilddrüsen und Inseln des Pankreas charakterisiert ist. Umgekehrt weisen 30–50 % der MEN1-Patienten ein ZES auf, wobei typischerweise ein multizentrisches duodenales Gastrinom vorliegt. Gastrinome des Pankreas sind nur äußerst selten mit MEN1 assoziiert, wenngleich bei den betroffenen Patienten häufig multiple endokrine Mikro- und Makrotumore im Pankreas vorliegen. Diese produzieren aber in der Regel keine signifikanten Mengen an Gastrin. Das metastatische und biologische Verhalten von MEN1-assoziierten duodenalen Gastrinomen entspricht jenem der sporadisch auftretenden.
Extraduodenale und extrapankreatische Gastrinome sind äußerst selten. Ihr Auftreten in Magen, Jejunum, Gallenwegen, Leber und Niere sowie das Vorkommen von endokrinen, gastrinbildenden Zellen in ovarialen oder pankreatischen muzinös-zystischen Tumoren kann sporadisch mit dem ZES assoziiert sein.
Pathophysiologie und Symptomatik
Gastrin, das nach Sekretin als zweites Hormon entdeckt wurde, wird normalerweise von den G-Zellen des Antrums produziert und erreicht über die Zirkulation den proximalen Magenanteil (Fundus und Corpus), wo es die Parietalzellen zur Salzsäuresekretion stimuliert. Im Nüchternzustand ist der Serum-Gastrinspiegel sehr niedrig, nach Stimulation, hauptsächlich durch Essen und hohen pH-Wert im Magen, steigt das Serum-Gastrin an, und Magensäure wird sezerniert. Deshalb produzieren wir im Nüchternzustand nur ganz wenig HCl im Magen, postprandial kommt es jedoch zu einem deutlichen Anstieg. Bei Vorliegen eines Gastrinoms ist der Serum-Gastrinspiegel permanent erhöht, und es werden große Mengen an Magensäure, oft viele Liter pro Tag, gebildet. Dies führt zu hartnäckigen peptischen Läsionen – Ulzera, die oftmals mit Komplikationen wie schwerer Blutung und Perforation assoziiert sind. Normalerweise liegt im Duodenum nach dem Bulbus, also in den ersten Zentimetern nach dem Pylorus, bereits ein neutraler pH-Wert vor, der u. a. durch Bicarbonatskretion (Brunnersche Drüsen, Pankreassaft) bedingt ist. Beim ZES besteht ein stark saurer pH-Wert weit über das Treitzsche Ligament hinaus, was eine Schädigung der Schleimhaut mit Bildung von mehreren Ulzera und Schleimhautblutungen distal des Bulbus duodeni verursacht. Solche Blutungen im proximalen Dünndarm (Abb. 1) waren vor der Verfügbarkeit von Protonenpumpenhemmern (PPIs) ein großes klinisches Problem. Auch die ersten beiden in der Literatur beschriebenen ZES-Patienten hatten als erste von vielen Operationen segmentale Dünndarmresektionen wegen Blutung.
Durch die massiv gesteigerte Bildung von Magensäure kommt es im Rahmen des ZES zu einer schweren peptischen Geschwürskrankheit, die wegen ihrer Hartnäckigkeit an einen „secretory drive“, in dem Fall durch Gastrin, denken lassen sollte. Zollinger selbst, den der Seniorautor dieses Beitrags persönlich kannte, war bis zu seinem Tod der Überzeugung, dass die einzig erfolgreiche Therapie hier eine totale Gastrektomie darstellt. Heute kann die Magensäuresekretion allerdings durch PPIs gut beherrscht werden. Wichtig ist auch zu wissen, dass bis zu 10 % der ZES-Patienten als Erstmanifestation wässrige Diarrhö aufweisen. Die vielen Liter an Magensäure, die in den Dünndarm fließen (wir haben bei einer ZES-Patientin mit Pefusionsstudien gezeigt, dass täglich 15 Liter Flüssigkeit vom Magen in den Dünndarm eintreten), überwältigen die absorptive Kapazität des Darms. Nach Verabreichung von PPIs in ausreichender Dosis verschwindet der Durchfall. Starkes Erbrechen kann bei ZES-Patienten durch den Verlust an HCl zu einer schweren, lebensbedrohlichen hypochlorämischen metabolischen Alkalose führen. Wir hatten einmal einen Patienten, bei dem es dabei sogar zu einer „Chlorid-Bicarbonat-Umkehr“ kam (Serumchlorid: 62 mEq/l, Serumbicarbonat: 65 mEq/l).
Diagnose
Die Diagnose des ZES stellt vielfach eine Herausforderung dar. Durchschnittlich vergehen 8 Jahre von Beginn der ersten Symptome bis zur gesicherten Diagnose. Dies liegt einerseits in der Seltenheit begründet (etwa 5 Fälle in ganz Österreich pro Jahr), andererseits in der weit verbreiteten Einnahme von PPIs, durch die die peptische Geschwürskrankheit lange beherrscht werden kann. Bei sehr hohen Gastrinspiegeln (Erhöhung zwanzigfach und mehr) und dem Vorliegen eines Tumors in der Bildgebung ist die Diagnose meist klar. Leicht erhöhte Gastrinspiegel können aber auch andere Ursachen wie atrophe Corpusgastritis, Niereninsuffizienz, Zustand nach Vagotomie, G-Zellhyperplasie (verursacht extrem selten ZES-ähnliche Symptome; Pseudo-ZES) oder ein zurückgebliebener Antrumteil nach Billroth-II-Resektion haben. Von praktischer Bedeutung ist dabei nur die Achlorhydrie bei atropher Corpusgastritis.
Der intravenöse Sekretintest ist diagnostisch hilfreich: Gastrin von G-Zellen in der Mukosa sinkt, Tumorgastrin steigt an. Wichtig ist dabei, dass PPIs mindestens eine Woche vor Durchführung des Tests abgesetzt werden. Aufgrund der möglichen Assoziation mit MEN1 sollte bei Patienten mit ZES immer auch eine MEN1-Diagnostik mit Genanalyse erfolgen.
Die moderne Bildgebung erlaubt meist, auch kleine Tumore zu finden, wobei die Somatostatin-Rezeptorszintigrafie (SRS, OctreoScan®) sensitiver als Computer- (CT) und Magnetresonanztomografie (MRT) ist. Endoskopischer Ultraschall (EUS) kann in Fällen mit besonders kleinen pankreatischen Tumoren MRT und CT überlegen sein. Die Positronen-Emissions-Tomografie (PET) kommt insbesondere zur Detektion von Metastasen zum Einsatz.
Prognose
Etwa 75 % der Gastrinome sind maligne und weisen Metastasen in den Lymphknoten, der Leber oder anderen Organen auf. Bei duodenalen Gastrinomen zeigt sich dabei im Vergleich zu pankreatischen Gastrinomen eine signifikant höhere Inzidenz an Lymphknotenmetastasen (70 % vs. 40 %). Ohne Metastasenbefall der Leber (Lebermetastasen kommen in nur ca. 10 % der Fälle mit duodenalem Gastrinom vor) haben Lymphknotenmetastasen allerdings keinen Effekt auf das 10-Jahres-Überleben, welches für duodenale Gastrinome mit 84 % angegeben wird. Pankreatische Gastrinome haben durch die höhere Inziden
z an Lebermetastasen eine generell schlechtere Prognose. Das 10-Jahres-Überleben nach operativer Intervention liegt bei lediglich 15 %. Patienten mit pankreatischem Gastrinom ohne Lebermetastasen weisen hingegen ein 20-Jahres-Überleben von 95 % auf.
Therapie
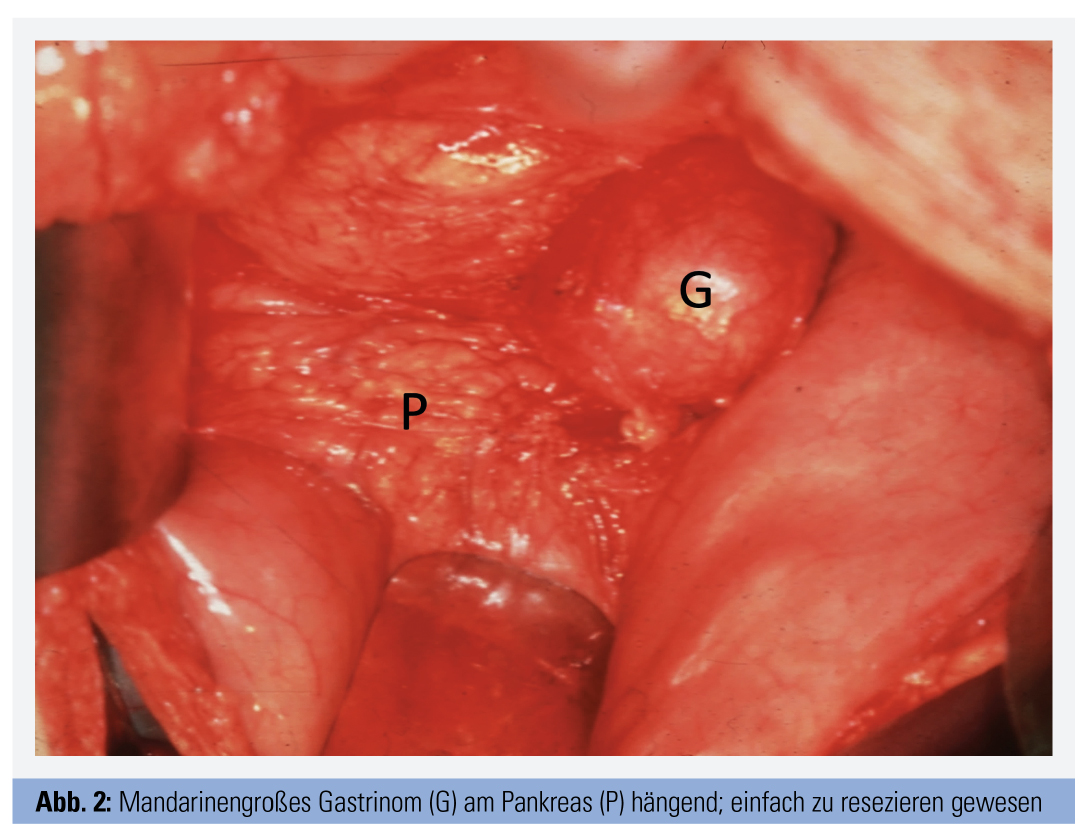
Insbesondere bei sporadischen Gastrinomen stellt die Tumorresektion die Therapie der Wahl dar (Abb. 2). Bei MEN1-assoziiertem ZES ist die chirurgische Intervention aufgrund des typischen Vorliegens von multiplen Tumoren meist weniger zweckmäßig.
Liegt ein Hyperparathyreoidismus im Rahmen von MEN1 vor, welcher zusätzlich einen hyperkalziämiebedingten Anstieg von Gastrin bewirkt, kann eine subtotale Parathyreoidektomie zur besseren Symptomkontrolle erwogen werden. Bereits Robert Zollinger stellte fest, dass 25 % seiner ZES-Patienten eine Parathyreoidektomie brauchten.
Die „Basistherapie“ des ZES besteht in der Verabreichung von PPIs, wobei die Dosis auf einen Säure-Output (wenn man die Möglichkeit zur Messung hat) von < 15 mEq pro Stunde bzw. < 5 mEq pro Stunde nach chirurgischer Intervention (falls postoperativ noch Bedarf besteht) zu adaptieren ist. Eine typische orale PPI-Dosis beläuft sich dabei auf das Zwei- bis Vierfache der Standarddosis. Bei Patienten mit fortgeschrittener Erkrankung können darüber hinaus alle verfügbaren Therapien für GEP-NETs zum Einsatz kommen. Dazu gehören vor allem Chemoembolisation, selektive interne Radiotherapie (SIRT), Peptidradiorezeptortherapie (PRRT), Somatostatin-Analoga (Octreotid, Lanreotid), mTOR-Inhibitoren (Everolimus), Rezeptor-Tyrosinkinase-Inhibitoren (Sunitinib) und zytotoxische Chemotherapie.