Moderne Epilepsiediagnostik
Epilepsien gehören zu den häufigsten chronischen neurologischen Erkrankungen. Weltweit sind rund 50 Millionen Menschen betroffen, was einer Prävalenz von etwa 0,6–1 % entspricht. In Österreich liegt die Zahl der Betroffenen Schätzungen zufolge bei rund 80.000–90.000, wobei die höchste Inzidenz in der Kindheit und im höheren Lebensalter auftritt. Die Diagnose einer Epilepsie ist klinisch anspruchsvoll, da Differenzialdiagnosen wie Synkopen, dissoziative Anfälle oder Migräneaura die klinische Einschätzung erschweren.
Basisdiagnostik
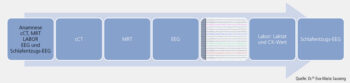
Die Basisdiagnostik stützt sich traditionell auf drei Säulen: die klinische Anamnese, das Elektroenzephalogramm (EEG) und die strukturelle Bildgebung mittels Magnetresonanztomografie (MRT) (Abb. 1).
Die Anamnese und Fremdanamnese sind entscheidend, da die klinische Beobachtung weiterhin der Goldstandard zur Diagnose von Anfallsereignissen bleibt. Dennoch zeigen Studien, dass bis zu 30 % der initial diagnostizierten Epilepsien Fehldiagnosen darstellen können.
Das EEG bleibt seit seiner Erstbeschreibung 1929 durch Hans Berger ein zentrales Instrument der Diagnostik. Mit einer Sensitivität von 30–50 % bei der Erstuntersuchung und bis zu 80–90 % nach wiederholten Ableitungen ist es jedoch kein alleiniger Beweis für Epilepsie. Zudem sind epileptiforme Muster nicht pathognomonisch und können auch bei Gesunden auftreten. Verbesserungen durch Langzeit-EEG und Video-EEG-Monitoring haben die diagnostische Genauigkeit deutlich erhöht, insbesondere bei unklaren Anfallsformen.
In der strukturellen Bildgebung hat die hochauflösende MRT (3 Tesla) die Computertomografie weitgehend ersetzt. Standardisierte Epilepsie-Protokolle, die dünnschichtige T1- und T2-Sequenzen sowie FLAIR-Sequenzen umfassen, erhöhen die Sensitivität zur Detektion von Läsionen wie Hippokampussklerosen, kortikale Dysplasien oder Tumoren. Dennoch bleibt bei etwa 20–30 % der Patient*innen die Bildgebung unauffällig, was die Herausforderung für die moderne Diagnostik verdeutlicht.
Die Basisdiagnostik bildet somit den Ausgangspunkt, reicht jedoch in vielen Fällen nicht aus, um eine definitive Diagnose und eine zielgerichtete Therapieentscheidung zu treffen. Hier setzt die moderne Diagnostik mit innovativen Verfahren wie Ultra-Hochfeld-MRT, quantitativer EEG-Analyse, funktioneller Bildgebung, genetischer Diagnostik, Biomarkeranalysen und KI-gestützter Mustererkennung an.
Moderne Bildgebung
In den letzten Jahren hat die Bildgebung entscheidende Fortschritte erfahren. Insbesondere die Ultra-Hochfeld-MRT mit 7 Tesla eröffnet neue Möglichkeiten in der Detektion subtiler kortikaler Dysplasien oder Hippokampusveränderungen, die bei 3 Tesla unauffällig bleiben. Eine prospektive Studie konnte zeigen, dass bei Patient*innen mit MRT-negativer Epilepsie die 7T-MRT bei über 30 % bislang nicht erkannte Läsionen sichtbar machen konnte.
PET und SPECT
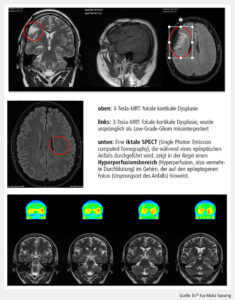
Neben der strukturellen Bildgebung gewinnen funktionelle Verfahren an Bedeutung. Die Positronenemissionstomografie (PET), vor allem mit 18F-FDG, erlaubt die Darstellung interiktaler Hypometabolismen, die mit epileptogenen Zonen korrelieren. In Kombination mit MRT (PET/MRT) lassen sich metabolische und strukturelle Informationen in einem einzigen Untersuchungsgang erfassen, was die diagnostische Sensitivität erhöht. Ein weiterer innovativer Ansatz ist die iktale Single Photon Emission Computed Tomography (SPECT) mit Subtraktion und MRT-Koregistrierung (SISCOM). Diese Methode ermöglicht die präzise Lokalisation der Anfallsursprungszone durch Darstellung von Perfusionsänderungen während eines Anfalls (Abb. 2). Studien zeigen, dass SISCOM die chirurgische Planung besonders bei komplexen und multilokulären Epilepsien unterstützt.
Funktionelle MRT (fMRT) und Diffusion Tensor Imaging (DTI) werden zusätzlich eingesetzt, um Sprach- und Motorareale darzustellen und wichtige Faserbahnen wie den Fasciculus arcuatus oder die Pyramidenbahn zu identifizieren. Dies ist vor allem im prächirurgischen Setting unverzichtbar, um postoperative Defizite zu vermeiden. Schließlich bietet die Kombination von multimodalen Verfahren (MRT, PET, EEG, fMRT) einen ganzheitlichen Zugang. Multimodale Diagnostik gilt zunehmend als Standard in spezialisierten Epilepsiezentren, da sie die prächirurgische Planung entscheidend verbessert.
qEEG und Video-EEG
Das EEG bleibt trotz moderner Bildgebungsverfahren eine zentrale Methode in der Epilepsiediagnostik. Es bietet direkten Zugang zur elektrischen Aktivität des Gehirns und ermöglicht die Identifikation epileptiformer Muster. Gleichwohl stößt die konventionelle EEG-Analyse an Grenzen: niedrige Sensitivität, hohe Abhängigkeit von der Expertise der Auswertenden und die oft schwierige Abgrenzung unspezifischer Veränderungen.
Quantitative EEG-Methoden (qEEG) ermöglichen die Umwandlung von Rohsignalen in statistische und bildhafte Darstellungen, etwa durch Frequenzanalysen, Spektraldichten oder Konnektivitätsmessungen. Studien zeigen, dass qEEG in Kombination mit konventionellem EEG die Sensitivität zur Erkennung epileptogener Herde steigern kann. Insbesondere bei MRT-negativen Patient*innen bietet qEEG zusätzliche Hinweise auf die epileptogene Zone, die für die chirurgische Planung nutzbar sind.
Die Kombination von EEG mit kontinuierlicher Videoaufzeichnung hat die Diagnostik entscheidend verbessert. Video-EEG erlaubt nicht nur die Erfassung seltener Anfälle, sondern auch die Zuordnung klinischer Symptome zu elektrischen Korrelaten. In einer prospektiven Studie führte Video-EEG bei 60 % der untersuchten Patient*innen mit unklarer Anfallsdiagnose zu einer Klärung der Diagnose.
Anfallserkennung und -prädiktion mittels KI
Die Anwendung von maschinellem Lernen im EEG hat in den letzten Jahren enorme Fortschritte gemacht. Klassische Machine-Learning-Algorithmen wie Support Vector Machines und Random Forests wurden zunächst zur Anfallserkennung eingesetzt. Neuere Deep-Learning-Ansätze, insbesondere Convolutional Neural Networks (CNN) und Transformer-Architekturen, zeigen jedoch deutlich höhere Genauigkeit.
Neben der reinen Anfallserkennung rückt zunehmend die Anfallsprädiktion in den Fokus. Erste prospektive Studien mit implantierbaren EEG-Sensoren konnten zeigen, dass eine Vorhersage epileptischer Anfälle mit einer Vorlaufzeit von mehreren Minuten möglich ist. Parallel dazu werden Wearables (z. B. EEG-Headsets oder multimodale Sensoren) untersucht, die eine nichtinvasive kontinuierliche Überwachung erlauben.
Genetik in der Epilepsiediagnostik
Die molekulargenetische Diagnostik hat die Epileptologie in den letzten zehn Jahren grundlegend verändert. Besonders in der Kinder- und Jugendneurologie konnten zahlreiche genetische Ursachen identifiziert werden. Mit der Einführung von Next-Generation Sequencing (NGS) stehen heute Genpanels, Exom- und zunehmend auch Ganzgenomsequenzierungen zur Verfügung.
Untersuchungen zeigen, dass bei früh beginnenden Epilepsien bis zu 30–40 % der Patient*innen eine genetische Ursache aufweisen. Besonders relevant sind Mutationen in Ionenkanal-Genen (z. B. SCN1A, KCNQ2, KCNT1), stoffwechselassoziierten Genen oder mTOR-Signalweg-Komponenten wie DEPDC5. Diese Diagnosen haben direkte therapeutische Konsequenzen. So sind beispielsweise Natriumkanalblocker bei SCN1A-assoziierter Dravet-Epilepsie kontraindiziert, während bei KCNQ2-Mutationen Retigabin in Einzelfällen wirksam ist.
Neben der Therapieoptimierung liefert die genetische Diagnostik wertvolle Informationen für die Prognoseabschätzung, genetische Beratung und prädiktive Testung in Familien. In Österreich werden genetische Abklärungen zunehmend in die Routinediagnostik integriert, insbesondere an neuropädiatrischen Zentren wie in Wien und Innsbruck.
Biomarker – neue Horizonte in der Epilepsiediagnostik
Neben Bildgebung und Genetik rücken molekulare Biomarker in den Fokus der modernen Epilepsiediagnostik. Ziel ist es, durch Blut- oder Liquoranalysen krankheitsspezifische Veränderungen zu erfassen.
Forschungsfokus Nfl und microRNA
Besonders intensiv erforscht werden microRNA, die in Tiermodellen und bei Patient*innen mit Temporallappenepilepsie spezifische Expressionsmuster zeigen. Auch Neurofilament light Chain (NfL) gilt als potenzieller Marker für neuronale Schädigung und Progression.
Eine laufende retrospektive Studie hat gezeigt, dass erhöhte Serumkonzentrationen von NfL bei Patient*innen mit Status epilepticus (SE) mit einer schlechteren klinischen Prognose korrelieren. Diese Entdeckung unterstützt das Potenzial von NfL als Biomarker für neuronale Schäden und den Verlauf von Anfällen.
Darüber hinaus wird in einer klinischen Studie untersucht, ob spezifische microRNA-Profile dazu beitragen können, verschiedene Epilepsieformen besser zu klassifizieren und das Ansprechen auf Therapien vorherzusagen. Diese Biomarker könnten in Zukunft eine wichtige Rolle in der Differenzialdiagnostik spielen.
Die Kombination von Biomarkern mit bildgebenden Verfahren könnte die Frühdiagnostik revolutionieren. Erste klinische Studien deuten darauf hin, dass Biomarker nicht nur das Vorliegen einer Epilepsie anzeigen, sondern auch helfen könnten, Anfallsrezidive oder Therapieansprechen vorherzusagen. So wird aktuell untersucht, wie blutbasierte Proteine epileptische von psychogenen nichtepileptischen Anfällen unterscheiden können, was die Diagnostik erheblich verbessern würde.
Prächirurgische Diagnostik
Invasive Verfahren und Innovationen
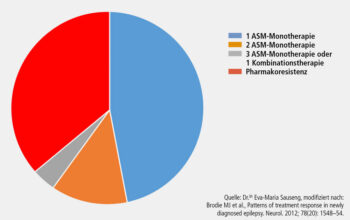
Bei Patient*innen mit pharmakoresistenter Epilepsie, die etwa ein Drittel aller Betroffenen ausmachen (Abb. 3), ist die epilepsiechirurgische Behandlung eine zentrale therapeutische Option. Voraussetzung für einen erfolgreichen chirurgischen Eingriff ist jedoch die präzise Lokalisation der epileptogenen Zone, insbesondere bei fokalen Anfällen, die keine offensichtlichen strukturellen Läsionen aufweisen. Die prächirurgische Diagnostik hat sich in den letzten Jahren zunehmend verfeinert, um eine möglichst exakte Planung der Resektion zu ermöglichen und gleichzeitig das Risiko für neurologische Defizite zu minimieren.
Die stereotaktische Elektroenzephalografie (SEEG) ist mittlerweile der Goldstandard in der invasiven Diagnostik und ermöglicht eine präzise dreidimensionale Erfassung der epileptischen Netzwerke durch das Setzen von Tiefenelektroden. Diese Technik ermöglicht es, auch subtile, nichtsichtbare epileptogene Herde zu identifizieren, die durch konventionelle bildgebende Verfahren wie MRT nicht erfasst werden können. Ein wesentlicher Vorteil der SEEG liegt in ihrer Fähigkeit, multiple Hirnregionen simultan zu überwachen und so die genaue Ausbreitung der epileptischen Aktivität zu kartieren. Dies ermöglicht eine exakte Planung der Resektion und hilft dabei, kritische funktionelle Areale wie Sprach- oder Bewegungszentren zu schonen.
Erweiterung durch Video-EEG-Monitoring
Ein weiteres unverzichtbares Verfahren in der prächirurgischen Diagnostik ist das Video-EEG-Monitoring, das in vielen spezialisierten Epilepsiezentren als ergänzendes Werkzeug zur Standard-EEG-Überwachung eingesetzt wird. Während das herkömmliche EEG die elektrische Aktivität des Gehirns misst, ermöglicht die Video-EEG-Überwachung die gleichzeitige Aufzeichnung der klinischen Symptome eines Anfalls in Verbindung mit den elektrophysiologischen Veränderungen. Dies bietet eine verbesserte Anfallscharakterisierung und eine genaue Zuordnung der elektrischen Aktivität zu den beobachteten klinischen Manifestationen, was die Diagnose von untypischen oder seltenen Anfallsformen erheblich erleichtert.
Ein entscheidender Vorteil des Video-EEG-Monitorings ist die Möglichkeit, seltene und unklare Anfälle zu erfassen, die in der täglichen Praxis möglicherweise nicht auftreten. Diese Anfälle können in einer Umgebung mit kontinuierlicher Videoüberwachung gezielt provoziert und dokumentiert werden, wodurch eine präzisere Lokalisierung der epileptischen Foci ermöglicht wird. Darüber hinaus wird es so auch möglich, klinikrelevante Ereignisse mit den elektroenzephalografischen Daten zu korrelieren, was besonders wichtig für die chirurgische Planung ist, um funktionelle Hirnareale zu vermeiden und zu erhalten.
Therapieansprechbarkeit mittels Video-EEG: Das Video-EEG-Monitoring hat sich auch als hilfreich erwiesen, um die Therapieansprechbarkeit zu überprüfen. Es erlaubt eine Langzeitüberwachung von Patient*innen, die in bestimmten Fällen eine Anpassung der Medikation oder andere therapeutische Maßnahmen erfordert. Studien haben gezeigt, dass das Video-EEG-Monitoring bei etwa 60 % der Patient*innen mit unklarer Anfallsdiagnose zur Klärung der Diagnose beiträgt und somit eine fundamentale Rolle bei der Identifizierung des epileptischen Ursprungsbereichs spielt.
Zusätzlich hat die Kombination von Video-EEG mit modernen KI-gestützten Anfallserkennungssystemen das Potenzial, die Diagnostik und präzise Lokalisierung von Anfällen weiter zu verbessern. Machine-Learning-Algorithmen, die auf Video-EEG-Daten trainiert wurden, sind in der Lage, Muster in den Anfallsmustern zu erkennen, die für den Menschen möglicherweise schwer zu identifizieren sind. Diese Technologien bieten nicht nur eine hohe Präzision, sondern ermöglichen auch eine automatisierte und effiziente Auswertung der umfangreichen Datenmengen, die während der Langzeitüberwachung anfallen.
Robotergestützte Implantation
Neben der SEEG haben robotergestützte Implantationssysteme die Präzision der Elektrodenplatzierung signifikant verbessert. Diese Systeme bieten eine höhere Genauigkeit und verringern das Risiko für Komplikationen, indem sie die notwendige Positionierung der Elektroden in einer minimalinvasiven Weise unterstützen. Auch bildgeführte Verfahren zur Planung der SEEG-Ableitungen haben sich bewährt, insbesondere durch die Integration von MRT- und PET-Daten, um die epileptogene Zone im Kontext des gesamten Gehirns zu lokalisieren.
Intraoperative funktionelle Kartierungen sind entscheidend, um funktionelle Hirnregionen wie Sprach- oder motorische Zentren zu identifizieren und zu erhalten. Diese Stimulationen ermöglichen es Chirurg*innen, während des Eingriffs präzise und interaktiv festzustellen, welche Bereiche des Gehirns für das grundlegende Funktionieren der Patient*innen erforderlich sind, um nach der Operation keine bleibenden Schäden zu hinterlassen.
Ein weiterer innovativer Ansatz sind Hybridverfahren wie die Laserablation unter MRT-Kontrolle oder Radiochirurgie, die als minimalinvasive Alternativen zur herkömmlichen Resektion zunehmend an Bedeutung gewinnen. Erste klinische Studien zeigen, dass diese Verfahren bei bestimmten Patientengruppen ebenso erfolgreich sein können, jedoch mit einer geringeren Morbidität und kürzeren Erholungszeiten. Diese Technologien ermöglichen es, fokale Läsionen schnell und präzise zu behandeln, was den Heilungsprozess erheblich verkürzt und gleichzeitig das Risiko für postoperative Komplikationen minimiert.
Zusammenfassung
Die Epilepsiediagnostik hat in den vergangenen Jahren einen tiefgreifenden Wandel durchlaufen: von der klassischen Beobachtung des klinischen Anfalls hin zu einer integrativen, multimodalen und zunehmend personalisierten Diagnostik. Moderne Verfahren wie hochauflösende Bildgebung, EEG-Analysen, genetische Untersuchungen, Biomarker und der Einsatz künstlicher Intelligenz wirken heute komplementär und ermöglichen eine neue Präzision. Dabei steht nicht mehr ausschließlich die Anfallsfreiheit im Zentrum, sondern ebenso der Schutz kognitiver Funktionen und die nachhaltige Sicherung der Lebensqualität. Die Vision einer „Epilepsie-360°“-Diagnostik – vernetzt, präzise und konsequent patientenzentriert – ist keine ferne Zukunft mehr, sondern zeichnet sich bereits konkret am Horizont ab.