Immunsuppression in der Rheumatologie
Unter den so genannten DMARDs (conventional synthetic disease-modifying antirheumatic drugs) stellt der Folsäureantagonist Methotrexat (MTX) den Goldstandard dar. Auch wenn die csDMARDs zu einer Verbesserung der Therapie von Patient:innen mit Rheuma beigetragen haben, gelang der wirkliche therapeutische Quantensprung erst in den 1990er-Jahren mit der Einführung der Biologika (biologic DMARDs, bDMARDs). Das sind biotechnologisch hergestellten Eiweißsubstanzen, die gegen bestimmte entzündungsfördernde Botenstoffe im Körper oder direkt gegen Immunzellen gerichtet sind. Botenstoffe, die Entzündungsvorgänge vermitteln und fördern, werden so neutralisiert. Viele dieser Substanzen werden auch in der Dermatologie, Gastroenterologie und anderen Spezialfächern eingesetzt – oftmals und optimalerweise im interdisziplinären Diskurs.
Nach der ersten in den 1990er-Jahren zugelassenen Gruppe der TNFα-Blocker wurden mittlerweile andere Wirkprinzipien wie IL-1-Blocker, IL-6-Blocker, Anti-B-Zell-Therapien, Anti-Blyss-Antikörper, T-Zellen-Costimulationblocker, IL-17-Blocker, IL-12/23-Blocker, IL-23-Blocker, Small Molecules (targeted systemic DMARDs = tsDMARDs), IL-5-Blocker und zuletzt ein Interferon-Antikörper-Präparat für diverse autoimmunologisch vermittelte rheumatische Erkrankungen entwickelt.
„Krankheitskontrolle ist ein realistisches Ziel in der Rheumatologie“
Vielzahl an Wirkmechanismen und Indikationen
Jedes Präparat hat Spezifika, was Wirkprinzip, Halbwertszeit, Applikationsmodus und -intervall, Indikation(en), Nebenwirkungsspektrum und Kontraindikationen anbelangt. Das Spektrum an Indikationen erweitert sich entsprechend neu hinzukommenden positiven Studienergebnissen und ist somit im Fluss; die therapeutische „Pipeline“ ist gut gefüllt. Die einzelnen Präparate sind mit ihrem Mode of Action (MOA) und Indikationen in der Tabelle wiedergegeben, wobei zu erwähnen ist, dass manche Substanzen kurz vor der Zulassung für neue Indikationen stehen bzw. in begründeten Fällen auch off-label eingesetzt werden (müssen).
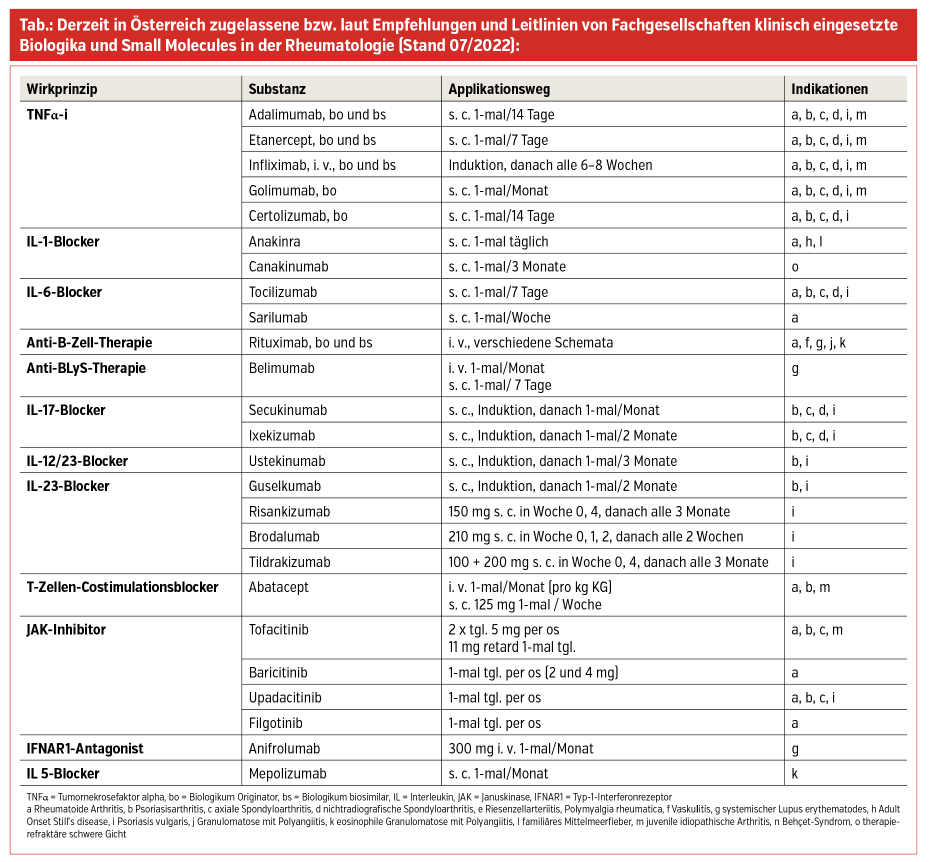
Für die ersten TNFα-Blocker sind – nach Ablauf des Patentschutzes – seit einigen Jahren auch Biosimilars (bsDMARDs = biotechnologisch hergestellte Substanzen mit demselben Mode of Action wie die Biologika-Originatorsubstanz [boDMARD)] am Markt. Diese Entwicklung hat durch den kompetitiven Effekt definitiv zur Ökonomisierung von TNFα-Therapien beigetragen.
Disease Management anhand definierter Algorithmen
Vor dem Therapiestart von bDMARDs und tsDMARDs sind eine genaue Anamnese zum Ausschluss von Kontraindikationen, die klinische Untersuchung und assoziierte Befunde (Labor, Bildgebung etc.) notwendig, deren Definition sich ebenso wie die Modalitäten der Therapieüberwachung an definierten Algorithmen rheumatologischer Fachgesellschaften orientiert, die barrierefrei aufrufbar sind:
- Rheumatoide Arthritis: EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease-modifying antirheumatic drugs: 2019 update (bmj.com) (Update 2022 am EULAR, Juni 2022 präsentiert, Publikation erwartet)
- Psoriasisarthritis: EULAR recommendations for the management of psoriatic arthritis with pharmacological therapies: 2019 update (bmj.com).
Die definitive Wahl des Präparates ist – unter Maßgabe der Indikationsstellung sowie der individuellen Situation der Patient:innen mit Komorbiditäten etc. und nach Abwägung aller Pros und Contras – von den betreuenden Ärzten und Ärztinnen zu treffen, der die individuellen Patient:innen am besten kennt. Biomarker stellen eine gewisse Hilfe für die Therapieentscheidung dar, auch wenn hier eine Weiterentwicklung wünschenswert wäre, um präziser und sozusagen zugeschnitten auf die individuellen Patient:innen wählen zu können, im Sinne einer möglichst personalisierten Therapie. - Ankylosierende Spondylitis (aktuelles Update am EULAR, Juni 2022 präsentiert, Publikation erwartet)
Sichere Anwendung
Die Einhaltung der vorgesehenen klinischen und laborchemischen Kontrollen unter laufender Therapie gewährleistet die Sicherheit in der Anwendung. Der häufigste Grund für eine Therapiepause ist das Auftreten von Infekten, um die körpereigene Infektabwehr nicht zu behindern. Bei geplanten operativen Eingriffen muss die Biologikatherapie – je nach Medikament – nicht automatisch pausiert werden. Gemäß internationalen Empfehlungen kann für die OP ein Zeitpunkt gegen Ende des Dosierungsintervalls gewählt werden, dies ist derzeit das gängige Vorgehen bei Routineeingriffen.
Shared decision making
In die Therapieentscheidung sollten die Betroffenen im Sinne eines informierten „shared decision making“ einbezogen werden. Für die strukturierte Patient:inneninformation und -aufklärung hat die ÖGR in einem eigenen Arbeitskreis zu allen verfügbaren Medikamenten – nach Literaturrecherche und unter Einbeziehung der verfügbaren Evidenz – Patient:innenaufklärungsbögen erstellt und führt – je nach Stand und Entwicklung der wissenschaftlichen Erkenntnisse – nötige Updates durch. Alle Bögen sind auf der Website der ÖGR frei herunterladbar.
Wissenswertes für die Praxis
- Biologika und Small Molecules sind langfristig einsetzbare immunsuppressive Medikamente und kommen bei Autoimmunerkrankungen in verschiedenen Indikationen (Rheumatologie, Dermatologie, Gastroenterologie etc.) zur Anwendung.
- Bei Anwendung von Biologika und Small Molecules sind regelmäßige klinische und laborchemische Kontrollen erforderlich.
- Biologika und tsDMARDs sind bei Infekten zu pausieren und werden erst nach Restitution wieder begonnen.























































































