Therapie der Depression – heute und morgen
Depressionen sind nicht nur überaus häufig, sondern auch mit einer enormen individuellen und gesellschaftlichen Krankheitslast verbunden. Die Ärzte Kronesprach mit o. Univ.-Prof. Dr. h. c. mult. Dr. Siegfried Kasper, Vorstand der Universitätsklinik für Psychiatrie und Psychotherapie, Medizinische Universität Wien, über aktuelle Fragen der Depressionsbehandlung und zukünftige Entwicklungen.
Siegfried Kasper: Rund 60 % der Patienten sprechen auf eine Behandlung mit Antidepressiva gut an. Prinzipiell gilt es zu unterscheiden: Zeigt ein Patient bei dem ersten Behandlungsversuch keinen ausreichenden Respons, spricht man von unzureichendem Ansprechen. Die Therapieresistenz wird als insuffizientes Ansprechen auf zwei Therapien, die therapierefraktäre Depression als ein ungenügendes Ansprechen auf zumindest drei Therapieoptionen, eventuell auch inklusive Elektrokonvulsionstherapie, definiert. Reicht eine Depression über mehr als zwei Jahre, spricht man von einer chronischen Depression. Diese Unterscheidungen sind wichtig, ähnlich wie eine Stadieneinteilung in der Onkologie.
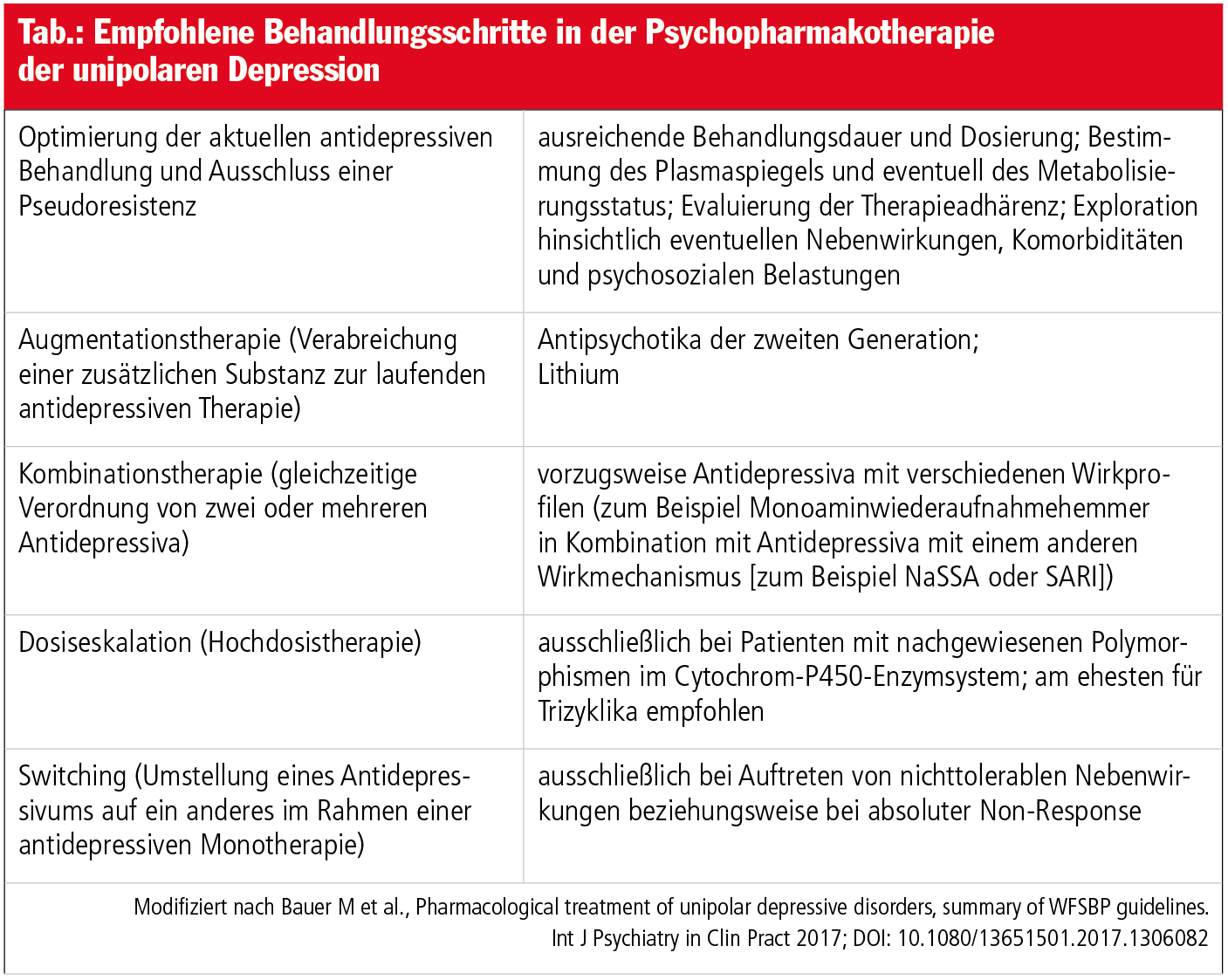
Die Evaluierung der Wirksamkeit der initialen antidepressiven Behandlung sollte zwei bis vier Wochen nach Erreichen der Zieldosis erfolgen. Bei insuffizientem Ansprechen sollte zunächst eine sogenannte Pseudoresistenz ausgeschlossen werden, die häufig durch eine unzureichende Behandlungsdauer und/oder eine unzureichende Dosierung des verordneten Antidepressivums hervorgerufen wird. Eine Pseudoresistenz kann zudem durch zu niedrige Plasmaspiegel oder Nichtadhärenz verursacht werden. Durch Medikamentenspiegelbestimmungen im Blutserum – „therapeutic drug monitoring“ – können mögliche Metabolisierungsstörungen aufgrund von Enzymdefekten, vor allem im Cytochrom-P450-System der Leber, entdeckt werden. Rund 5–10 % der depressiven Patienten, die an unserer Klinik behandelt werden, sind Ultra Rapid Metabolizer, die aufgrund eines genetischen Polymorphismus höhere Dosierungen eines Medikaments für eine adäquate Therapie benötigen.
Nach Ausschluss einer Pseudoresistenz wird als evidenzbasierte First-Line-Strategie bei unzureichendem Ansprechen auf eine antidepressive Monotherapie eine Augmentationstherapie mit Antipsychotika der zweiten Generation – zum Beispiel Quetiapin, Olanzapin, Aripiprazol – oder mit Lithium empfohlen. Auch wenn in Metaanalysen die Effektstärke für Antipsychotika- und Lithiumaugmentation vergleichbar war, ist zu bedenken, dass mehr Augmentationsstudien mit Antipsychotika durchgeführt und in diesen vorwiegend neuere Antidepressiva – vor allem SSRI und SNRI – eingesetzt wurden. Lithium wurde hingegen meist in Kombination mit Trizyklika untersucht. Wenn Antipsychotika bei therapieresistenter Depression verschrieben werden, sind in der Regel niedrigere Dosierungen als in der Schizophreniebehandlung notwendig, zum Beispiel Aripiprazol 2,5–10 mg/d, Quetiapin XR 50–300 mg/d, Olanzapin 5–10 mg/d. Antipsychotika sind vor allem auch für die Behandlung einer Depression mit zusätzlicher psychotischer Symptomatik geeignet.
Neben diesen Augmentationsstrategien wird häufig eine Kombinationstherapie mit zwei verschiedenen Antidepressiva durchgeführt. Diese Maßnahme kann nur dann als evidenzbasiert angesehen werden, wenn zwei Antidepressiva mit einem unterschiedlichen Wirkmechanismus kombiniert werden. Sinnvoll ist beispielsweise eine Kombination von SSRI oder SNRI mit präsynaptischen Autorezeptorinhibitoren wie zum Beispiel dem NaSSA Mirtazapin oder dem SARI Trazodon, da sich synergistische Effekte erwarten lassen.
Häufig wird im klinischen Alltag auch eine Dosiseskalation oder ein Wechsel eines Antidepressivums auf ein anderes durchgeführt. Bei der Effektivität der Dosiseskalation spielt jedoch die Substanzklasse eine Rolle. Während für Monoaminwiederaufnahmehemmer eine Dosiserhöhung keine Wirksamkeit zeigte, gibt es positive Befunde für Trizyklika und MAO-Hemmer. Ein Wechsel des Antidepressivums sollte ausschließlich bei Auftreten von nicht-tolerablen Nebenwirkungen oder bei einer absoluten Nonresponse in Betracht gezogen werden (Tab.).
Besonders wichtig ist mir auch, dass eine Kombination der antidepressiven Medikation mit Psychotherapie zu jedem Zeitpunkt erwogen werden kann. Dabei ist zu berücksichtigen, in welchem psychophysischen Zustand sich der Patient befindet. Viktor Frankl formulierte es so: Die Person des Menschen schlummert „hinter der Mauer der Erkrankung“. Das heißt, man muss schauen, wie dick und hoch diese Mauer ist, um sie möglichst zu beseitigen, und dann Psychotherapie einsetzen, falls diese indiziert ist.
Wichtig ist, den Patienten die Erkrankung zu erklären, was in leichten bis mittleren Krankheitsstadien meist möglich ist. Bei schweren Depressionen mit psychotischer oder wahnhafter Ausprägung ist besonders darauf zu achten, die Patienten nicht durch die Gesprächsführung zu überfordern, denn man kann – bildlich gesprochen – über diese Mauer nicht hinwegsteigen.
Darüber hinaus gibt es noch weitere Behandlungsmethoden wie die Elektrokonvulsionstherapie, die transkranielle Magnetstimulation, die Vagusnervstimulation, den therapeutischen Schlafentzug oder die Lichttherapie, die bei Depression eingesetzt werden können.
Siegfried Kasper: Die Wirklatenz der Antidepressiva liegt bei 10 bis 14 Tagen. Das ist eine für die Patienten schwierige Zeit, vor allem in Hinblick auf die Suizidalität. Es gibt einige Medikamente, die Teile der depressiven Symptomatik rascher verbessern. So haben zum Beispiel Mirtazapin und Trazodon eine schlafinduzierende Wirkung. Auch die Angst ist bei beiden schon am Anfang gebessert. Mit Ketamin gibt es jetzt eine neue Therapieoption, die nicht mehr auf das monoaminerge, sondern auf das glutamaterge System wirkt. Die antidepressive und anti-suizidale Wirkung von Ketamin tritt sehr rasch (nach ungefähr 10–20 Minuten) ein, das kann man während der intravenösen oder intranasalen Behandlung, die wir an der Klinik auch durchführen, beobachten.
Interessanterweise kann auch durch eine Add-on-Therapie mit atypischen Antipsychotika eine rasche antidepressive Wirkung erreicht werden, die meist innerhalb von drei Tagen eintritt.
Ebenso zeigt die Schlafentzugstherapie in circa 60 % der Fälle eine rasche Verbesserung der depressiven Symptomatik. Diese Methode ist nichtinvasiv, kostengünstig und wird meist gut toleriert. Die meisten Patienten erleben ein Rezidiv nach einer Nacht, der antidepressive Effekt kann jedoch durch erneutes Durchführen repliziert werden. Eine Lichttherapie scheint den Effekt der partiellen Schlafentzugstherapie zu stabilisieren.
Siegfried Kasper: Ketamin ist eine faszinierende neue Entwicklung. In den letzten Jahren hat sich die Ketamintherapie als Off-Label-Behandlung bei antidepressiver Therapieresistenz etabliert, mit Ansprechraten von bis zu 70 % und antisuizidaler Wirkung.
Ketamin wurde bereits vor über 50 Jahren entwickelt und als Anästhetikum eingesetzt. Beginnend in den 1990er-Jahren wurden antidepressive Effekte zunächst im Tierversuch, seit einigen Jahren auch klinisch untersucht. Dabei wurde beobachtet, dass der antidepressive Wirkeintritt relativ rasch erfolgt. Ketamin greift in das glutamaterge System ein. Glutamat, das bei depressiven Patienten erhöht im Gehirnstoffwechsel vorliegt, wird reduziert. In der Depressionsbehandlung liegt die Ketamindosis bei etwa einem Zehntel der Dosierung in der Anästhesie, circa 25–50 mg je nach Körpergewicht. Die antidepressive Wirkung tritt bereits nach 10–20 Minuten ein, hält allerdings nur wenige Tage an. Bei wiederholter Gabe, zweimal pro Woche, ist ein anhaltenderer Effekt zu beobachten.
Das Abhängigkeitspotenzial muss noch genauer untersucht werden. Ketamin wird sicher nicht frei verschreibbar erhältlich sein. Wenn es dann am Markt ist, werden sich wahrscheinlich die Patienten in sogenannten „Ketaminambulanzen“ zweimal pro Woche einen Ketaminhub holen, da sonst dem Missbrauch zu viel Raum gegeben wäre. Bei längerfristiger Anwendung besteht auch ein Zystitisrisiko. Ansonsten sind mir keine längerfristigen Nebenwirkungen bekannt.
Siegfried Kasper: Die publizierten Studien dauerten maximal 14 Tage bis vier Wochen. Eine weltweite Langzeitstudie, an der die Wiener Klinik teilnimmt, wird derzeit durchgeführt. Wir sind gerade dabei, die Patienten, die wir akut behandelt haben, auch in eine Langzeittherapie zu überführen. Die Ergebnisse werden hoffentlich in ein, zwei Jahren vorliegen.
Siegfried Kasper: Ketamin wurde bislang immer als Add-on-Therapie angewandt. Es wäre natürlich interessant, zu untersuchen, ob es auch als Monotherapie wirken würde. Ketamin scheint nicht auf den Serotonintransporter zu wirken, wie wir in Tests mit gesunden Kontrollen festgestellt haben. Eine Studie mit Ketamin als Monotherapie – eventuell könnte man den Effekt durch eine begleitende spezifische Therapie mit Lithium, Lamotrigin oder anderen Moodstabilizern aufrechterhalten – wäre eine große Sache. Aber wir sind schon sehr froh, dass wir ein Medikament haben, das den Patienten rasch aus der akuten Phase heraushilft.
Siegfried Kasper: Im ambulanten Setting wird es in Zukunft wahrscheinlich so sein, dass es sogenannte Ketaminambulatorien geben wird. Das sollte man sich ähnlich vorstellen wie ein physikalisches Institut, wo man seine Rückenbeschwerden behandeln lässt. In Amerika gibt es beispielsweise den Begriff „brain health“, der mir sehr gut gefällt und den Krankheiten das Stigma nimmt. Analog zu physikalischen Instituten könnte man in solchen „brain health centers“ eine Ketaminbehandlung anbieten, aber eventuell auch transkranielle Magnetstimulation oder weitere apparative Untersuchungen wie zum Beispiel EEG. Hier haben wir noch Nachholbedarf im Setting. Es sollte keineswegs so sein wie bei Drogenkranken, die man vor Apotheken warten sieht, wenn sie das Methadon abholen, das wirkt diskriminierend. Psychische Erkrankungen wie Depressionen sollten Erkrankungen sein wie andere auch, man sollte sie entstigmatisieren und entmythologisieren.
Siegfried Kasper: Eine intranasale Anwendung wäre meiner Ansicht nach die bessere Möglichkeit, die wir bereits im Rahmen einer weltweiten Studie untersuchen.
Siegfried Kasper: Ketamin wird die Eingangssubstanz für andere glutamaterge Substanzen sein; so wie vor circa 40 Jahren, als es noch keine SSRI gab und als einer der ersten Serotoninwiederaufnahmehemmer, Zimelidin auf den Markt kam. Danach wurden weitere Substanzen entwickelt. Es sind verschiedene glutamaterge Substanzen in der Pipeline, die aber zurzeit noch tierexperimentell geprüft werden.
Siegfried Kasper: Statt personalisierte Therapie ziehe ich den Begriff Präzisionsmedizin vor. Bei „precision medicine“, „precision therapy“ präzisiert man, auf welche Therapie der Patient anspricht. Wir versuchen jetzt schon, die Patienten im Sinne einer Präzisionsmedizin zu behandeln, aber für eine genaue Präzisionsmedizin brauchen wir noch weitere Biomarker, insbesondere auch genetische Marker. Das Kombinieren von verschiedenen klinischen und neurobiologischen Faktoren, zum Beispiel genetischer Befunde, stellt einen vielversprechenden Ansatz dar. Es konnte außerdem gezeigt werden, dass verschiedene genetische Befunde die Neigung zu Nebenwirkungen beeinflussen.
Die Wiener Klinik ist Teil eines europäischen Forschungsprogramms zur therapieresistenten Depression, die auch Thema des CINP-Kongresses Ende Juli in Prag ist. Im Rahmen dieses europäischen Forschungsprogramms wird neben der klinischen Symptomatik auch die Genetik von rund 2.700 Patienten untersucht. Die genetischen Analysen dauern noch an. Wahrscheinlich wird es bei der Depression – ähnlich wie in der Onkologie – auch so sein, dass man aus der Zusammenschau von klinischen Symptomen – zum Beispiel Schlafstörungen, Antriebsstörung in den Morgenstunden oder melancholische Zeichen – und genetischen Befunden beurteilen wird, welcher Patient auf welche Therapie ansprechen wird. Wie auch in der Onkologie zwischen den verschiedenen Karzinomen unterschieden wird, ist auch die Depression ein Überbegriff, der unterteilt werden muss.
Neben den genetischen Biomarkern wird wahrscheinlich das Neuroimaging eine wichtige Rolle spielen, wie zum Beispiel die Untersuchung der Informationsverarbeitungsgeschwindigkeit anhand von Bildgebungsdaten. Solche Neuroimaging-Befunde sind sicherlich aussagekräftiger als periphere biochemische Marker, die meist mit dem Gehirn nicht sehr viel zu tun haben, es gibt ja auch die Blut-Hirn-Schranke. Man sollte bei dem Organ bleiben, bei dem man die Depression vermutet. Wir konnten zum Beispiel mittels PET (Positronenemissionstomografie) zeigen, dass bei depressiven Patienten die Serotonintransporterexpression vermindert, und die Gabe von SSRI somit eine logische Therapie ist.
In Österreich sind wir das einzige Zentrum, das diese Untersuchungen, die sehr kostspielig sind, machen kann; in ganz Europa gibt es drei oder vier Zentren.