Neues aus der Welt der CAR-T-Zellen
Dominiert wurde der erste Tag des ASH-Meetings 2023 von Daten, die sich weniger um die CAR-T-Zelltherapie per se als vielmehr um die Prädiktion von Ansprechen nach CAR-T-Zelltherapie und das Tumor Microenvironment (TME) drehten. Hier ging es bei den zwei Hauptentitäten rezidiviertes/refraktäres multiples Myelom (RRMM) und großzelliges B-Zell-Lymphom (LBCL) um Möglichkeiten, prädiktive Marker des Ansprechens zu definieren.
Ansprechtiefe und Prognose beim multiplen Myelom
Im Abstract #94 wurde der Faktor der MRD-Negativität im Kontext des rezidivierten/refraktären und des neu diagnostizierten multiplen Myeloms (RRMM, NDMM) und dessen Einfluss auf das Überleben im CART-Setting aber auch im Setting der Therapie mit bispezifischen Antikörpern (TCE, „T Cell Engager“, BiTE-Antikörper) – und hier vorzugsweise BCMA- sowie GPRC5D-gerichteten BiTEs – beleuchtet. Im Gegensatz zum neu diagnostizierten Multiplem Myelom spielt das Erreichen der Komplettremission (CR) im MRD-negativen RRMM wohl eine Rolle in Bezug auf die dauerhafte Ansprechrate nach CAR-T-Zelltherapie und Therapie mit bispezifischen Antikörpern. (vgl. Abb. 1)
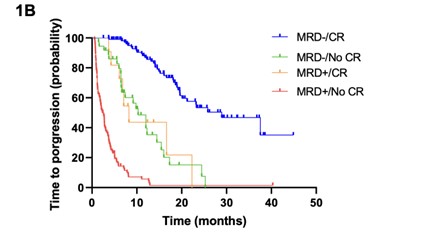
Abb. 1: Im fortgeschrittenen rezidivierten/refraktären Setting des multiplen Myeloms dürfte das Erreichen einer Komplettremission bei MRD-negativen Patient:innen für die Prognose wichtig sein.
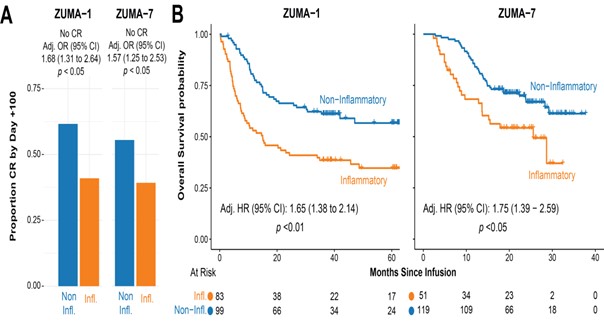
Inflammation als Biomarker-Signatur für das Ansprechen auf CAR-T-Zellen
Im Kontext der Evaluation des Tumor-Microenvironments (TME) war das Abstract #224 aus dem MD Andersen Cancer Center überaus interessant. Hier wurde anhand einer neuen Methode der Erfassung von Inflammation als Biomarker (Inflamix) dessen Einfluss auf die in vivo Kinetik des CAR-T-Zellprodukts und dessen Einfluss auf die Ansprechrate diskutiert. Es konnte gezeigt werden, dass die Resolution einer Inflammation („inflammatorisches Cluster“) zum Zeitpunkt der Apherese bis zur CAR-T-Zell-Infusion, das Ansprechen der CAR-T-Zelltherapie nachhaltig positiv beeinflusst – erklärt durch die immunsuppressive Wirkung der Entzündung auf das Tumor-Microenvironment. (vgl. Abb. 2)
Zirkulierende Tumor-DNA als Surrogatmarker für Tumorlast und Ansprechen auf CAR-T-Zellen
Einen weitere Aspekt, der sich mit der Prädiktion des Ansprechens, hier aber im Setting der Zweitlinientherapie des großzelligen B-Zell-Lymphoms (LBCL) auseinandersetzte, war die Präsentation von L. Stepan im Abstract #225, der die Daten der TRANSFORM-Studie (Lisocabtagen maraleucel, Breyanzi®) in Bezug auf die ctDNA (zirkulierende Tumor-DNA) als Surrogatmarker für Tumor Burden und Ansprechen diskutierte. Er konnte darauf verweisen, dass eine rapide Reduktion bereits am Tag 15 nach CAR-T Therapie und eine anhaltende Negativität für diese ctDNA am Tag 30 post CAR T mit anhaltendem Ansprechen korreliert. Die Auswertung des entsprechenden SOC-Arms der 2L dieser Studie (HDCTx und ASCT) ist noch am Laufen und wird wohl nachgereicht werden.
Zur Frage der Sequenztherapie: Bispezifische Antikörper und CAR-T-Zellen
Abschließend, da doch eine gewisse Signalwirkung beinhaltend, aber vielleicht noch nicht ganz ausgereift (der kurzen Follow-up-Zeit geschuldet), sind die Daten, die im Abstract #228 abgehandelt und von G. Jacoboni präsentiert wurden. Hier haben sich 15 Zentren aus Frankreich und Spanien zusammengeschlossen und in einer retrospektiven Studienauswertung die Aussage beleuchtet, ob eine vor CAR-T-Zelltherapie durchgeführte TCE-Therapie („T-cell engager“ bzw. bispezifische Antikörpertherapie wie CD20/CD3 oder CD22/CD3) das Outcome mit CAR-T-Zellen negativ beinflusst. Sie kamen zum Schluss, dass dies nicht der Fall sei. Wobei schon die Aussage ablesbar war, dass sich ein größerer zeitlicher Abstand vom Letzteinsatz des bispezifischen Antikörpers zur CAR-T-Infusion (mehr als 50 Tage) positiv auf das Ansprechen auf die nachfolgende CAR-T-Zelltherapie auswirkt: So ergab eine wash out time > 50 d eine 6-Monate-OS-Rate von 86% vs. 62%, wenn diese kürzer war (p-0,13).