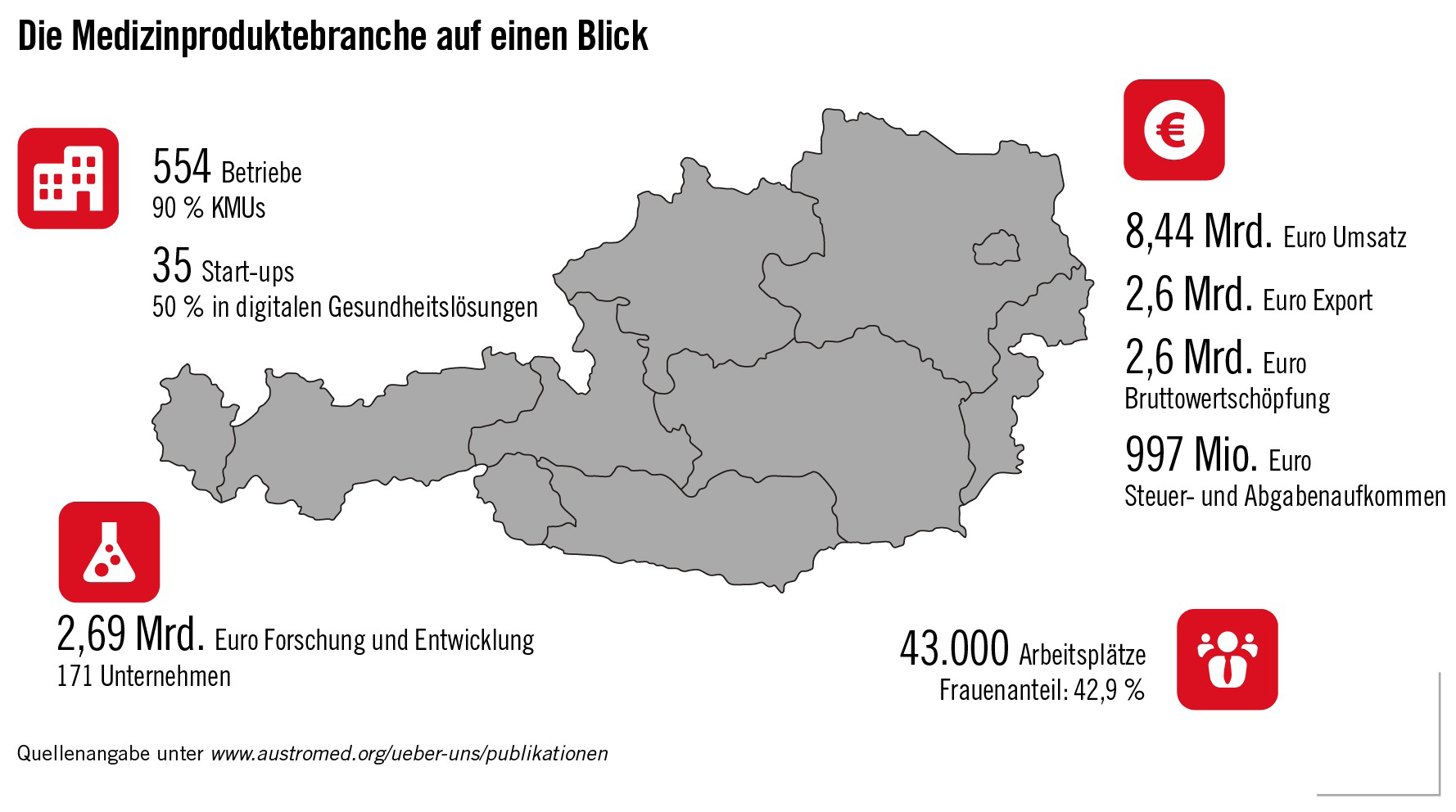
Medizinprodukte: Unverzichtbar für das Leben!
Medizinprodukte werden in der Diagnose und Therapie eingesetzt. Dabei handelt es sich zum Beispiel um Geräte in der Chirurgie oder Intensivmedizin wie etwa zur Beatmung oder zur Überwachung von lebensnotwendigen Körperfunktionen. Auch Implantate – von der Hüfte bis zum Zahn – sind Medizinprodukte. Außerdem zählen Produkte wie Desinfektionsmittel, Verbände oder OP-Material, aber auch Laborprodukte zu dieser wichtigen Gesundheitsbranche.
Verantwortung für Patienten
Wichtig ist die Abgrenzung der Medizinprodukte zu Medikamenten, denn sie unterscheiden sich im Hinblick auf die rechtlichen Regelungen, die einzuhalten sind, damit die Medizinprodukte am Patienten angewendet werden dürfen. In Österreich finden sich diese Vorschriften hauptsächlich im Medizinproduktegesetz. Hier ist unter anderem festgeschrieben, wie ein Produkt funktionieren muss, was es leisten muss und wie es angewendet werden darf, um sicher und wirksam bei der Behandlung eines Patienten eingesetzt zu werden. Themen wie die Instandhaltung, Desinfektion, aber auch das Risiko- und Qualitätsmanagement sind hier abgebildet. Unternehmen waren und sind gefordert, Höchstleistungen zu erbringen, um diese strengen Regeln zu erfüllen. Das ist auch gut so, denn es geht um die Gesundheit und das Leben der ihnen – über Ärzte, Ordination, Ambulanzen oder Spitäler – anvertrauten Patienten! Gleichzeitig eröffnet sich damit auch schon die erste große Herausforderung: die Vielfalt der unterschiedlichen Produkte und Anforderungen in diesem einen Rechtsrahmen unterzubringen.
Blick über die Grenzen
Der Markt der Medizinprodukte endet nicht an den Landesgrenzen. Auf EU-Ebene gibt es ebenfalls rechtliche Regeln, die in den Mitgliedstaaten gültig sind und vorschreiben, wie die lebenswichtigen Produkte im heimischen Gesundheitswesen „arbeiten“ dürfen. Dieser europäische Rechtsrahmen für Medizinprodukte ist als neue EU-Medizinprodukte-Verordnung (Medical Device Regulation, MDR) und die ebenfalls neue IVD-Verordnung (In-vitro-Diagnostika, IVDR) im EU-Amtsblatt bekannt gemacht worden. Am 25. Mai 2017 sind beide Verordnungen in Kraft getreten, jedoch gelten Übergangsfristen: für die MDR drei Jahre, also der 25. Mai 2020, und für die IVDR fünf Jahre, damit der 25. Mai 2022. Auch wenn es auf den ersten Blick noch eine Zeit lang hin ist, bis es wirklich ernst wird, und die Unternehmen auch bisher schon auf Qualität und Sicherheit höchsten Wert gelegt haben, so werden die Regeln jetzt noch strenger und die Vorbereitungen laufen bereits auf Hochtouren. „Wir begrüßen diese einheitlichen Regelungen mit noch mehr Ausrichtung auf die Patientensicherheit, doch eine Überregulierung bringt das Gesundheitswesen nicht weiter“, sagt Mag. Philipp Lindinger, Geschäftsführer der AUSTROMED, der Interessensvertretung der Medizinprodukte-Unternehmen. Die strengeren Regelungen bringen nicht nur ein Plus an Sicherheit und Qualität in die Gesundheitsversorgung, sondern auch mehr Bürokratie in der gesamten Abwicklung. Daher ist rasches und kompetentes Handeln gefragt, wenn der Wirtschaftsstandort und die hochwertige Patientenversorgung nicht gefährdet werden sollen.
Strenge Regeln für mehr Patientensicherheit
Waren über viele Jahre die vorhandenen Rechtsvorschriften durchaus sicher und effektiv, so gab es doch einen Anlass, der sehr rasch dazu führte, das dem bisherigen System die „Daumenschrauben“ angesetzt wurden. Der Wunsch, die Branche noch sicherer für Patienten zu machen, war aufgrund des sogenannten „PIP-Skandals“ durchaus legitim. Es ging dabei um schadhafte Brustimplantate der französischen Firma Poly Implant Prothèse (PIP).
Die Zulassung für Medizinprodukte wurde kräftig verschärft und die jetzt vorliegenden Verordnungen – MDR und IVDR – schießen weit über das Ziel hinaus. Die Vorschriften sind so umfassend und streng, dass Zulassungsstellen ihre Arbeit eingestellt haben, mehr Produkte jedoch den Zulassungsprozess durchlaufen müssen und die Umsetzung der Vorschriften in den Firmen dazu führen könnte, dass neue Produkte gar nicht mehr auf den Markt kommen. Die – wie im Falle von PIP – dahintersteckende kriminelle Energie wird auch mit einer EU-Verordnung nicht zu verhindern sein.
Attraktive Arbeitsplätze bieten
Viel Arbeit wartet jetzt auf die Zulassungsstellen. Österreich ist davon in besonderer Weise betroffen, denn hier haben die beiden nationalen Benannten Stellen, die Europaprüfstelle für Medizinprodukte der Technischen Universität Graz (PMG) und der TÜV Austria ihre Tätigkeit bereits im Jahr 2017 niedergelegt. Das Stuttgarter Unternehmen medical device certification GmbH (mdc) hat eine österreichische Niederlassung gegründet und viele der TÜV-Kunden übernommen. Aktuell erfreulich ist, dass das im Dezember 2018 neu gegründete Unternehmen QMD Services am 17. Juni 2019 den Antrag auf Benennung als Konformitätsbewertungsstelle nach der MDR bei der österreichischen Behörde eingebracht hat. Eine Einreichung nach IVDR ist in Vorbereitung. Ein erster Schritt ist damit gemacht, jetzt folgt allerdings ein langwieriger Zulassungsprozess unter Mitwirkung der EU-Kommission. Die Anforderungen an das qualifizierte Personal sind enorm gestiegen, sodass es sich ein privatwirtschaftlich geführtes Unternehmen offensichtlich kaum leisten kann, kostendeckend zu arbeiten. „Eine gute Ausbildung ist nur die halbe Miete, es braucht erfahrene Experten für diese Prüfstellen“, beschreibt AUSTROMED-Präsident Gerald Gschlössl den Engpass. Er bringt damit die missliche Lage für Hersteller, Anwender und letztendlich Patienten auf den Punkt: „Nach aktuellen Einschätzungen werden innovative Produkte um fünf bis zehn Jahre verspätet oder gar nicht für Patienten verfügbar werden, andere nutzbringende vom Markt verschwinden, da sich der Mehraufwand nicht mehr rechnet. Damit wird zunehmend mit eigentlich schon veralteten Produkten behandelt werden müssen, was dem Grundgedanken der rechtlichen Regelung massiv widerspricht.“
Natürlich werfen viele Arbeitgeber – Betriebe, Kliniken oder Forschungseinrichtungen – jetzt ihre Angelruten im gleichen Teich aus, wenn sie auf Personalsuche gehen – aus Sicht der AUSTROMED aber kein unlösbares Problem: „Es wäre jetzt an der Zeit, mit einer breiten Kampagne dafür zu werben, dass wir im Land attraktive Arbeitsplätze bieten können. Was mit Lehrlingen gut geklappt hat, wird doch auch mit Akademikern möglich sein. Ich sehe die Situation jetzt als große Chance, kluge Köpfe im Land zu halten, den Standort zu stärken und damit den Boden für eine neue Benannte Stelle aufzubereiten“, sagt Lindinger.
Schulterschluss der Branche
Damit der Standort Österreich nach wie vor seine Attraktivität behält, bemüht sich die AUSTROMED intensiv um einen Schulterschluss der wichtigsten Stakeholder der Branche: „Mit der ‚Plattform Medizinprodukte‘ bilden wir gemeinsam den Gesamtprozess eines Medizinproduktes von der Entwicklung über die lebendige Start-up-Szene bis hin zur Erstattung und Markteinführung im Hinblick auf die Anforderungen der neuen EU-Verordnungen transparent ab“, freut sich Lindinger über diesen wichtigen Schritt. Die Partner der Plattform sind Angehörige von universitären und außeruniversitären Forschungseinrichtungen sowie Gesundheitscluster und Interessensvertretungen, die gemeinsam das Ziel verfolgen, die Medizintechnikbranche in Österreich bei der Umsetzung der neuen EU-Verordnungen über Medizinprodukte und In-vitro-Diagnostika zu unterstützen. Die Kerngruppe umfasst neben der AUSTROMED die Life Sciences- und MedTech-Cluster der Bundesländer, die Österreichische Gesellschaft für Biomedizinische Technik (ÖGBMT), das Austrian Institute of Technology (AIT) und das Bundesgremium für Foto-, Optik- und Medizin-produktehandel der Wirtschaftskammer Österreich. Je nach Themen und Aufgabenstellungen ist eine Erweiterung dieser Gruppe vorgesehen. Der gemeinsame Vorstoß der Plattform ist ein wichtiges Zeichen, um die drohenden Konsequenzen der EU-Gesetzgebung rasch in den Griff zu bekommen.
Unterstützung kommt auch vonseiten der Wirtschaftsreferenten der Bundesländer, die sich bereits mehrmals mit der dringenden Bitte an die Bundesregierung gewandt haben, rasch alle erforderlichen Maßnahmen für die Wiedereinrichtung einer österreichischen Benannten Stelle – sie ist für die Zulassung von Medizinprodukten verantwortlich – zu ergreifen. Sie fordern, bei der Umsetzung der neuen EU-Verordnungen die Bedürfnisse der Industrie und der akademischen Forschung zu berücksichtigen, um die positive Weiterentwicklung des Life-Sciences-Standorts Österreich zu gewährleisten. „Bestmögliche Patientenversorgung ist nur im Zusammenspiel von wirksamer Qualitätssicherung, solider wirtschaftlicher Basis und lebendiger Forschungs- und Innovationskultur denkbar“, bekräftigt Lindinger das gemeinsame Ziel.
Damit auch in Zukunft dem Gesundheitswesen ausreichend innovative Medizinprodukte zur Verfügung stehen, haben sich die heimischen Unternehmen – den knappen Übergangsfristen und zahlreichen Stolpersteinen zum Trotz – gut auf die neuen Regelungen vorbereitet. Gefordert ist jetzt die Politik, denn im Gesetzgebungsprozess fehlt es noch an einer Reihe von Rechtsakten zur Implementierung und Durchführung. Parallel liegt der klare Auftrag auf dem Tisch, zumindest eine echte Zulassungsstelle – also nicht nur eine Zweigbüro einer ausländischen Stelle – in Österreich zu schaffen, um die damit verbundene Wertschöpfung nicht zu verschenken!