Medizinprodukte und In-vitro-Diagnostika für die Zukunft sichern
Die Europäische Kommission wollte es nun genau wissen und hat im Rahmen des EU4-Health-Programms zur Unterstützung der Überwachung der Verfügbarkeit von Medizinprodukten auf dem EU-Markt eine Studie ausgeschrieben. Mit der Projektleitung wurde die Gesundheit Österreich GmbH (GÖG) in Zusammenarbeit mit den Projektpartnern Areté und Civic Consulting beauftragt. Ziel ist es, die Entwicklung der Verfügbarkeit von Medizinprodukten auf dem EU-Markt im Rahmen der Umsetzung der EU-Verordnungen über Medizinprodukte (MDR 2017/745) und über In-vitro-Diagnostika (IVDR 2017/746) zu beobachten und zu analysieren. Potenzielle Herausforderungen, wie beispielsweise Engpässe bei der Zertifizierung oder neue regulatorische Anforderungen, und mögliche Lösungen sollen aufgezeigt werden.
Die Studie umfasst Medizinprodukte und In-vitro-Diagnostika aller Risikoklassen, die bereits in Verkehr gebracht wurden oder in Verkehr gebracht werden sollen. Der Schwerpunkt wird auf folgende Produktgruppen gelegt:
- Produkte, die eine Benannte Stelle für die Konformitätsbewertung erfordern,
- Produkte für seltene Erkrankungen, Nischenprodukte und
- Produkte, bei denen die Gefahr einer Verknappung besteht.
Im Rahmen des Projekts werden umfassende schriftliche und mündliche Befragungen mit den wichtigsten Stakeholdergruppen in den 27 EU-Mitgliedstaaten sowie Island, Liechtenstein und Norwegen durchgeführt:
- Benannte Stellen (designiert nach MDR und IVDR)
- Hersteller und Bevollmächtigte
- Gesundheitseinrichtungen
- Patientenvertretungen
- zuständige Behörden
Befragung Benannter Stellen
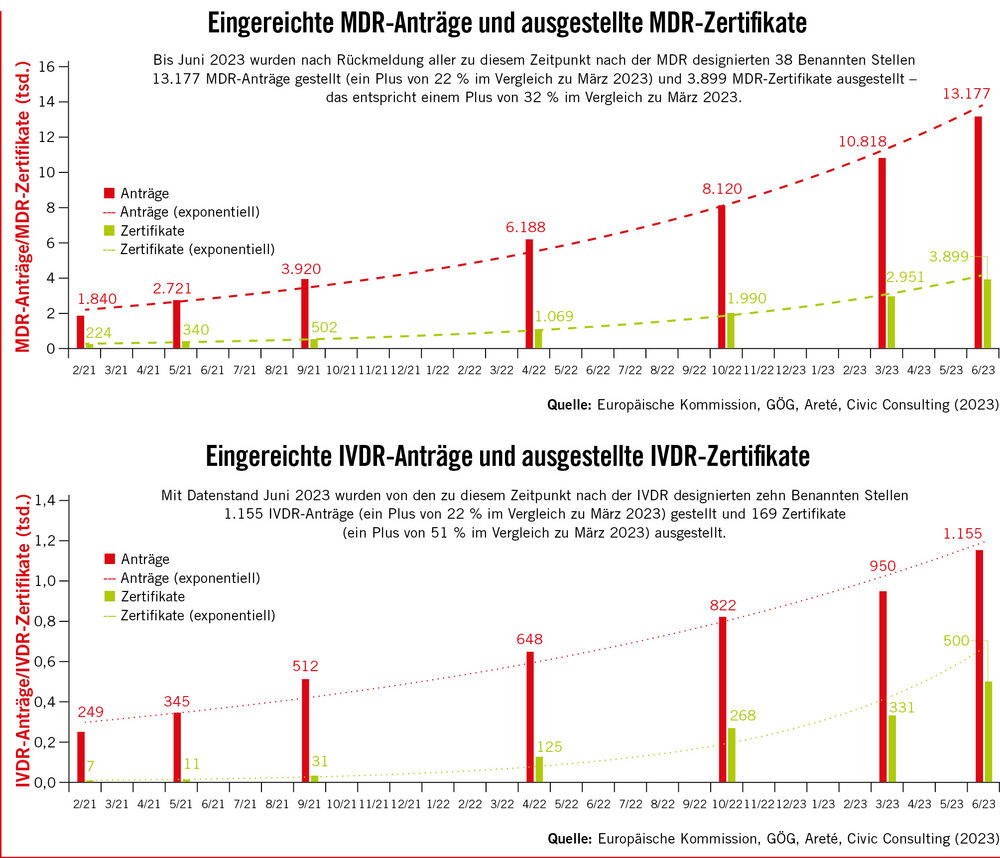
Die Befragung der Benannten Stellen startete im April 2023. Seither wurden fünf Erhebungen durchgeführt und abgeschlossen. Erfragt wurden unter anderem Informationen zu Anträgen (Anzahl eingereichter MDR-Anträge, Anzahl abgelehnter Anträge, Vollständigkeit der Anträge), zu ausgestellten Zertifikaten (QMS- und Produktzertifikate) sowie zur durchschnittlichen Dauer zwischen Antragstellung und Unterzeichnung einer schriftlichen Vereinbarung. Einmal jährlich werden auch Informationen zu den Kunden und Mitarbeitern der Benannten Stellen erhoben.
Befragung von Herstellern und Bevollmächtigten
Im November 2023 wurde mit der Befragung von Herstellern und Bevollmächtigten gestartet. Dabei werden seither von den Marktakteuren Daten und Informationen zum aktuellen Stand der Übergangsphase von den bisherigen gesetzlichen Rahmenbedingungen zu den beiden EU-Verordnungen erhoben. Die Befragung läuft bis 15. Jänner 2024. Hersteller und Bevollmächtigte von Medizinprodukten und In-vitro-Diagnostika sind aufgefordert, an der Umfrage teilzunehmen.
Dashboard
Zur Präsentation der studienrelevanten Indikatoren wurde ein interaktives Dashboard entwickelt, das die aggregierten Ergebnisse der Stakeholderbefragungen enthält. Es wird auf der Website der Europäischen Kommission öffentlich zugänglich gemacht und regelmäßig aktualisiert: https://health.ec.europa.eu/medical-devices-topics-interest_en
Kontakt für Rückfragen: medical.devices@goeg.at