Kardiovaskuläre Diagnostik bei Patienten mit rheumatologischen Erkrankungen
Im Rahmen von rheumatologischen Erkrankungen besteht ein deutlich erhöhtes kardiovaskuläres und/oder kardiopulmonales Risiko. Dies ist einerseits für Rheumatologen wichtig, um eine frühzeitige und regelmäßige kardiale Abklärung bei Risikopatienten einzuleiten, andererseits ist es auch für Kardiologen essenziell, zu bedenken, dass kardiale Erkrankungen ihren Ursprung in einer rheumatologischen Diagnose haben können. Die Tabelle zeigt eine Übersicht der rheumatologischen Erkrankungen, die mit kardiovaskulären Manifestationen einhergehen können. Dieser Artikel soll einen Überblick über Zusammenhänge und die optimale kardiovaskuläre Diagnostik bei rheumatologischen Patienten bieten.
Rheumatoide Arthritis und andere entzündliche Gelenkserkrankungen
Im Vergleich zur Normalbevölkerung besteht bei Patienten mit rheumatoider Arthritis (RA) ein höheres kardiovaskuläres Risiko1–3. Unabhängig von konventionellen Risikofaktoren haben diese Patienten ein 2-fach erhöhtes Risiko, einen Myokardinfarkt zu erleiden.4 Dies beruht einerseits auf der chronischen, systemischen Entzündung, mit der die RA einhergeht5–7, andererseits auf der Verstärkung kardiovaskulärer Risikofaktoren durch RA-Therapien (v. a. Kortikosteroide).8 Daher empfehlen aktuelle Leitlinien nicht nur eine Optimierung der Risikofaktoren, sondern auch eine Reevaluierung des kardiovaskulären Risikos, zumindest alle 5 Jahre oder bei Umstellung der RA-Therapie.9 Die Prävention von kardiovaskulären Events bei RA-Patienten beruht hauptsächlich auf einer frühen Diagnostik und Risikostratifizierung sowie regelmäßiger nichtinvasiver Diagnostik. Derzeit gibt es keine Empfehlung für invasive Diagnostik, die sich von jener für die Nicht-RA-Bevölkerung unterscheidet.
- Evaluierung des kardiovaskulären Risikos: konventionelle Modelle zur Evaluierung des kardiovaskulären Risikos (z. B. SCORE10 oder das Framingham-Modell11) sollen für RA-Patienten angewandt und mit dem Faktor 1,5 multipliziert werden, um das individuelle Risiko abzuschätzen, wenn12:
– die Krankheitsdauer > 10 Jahre beträgt
– Rheumafaktorpositivität oder Antikörper gegen anticitrullinierte Proteine vorliegen
– zusätzliche Nicht-Gelenk-Manifestation vorliegt. - Regelmäßige Kontrollen von Lipiden und HbA1c sind empfohlen.
- Ein Screening auf das Vorliegen von Carotisplaques mittels Carotisduplex ist auch bei asymptomatischen Patienten empfohlen.
Erkrankungen mit erhöhtem Risiko für die Entwicklung einer pulmonalen Hypertension
Die pulmonale Hypertension (PH) ist durch eine Erhöhung der kardiopulmonalen Drucke gekennzeichnet und liegt definitionsgemäß bei einem mittleren pulmonalarteriellen Druck von > 20 mmHg vor. Eine verlässliche Bestimmung der Druckwerte kann nur durch invasive Diagnostik mittels Rechtsherzkatheter erfolgen. Zu den Erkrankungen, die mit einem erhöhten Risiko für die Entwicklung einer PH einhergehen, zählen vor allem die Kollagenosen. Die Prävalenz der PH liegt bei Patienten mit systemischer Sklerose (SSc) vermutlich bei ca. 10–20 %, allerdings gibt es Daten von histopathologischen Studien, die Veränderungen bei 60–80 % aller SSc-Patienten beschreiben, die das Vorliegen einer PH vermuten lassen. Prinzipiell muss man allerdings zwischen Erkrankungen unterscheiden, die durch eine primäre Veränderung der pulmonalen Gefäße oder des Lungenparenchyms zu einer präkapillären PH führen, und jenen, die sekundär durch eine myokardiale Dysfunktion oder Versteifung eine postkapilläre PH verursachen. Die chronische systemische Entzündung, die bei beinahe allen rheumatologischen Erkrankungen vorliegt, kann zu myokardialer Fibrose führen, die eine diastolische Dysfunktion verursacht. Auch aufgrund der dadurch erhöhten linksventrikulären Füllungsdrucke kann sich eine PH entwickeln.
Kardiale Diagnostik in der Rheumatologie
Eine Basisdiagnostik sollte bei Patienten mit rheumatologischen Erkrankungen regelmäßig erfolgen. Dazu gehört bei allen Patienten die Elektrokardiografie (EKG) und die Echokardiografie. Bei ausgewählten Patienten kann die kardiale Diagnostik auch mittels Magnetresonanztomografie, Ergometrie oder invasiver Diagnostik mittels Herzkatheter erweitert werden.
Elektrokardiografie
Ein EKG sollte bei allen Patienten geschrieben werden und dient nicht nur der Ischämiediagnostik, sondern kann bei betroffenen Patienten auch Hinweise auf das Vorliegen einer Rechtsherzbelastung liefern. Zu diesen EKG-Veränderungen gehören: eine Rechtsdeviation des Lagetyps, der Rechtschenkelblock, die rSR’-Konfiguration in V1 und der rechtsventrikuläre Strain, der sich im EKG als ST- und T-Wellen-Inversion in V1–V3, manchmal auch in II, III und aVF darstellt.
Echokardiografie zur Screening- und Verlaufsdiagnostik der pulmonalen Hypertension
Die Echokardiografie eignet sich ideal zum PH-Screening und sollte bei Patienten mit Kollagenosen (v. a. SSc und systemischem Lupus erythematodes) regelmäßig durchgeführt werden.
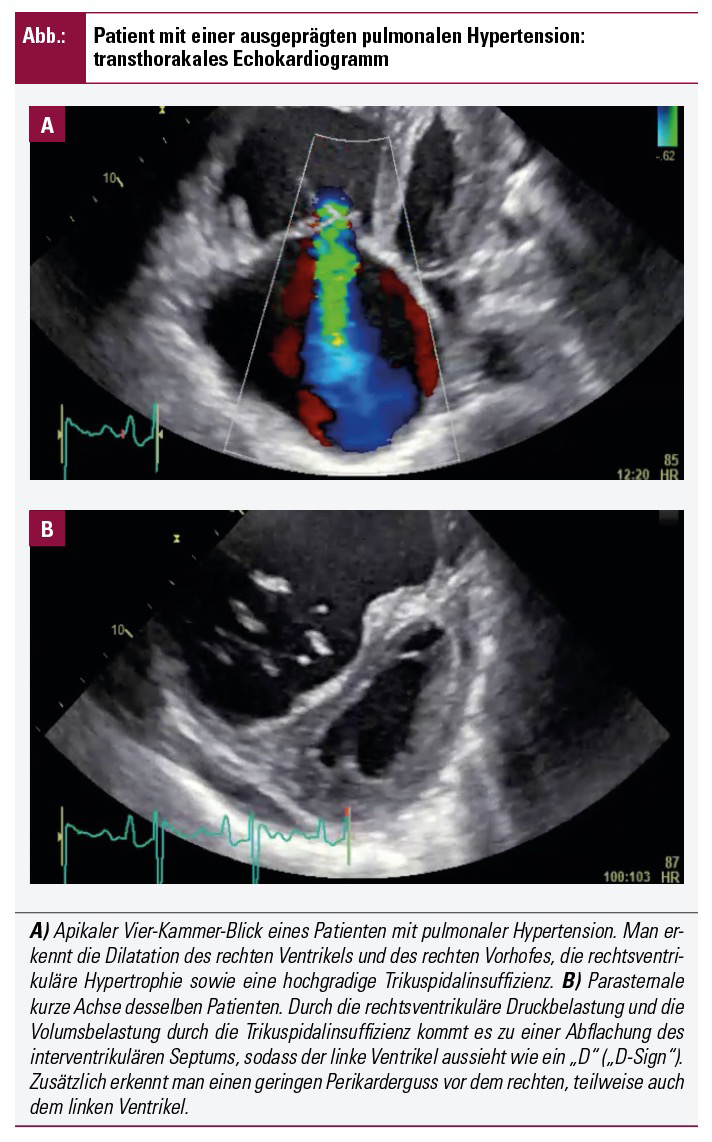
Die PH führt zu einer Rechtsherzbelastung, da der rechte Ventrikel (RV) physiologisch nicht dafür ausgelegt ist, gegen hohe Widerstände in der Lungenstrombahn, wie sie bei der PH vorliegen, anzupumpen. Daher liegt auch der Fokus der echokardiografischen Diagnostik auf der Beurteilung des RV. Die folgenden Merkmale deuten auf das Vorliegen einer PH hin:
- RV-Dilatation: Der RV sollte immer kleiner sein als der linke und sollte nicht spitzenbildend sein. Ab einem basalen RV-Durchmesser von 40 mm spricht man von einer RV-Dilatation.
- Abflachung des interventrikulären Septums („D-Sign“). Durch die Druckbelastung des RV kommt es zu einer Abflachung des interventrikulären Septums. Dies lässt den normalerweise runden linken Ventrikel wie den Buchstaben „D“ aussehen und wird daher als „D-Sign“ bezeichnet. Dieses Phänomen lässt sich am besten in einer parasternalen kurzen Achse (Querschnitt durch beide Ventrikel) darstellen.
- Erweiterung der Pulmonalarterie und Pulmonalklappeninsuffizienz: Häufig sieht man bei Patienten mit PH auch eine Dilatation der Pulmonalarterie und im Farbdoppler eine Pulmonalklappeninsuffizienz. Von einer erweiterten Pulmonalarterie spricht man bei einem Durchmesser von > 28 mm.
- RV-Hypertrophie: Da sich eine PH in der Regel graduell entwickelt, hat der RV Zeit, sich an den erhöhten pulmonalen Widerstand anzupassen. Dies erkennt man als Hypertrophie der freien lateralen Wand des RV.
- Trikuspidalinsuffizienz: Durch den erhöhten Druck und die Vergrößerung des RV kommt es zu einer Dilatation des Klappenhalteapparates der Trikuspidalklappe, sodass die Klappe nicht mehr optimal schließt. Dadurch entsteht eine Klappeninsuffizienz, die im Extremfall sogar einen Koaptationsdefekt zur Folge haben kann. In diesem Fall ist der Klappenring derart dilatiert, dass sich die Klappensegel nicht mehr berühren. Dies führt zu einem Druckangleich zwischen Ventrikel und Vorhof.
- Vorhofvergrößerung: Durch den erhöhten Druck in den pulmonalen Gefäßen, der sich in das rechte Herz fortleitet, kommt es zu einer Dilatation des rechten Vorhofs. Dies ist sowohl die Folge einer Druckbelastung als auch einer Volumenbelastung, die durch die Trikuspidalinsuffizienz entsteht.
Erhöhung des geschätzten systolischen pulmonalarteriellen Drucks (sPAP): Bei Patienten mit einer Trikuspidalinsuffizienz lässt sich mithilfe der maximalen Geschwindigkeit des Insuffizienzsignals der systolische pulmonalarterielle Druck abschätzen. Zur Berechnung zieht man die vereinfachte Bernoulli- Gleichung (Vmax2 x 4) heran und addiert den geschätzten Vorhofdruck. Bei einem berechneten sPAP von > 35 mmHg spricht man von einer PH.
- Dilatation der Vena cava inferior: Durch die Druckerhöhung im rechten Herzen kommt es auch zur Dilatation der Vena cava inferior. Ein weiteres Zeichen ist ihre eingeschränkte oder sogar fehlende respiratorische Kaliberschwankung.
- Perikard- und Pleuraergüsse: Ergussformationen entstehen als Folge der RV-Dysfunktion. Vor allem bei rheumatologischen Erkrankungen ist allerdings bei Vorliegen von Ergüssen die Differenzialdiagnose einer Serositis in Betracht zu ziehen. Diese geht meist ohne Zeichen einer RV-Belastung einher.
Die Abbildung zeigt ein transthorakales Echokardiogramm eines Patienten mit einer ausgeprägten pulmonalen Hypertension.
Kardiale Magnetresonanztomografie
Die Magnetresonanztomografie (MRT) ist der Goldstandard zur Bestimmung der kardialen Volumina und Funktion. Dies ist besonders relevant, wenn die echokardiografische Bildqualität unzureichend ist. Sie kann in der genauen Evaluierung der RV-Funktion bei Patienten mit PH dienen. Weiters ist sie in der nichtinvasiven Diagnostik der koronaren Herzerkrankung relevant. Mithilfe einer Kontrastmittelapplikation können regionale Ischämieareale dargestellt werden und kann ihre Vitalität bestimmt werden. Vor allem bei rheumatologischen Erkrankungen, die mit mikrovaskulären Veränderungen einhergehen, kann die MRT hilfreich sein. Mikrovaskuläre Dysfunktion führt in der Regel zu diffuser Fibrose, die mittels T1-Mapping in der MRT detektiert und auch quantifiziert werden kann. Durch diese Gewebecharakterisierung kann das Verhältnis von intrazellulärem zu extrazellulärem Volumen berechnet werden.
Mittels T2-gewichteter Sequenzen kann auch myokardiales Ödem nachgewiesen werden, wie es bei chronischer Inflammation vorkommt. Dies könnte in Zukunft vor allem bei der Diagnostik von systemischer Muskelentzündungen (Autoimmunmyositis) an Bedeutung gewinnen.
Resümee
- Die kardiale Diagnostik sollte bei Patienten mit rheumatologischen Erkrankungen frühzeitig eingeleitet werden und nicht erst wenn Patienten Symptome entwickeln. Die regelmäßige Durchführung einer Echokardiografie wird vor allem bei Patienten mit Kollagenosen empfohlen.