Sentinel-Lymphknoten-Biopsie: Was ist noch unklar?
Der axilläre Lymphknotenstatus ist der wichtigste Prognosefaktor beim invasiven Mammakarzinom und dient weiterhin der adjuvanten Therapieentscheidung. Bei klinisch unauffälliger Axilla ist die Sentinel-Lymphknoten-Biopsie (SLNB) der chirurgische Standard. Eine Axilladissektion sollte nicht mehr als diagnostische Maßnahme durchgeführt werden.
Offene Fragen zur SLNB:
- Kontrovers ist die SLNB (ASCO 2017, AGO-Deutschland) bei T3/T4-Tumoren und schwangeren Frauen.1 Die AGO betrachtet die Indikation zur SLNB unabhängig vom T-Stadium als gegeben (LOE 3b/B/+).
- Der Verzicht auf die SLNB zum axillären Staging wird zurzeit in den Studien SOUND und INSEMA untersucht.
Therapie der Axilla bei positivem Nodalstatus
Das chirurgische Vorgehen bei Patientinnen mit positivem Nodalstatus ist bis heute nicht eindeutig geklärt. Zwei randomisierte Studien konnten keinen Benefit einer Axilladissektion (ALND) bei geringer, klinisch okkulter Tumorlast (1–2 positive SLN) und adjuvanter systemischer Therapie und Strahlentherapie belegen.2, 3 Die 10-Jahres-Ergebnisse der ACOSOG-Z0011-Studie zeigten eine regionäre Rezidivrate von 0,5 % bei Patientinnen, die eine Axilladissektion erhielten, versus 1,5 % nach alleiniger SLNB. Das lokoregionäre Rezidiv (81,2 % versus 83,0 %) und das Gesamtüberleben (83,6 % versus 86,3 %) zeigten keinen statistisch signifikanten Unterschied.
Leitlinienempfehlungen 2017: Trotz der methodischen Mängel der oben genannten Studie (unzureichende Fallzahl, hoher Anteil an Patientinnen mit Mikrometastasen, unzureichend definierte Bestrahlungsfelder) und trotz mangelnder bestätigender Daten wurden 2017 Leilinien publiziert, die den Verzicht auf eine Axilladissektion bei 1–2 befallenen Sentinel-Lymphknoten empfehlen: ASCO 2017 empfiehlt bei Erfüllung der ACOSOG-Kriterien (Brusterhaltung [BET], 1–2 SLN positiv, Strahlentherapie der Brust) den Verzicht auf die Axilladissektion (Evidenzgrad hoch, Empfehlungsgrad hoch).4 In der S3-Leitlinie (2017) wird erstmals in einer deutschen Leitlinie der Verzicht auf eine Axilladissektion in diesem Kollektiv gegenüber anderen Maßnahmen (ALND, Strahlentherapie) favorisiert.
Sinkende ALND-Raten: Poodt et al. untersuchten anhand eines nationalen holländischen Krebsregisters das operative Vorgehen in der Axilla bei 8.191 Frauen, die mit einer BET behandelt wurden und 1–2 befallene SLN hatten. Die Rate der ALND sank von 75 % (2011) auf 17 % im Jahr 2015.5 Hennings et al. analysierten 188.909 Datensätze des Westdeutschen Brustzentrums (aus den Jahren 2008 bis 2015) und identifizierten 13.741 Patientinnen mit einem cT1/2cN0M0-Tumor, die 1–2 positive SLNs aufwiesen und eine BET mit Tangentialfeldbestrahlung der Brust erhielten.6 Die Rate an ALND sank von 94,6 % (2008) auf 46,9 % (2015). In der Studie zeigten sich erhebliche Unterschiede in den Therapiestandards einzelner Kliniken. Dabei schwankten die ALND-Raten im Jahr 2015 zwischen 80,1 % und 3,45 % zwischen verschiedenen Institutionen.
Axilladissektion vs. Axillabestrahlung: Beim ASCO 2017 wurden erstmals Daten vorgestellt, die den Verzicht auf eine Axilladissektion bei Patientinnen mit Mastektomie und niedriger nodaler Tumorlast (pN1[sn][1–3]) untersucht haben. Gleichzeitig wurde der Einfluss der Thoraxwandbestrahlung analysiert. Dabei wurden 42. 371 Datensätze aus der SEER-Datenbank ausgewertet. Klinisch nodal negative Patientinnen mit einem cN0pN1(sn)-Status, bei denen auf eine Axilladissektion verzichtet wurde und eine Mastektomie ohne Bestrahlung der Thoraxwand durchgeführt wurde, wiesen nach einem medianen Follow-up von 4,1 Jahren eine signifikant höhere Mortalität auf im Vergleich zu Patientinnen, die entweder eine ALND oder eine Bestrahlung der axillären Lymphknoten bei positivem SLN erhalten hatten (HR 1,25; 95%-KI 1,11–1,41; p > 0,001).7
Während für die operative Lymphknotenentfernung (im Rahmen eines multimodalen Behandlungsansatzes) bis heute keinen Vorteil in Bezug auf die regionäre Kontrolle, das krankheitsfreie Überleben (Disease-free Survival – DFS) oder das Gesamtüberleben (Overall Survival – OS) nachgewiesen werden konnte, zeigten zwei randomisierte Studien Vorteile für eine Strahlentherapie der extraaxillären Lymphknoten bei Patientinnen mit einem positiven SLN.8, 9 Interessanterweise wurde nicht nur die lokoregionäre Kontrolle, sondern auch das Fernmetastasen-freie Intervall verbessert, sodass durch eine Strahlentherapie der regionären Lymphknoten die systemische Kontrolle verbessert werden könnte.
Zusammenfassend weisen diese Daten darauf hin, dass nicht die lokale Therapie per se, sondern eher die operative Therapie (im multimodalen Setting) keinen Effekt auf das onkologische Outcome zeigt. Eine Strahlentherapie hat bei ungünstiger Prognose einen positiven Effekt auf das Überleben.
Die Indikation zu einer Axilladissektion beschränkt sich zunehmend auf Patientinnen mit hoher Tumorlast in der Axilla (> 2 positive SLN oder klinisch verdächtige und befallene Lymphknoten).
Fazit: Die SLNB ist das Standardverfahren für alle Patientinnen, für die ein axilläres Staging bei primärer Operation erforderlich ist. Die Indikation zu einer Axilladissektion wird bei klinisch okkultem und geringfügigem Tumorbefall im SLN meistens verlassen, wenn eine BET unter Einschluss einer Tangentialfeldbestrahlung durchgeführt wurde. Das optimale radiotherapeutische Vorgehen bei diesen Patientinnen ist noch nicht abschließend geklärt. Die weitere Reduktion der Indikationsstellung zur Axilladissektion bei klinisch okkultem Nodalbefall (Mastektomie +/– Radiotherapie, > 2 LN) ist Gegenstand aktuell laufender Studien.
Offene Fragen:
In Bezug auf den Verzicht auf eine Axilladissektion im Stadium cN0pN1(sn) werden folgende Fragen diskutiert:
- Kann auch bei einer hypofraktionierten Ganzbrustbestrahlung auf eine ALND verzichtet werden?
Sind hohe Tangenten im Rahmen der Ganzbrustbestrahlung erforderlich? - Kann bei einer Mastektomie mit anschließender Bestrahlung der Thoraxwand auf eine ALND verzichtet werden?
- Kann bei einer Mastektomie ohne Bestrahlung der Thoraxwand auf eine ALND verzichtet werden?
- Kann auch bei mehr als 2 klinisch okkult befallenen Lymphknoten auf eine ALND verzichtet werden?
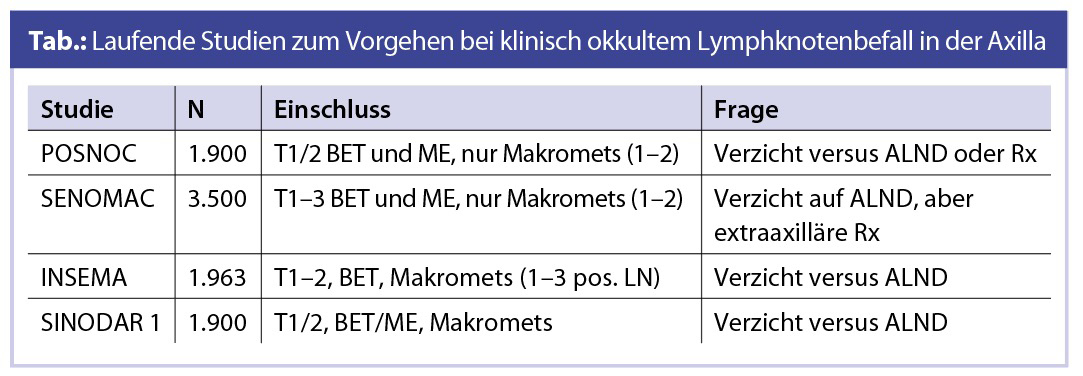
Aktuelle Studien zum Vorgehenin der Axilla bei cN0/pN1(sn)
Die Tabelle zeigt Studien, die ermitteln werden, inwieweit die Indikationsstellung zu einer ALND auf Patientinnen, die eine Mastektomie (+/– Bestrahlung) erhalten und > 2 positive SLN oder T3-Tumoren aufweisen, erweitert werden kann.
Sentinel-Node-Biopsie und neoadjuvante Chemotherapie
In Bezug auf die Detektionsrate für den SLN und die diagnostische Genauigkeit der Technik nach neoadjuvanter Chemotherapie konnten mehrere große prospektive Studien und Metaanalysen zeigen, dass die Erfolgsraten für die SLNB vom prätherapeutischen (klinischen) Nodalstatus abhängig sind.10, 13 Bei Patientinnen mit einem primär unauffälligen Nodalstatus vor der Chemotherapie ist sowohl die Detektionsrate als auch die Falsch-negativ-Rate für die SLNB vergleichbar mit der bei primär operierten Patientinnen.3 Für Frauen mit einem primär positiven Nodalstatus ist die Detektionsrate für den SLN signifikant reduziert.11–13 Auch die Falsch-negativ-Rate (FNR) ist deutlich erhöht. In einer Metaanalyse von van Nijnatten wurde bei 1.395 Patientinnen mit einem initial (histologisch gesicherten) positiven Nodalstatus eine Detektionsrate von 92,3 % und eine FNR von 15,1 % ermittelt.13
Aufgrund des hohen klinischen Nutzens einer SLNB nach neoadjuvanter Chemotherapie (Ermittlung der pCR, Einsparung einer Operation) sowie der günstigen Daten hinsichtlich der Durchführbarkeit und der Genauigkeit bei Frauen, die vor der Therapie einen klinisch unauffälligen Lymphknotenstatus aufweisen, hat sich die Durchführung einer SLNB nach NACT in allen internationalen Leitlinien fest etabliert.
Für Patientinnen, die vor der NACT einen positiven Lymphknotenstatus aufweisen, zeigten zwei große prospektive Kohortenstudien3, 18 deutlich eingeschränkte Erfolgsraten für die SLNB sowohl in Bezug auf die Detektionsrate als auch FNR. Das Resümee beider Studien lautete, dass die Technik der SLNB modifiziert werden sollte, um die Durchführbarkeit und die diagnostische Genauigkeit des Verfahrens für dieses Patientinnenkollektiv zu verbessern. Allerdings lagen bisher noch keine Daten zu regionären Rezidivraten für die Durchführung einer SLNB nach NACT vor, und die Frage, ob sich eine erhöhte FNR > 10 % auf die onkologische Sicherheit überträgt, ist bisher nicht geklärt.
Für eine Modifikation der SLNB-Technik werden mehrere Optionen diskutiert:
- Entfernung von > 2 SLN11
- Nutzung einer kombinierten Tracer-Anwendung (Radiokolloid und Farbstoff)11
- gezielte Suche nach okkulten Tumorzellen durch Immunhistochemie14, 15
- prätherapeutische Clipmarkierung eines stanzbioptisch gesicherten Lymphknotens6, 16
Targeted Axillary Dissection (TAD) zur Senkung der Falsch-negativ-Rate (FNR): Ein weiteres Konzept, die FNR für die SLNB nach NACT bei cN1-Patientinnen zu senken, ist die Applikation von Markern (Clip, radioaktive oder magnetische Seeds, Kohle) in prätherapeutisch punktierten und histologisch bestätigten Lymphknotenmetastasen. In einer ungeplanten retrospektiven Analyse der ACOSOG-Z1071-Studie betrug die FNR 7,4 %, wenn der SLN mit dem Clip-markierten Lymphknoten übereinstimmte.15 Am MD Anderson Cancer Center wurde daraufhin ein neues vielversprechendes Verfahren, die Targeted Axillary Dissection (TAD) entwickelt.16 Diese Technik kombiniert die SLNB mit einer gezielten Resektion des prätherapeutisch stanzbioptisch gesicherten und anschließend markierten Lymphknotens (Target-Lymphknoten – TLN). Die Markierung kann mittels Clips, radioaktiven Seeds, Farbstoffen (Kohle) oder magnetischen Tracern erfolgen.
Caudle et al. publizierten 2016 eine unizentrische, retrospektive Studie aus einer prospektiv erhobenen Datenbank. Darin wurde bei 208 Patientinnen eine TAD nach der NACT durchgeführt.17 Von diesen Patientinnen erhielten 191 Frauen eine Axilladissektion. Von 120 Patientinnen, die nach der NACT noch positive Lymphknoten aufwiesen, war der Clip-markierte Lymphknoten in 115 Fällen befallen. Daraus resultiert eine FNR von 4,2 % für die Entfernung eines Clip-oder Seed-markierten Lymphknotens (Target-Lymphknotenbiopsie – TLNB). Für die alleinige SLNB wurde in diesem Kollektiv eine FNR von 10,1 % ermittelt. In 23 % der Fälle war der Clip nicht im SLN lokalisiert. Bei 6/7 FN-Fällen bei der alleinigen SLNB fanden sich tumorbefallene Clip-markierte Lymphknoten. Bei 85 Frauen wurde eine TAD gefolgt von einer ALND durchgeführt. Die FNR betrug 1,4 %.
Die aktuell akzeptierte FNR für operative Staging-Maßnahmen in der Axilla von 10 % ist ein willkürlicher, aber weitgehend konsentierter Cut-off. Das Verhältnis zwischen FNR und regionären Rezidiven ist bisher unzureichend bekannt, da keine Langzeitdaten für die verschiedenen operativen Techniken nach NACT verfügbar sind.
Offene Fragen:
- Ist bei einer bildgebenden Komplettremission nach NACT noch eine Operation der Axilla erforderlich? EUBREAST- 01, eine multizentrische, nichtrandomisierte Studie zur Frage, ob nach pCR der Brust auf die SLNB verzichtet werden kann, ist zur Rekrutierung offen (www.eubreast.com, Anfragen zur Teilnahme bei der Autorin).
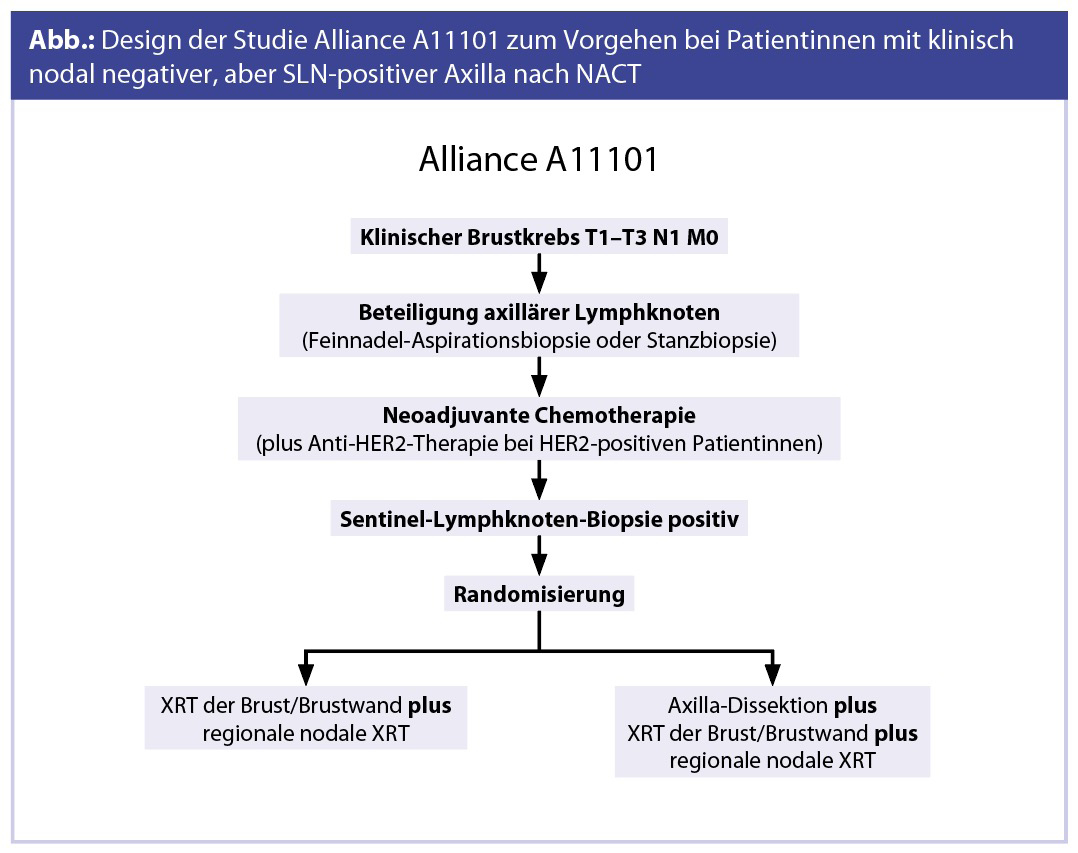
- Kann das Ansprechen auf eine Chemotherapie die lokale Therapie modifizieren? In der Studie NSABP B-51/RTOG 1304 (NRG 9353) erhalten Patientinnen, die durch eine NACT von einem positiven zu einem negativen Nodalstatus konvertieren, entweder eine ergänzende Strahlentherapie (Lymphabflussgebiete bei BET oder Thoraxwand und Lymphabflussgebiete bei Mastektomie) oder keine ergänzende Radiotherapie. In dieser Studie wird die Frage geklärt, ob durch das gute Ansprechen auf eine NACT die regionäre Therapie deeskaliert werden kann. Im Alliance Trial A11101 wird bei Patientinnen, die eine klinisch nodal negative, aber SLN-positive Axilla nach der NACT aufweisen, entweder eine Axilladissektion mit einer lokoregionären Bestrahlung allein (Brust/Thoraxwand und Lymphabflussgebiete) oder eine Radiotherapie allein durchgeführt (Abb.).
- Targeted Axillary Disessction (TAD) nach Konversion eines cN+: Eine von EUBREAST (www.eubreast.com) geplante internationale Registerstudie soll Daten zur Reproduzierbarkeit, zu Rezidivraten, zur operativen Radikalität sowie zur Morbidität im Vergleich zu anderen Verfahren (SLNB, ALD) erfassen ( Anfragen zur Teilnahme bei der Autorin).
Die Reproduzierbarkeit der TAD wurde trotz des überzeugenden Konzeptes hinterfragt: Dies gilt insbesondere für die Lokalisation und Auffindbarkeit eines Clip-markierten Lymphknotens nach bildgebender Komplettremission in der Axilla.In einer prospektiven unizentrischen Feasibility-Studie untersuchten Hartmann et al. die Identifikationsrate für den TLN an 30 Patientinnen nach einer NACT.18 Sonografisch konnte der TLN präoperativ bei 25/30 Patientinnen (83,3 %) identifiziert und markiert werden. In 9/39 (30 %) konnte die Entfernung des Clips aber nicht in der Präparateradiografie bestätigt werden.
In einer prospektiven Studie von Siso et al. wurden 46 Patientinnen untersucht, bei denen präoperativ ein Clip in einem gesichert positiven Lymphknoten platziert wurde. In dieser Studie konnte der Clip bei 44/46 Patientinnen durch eine Ultraschall-gesteuerte Operation detektiert und reseziert werden. 26 Frauen erhielten eine TAD. Bei 27 Patientinnen entsprach der TLN dem SLN (77 %). Die FNR für die TAD betrug 4,1 % (KI 0,1–21,1 %).19
Outcome nach alleiniger SLNB: Erste Daten über das Outcome von Patientinnen, die nach einer NACT eine alleinige SLNB erhielten, wurden 2016 von Galimberti et al. publiziert.20 In einer retrospektiven Analyse wurden 396 Patientinnen mit den Tumorstadien cT1–4, cN0/1/2 untersucht, bei denen nach der NACT zumindest ein SLN entfernt worden war und die keine weitere operative Intervention in der Axilla bei tumorfreiem SLN erhalten hatten. Von 249 Patientinnen, die prätherapeutisch einen klinisch unauffälligen Lymphknoten aufwiesen, wurde bei 157 Frauen ein negativer SLN nach der systemischen Therapie entnommen. Nach 5 Jahren betrug die axilläre Rezidivrate 1/157 (0,6 %). Bei 147 Frauen mit einem cN1/2-Stadium, die nach NACT einen negativen SLN aufwiesen (n = 70), wurde nach 5 Jahren kein einziges axilläres Rezidiv beobachtet. Die Autoren folgern aus diesen Daten, dass die alleinige SLNB unabhängig vom initialen klinischen Nodalstatus ausreichend sicher ist.
Fazit: Bei klinisch nodal negativen Patientinnen, die eine neoadjuvante Therapie erhalten, ist die Bestimmung des Nodalstatus nach der neoadjuvanten Therapie als Standard anzusehen. Für Frauen, die prätherapeutisch einen positiven Nodalstatus aufweisen und unter Chemotherapie zu einem ycN0-Status konvertieren, kann die TAD angewendet werden, obwohl internationale Leitlinien sehr divergent sind (ALND, TAD, SLNB). Hintergrund ist die Tatsache, dass bis heute keine vergleichenden Daten zu den lokalen Rezidivraten, dem DFS oder dem OS oder auch der operativen Radikalität, der Morbidität und den Kosten für die einzelnen Verfahren verfügbar sind.
ZUSAMMENFASSUNG: Die SLNB ist das Standardverfahren für alle Patientinnen, bei denen ein axilläres Staging bei primärer Operation erforderlich ist. Die Indikation zu einer Axilladissektion wird bei klinisch okkultem und geringfügigem Tumorbefall im SLN zunehmend verlassen. Das optimale radiotherapeutische Vorgehen bei diesen Patientinnen ist noch nicht abschließend geklärt.Bei Patientinnen, die einen klinisch negativen Lymphknotenstatus aufweisen und eine neoadjuvante Therapie erhalten, sollte die SLNB nach der NACT durchgeführt werden. Für Patientinnen, die prätherapeutisch einen positiven Nodalstatus aufweisen und unter Chemotherapie zu einem ycT0-Status konvertieren, ist das optimale Vorgehen nicht geklärt.