Bispezifische Antikörper beim Multiplen Myelom
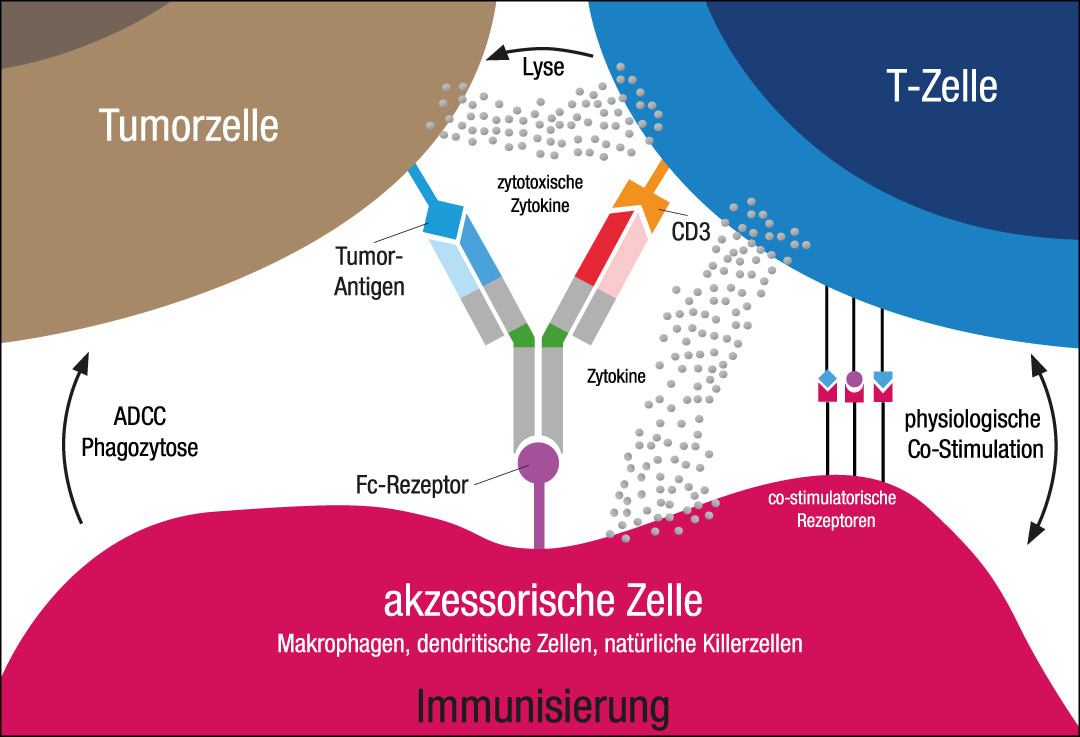
Bispezifische Antikörper (bsAb) zielen auf eine direkte Verbindung zytotoxischer T-Zellen mit der Tumorzelle, wobei die Vorteile in der MHC-/TCR-unabhängigen T-Zell-Aktivierung und – im Gegensatz zur CAR-T-Zelltherapie – in der sofortigen Verfügbarkeit liegen. Als Leitsubstanz hat Blinatumomab einen festen Platz in der Therapie der akuten lymphoblastischen Leukämie (ALL) und ließ jetzt mit Daten zu rezidivierter ALL im Kindes- und jungen Erwachsenenalter aufhorchen.1
Mit AMG 420 wurde das BiTE-Format (Bispecific T cell Engager; Abb.) erfolgreich auf das Multiple Myelom übertragen2, jedoch erfordert die kurze Halbwertszeit die Applikation als Dauerinfusion über 28 Tage; die Weiterentwicklung wurde wohl auch deshalb gestoppt. Die bsAb der 2. Generation werden jetzt in Phase-I-Studien geprüft, greifen mehrheitlich BCMA (B Cell Maturation Antigen) an und enthalten eine Fc-Domäne, wodurch die intermittierende Gabe möglich wird.
CC-93269 erzielt in der bislang höchsten Dosis eine Ansprechrate (ORR) von 89 %, davon 44 % CR/sCR. Leider verstarb ein Proband an den Folgen eines „cytokine release syndrome“ (CRS), bei allen anderen Patienten (n = 29) war die CRS-Problematik mild bzw. gut beherrschbar.3
Mit PF-3135 waren bisher (n = 23) keine höhergradigen CRS zu beobachten, es gibt aber noch kein relevantes Ansprechen (39 % SD, eine CR) – die Zieldosis ist noch nicht erreicht.4
REGN5458 wurde von 7 älteren, schwer vorbehandelten Patienten akzeptabel vertragen und zeigt ein dosisabhängiges Ansprechen (ORR 57 %).5
Präklinische Daten zu AMG 701 lassen auf einen Synergismus mit IMiDs schließen6 und öffnen das Feld für künftige Kombinationsstrategien.
Ausblick: Wir warten gespannt auf weitere Ergebnisse, auch zu bsAb mit alternativen Zielstrukturen wie FcRH5 und GPRC5D.
- Brown PA et al., 2019 ASH Annual Meeting; Abstract LBA-1
- Einsele H et al., 17th International Myeloma Workshop (IMW); Abstract OAB-025
- Costa LJ et al., 2019 ASH Annual Meeting; Abstract 143
- Raje NS et al., 2019 ASH Annual Meeting; Abstract 1869
- Cooper D et al., 2019 ASH Annual Meeting; Abstract 3176
- Cho SF et al., 2019 ASH Annual Meeting; Abstract 135