Outcome-Optimierung bei transplantablen Patient:innen
In den letzten 25 Jahren kam es zu einer enormen Veränderung der Therapielandschaft beim Multiplen Myelom, vor allem auch mit Einzug der AntiCD38-Antikörper Isatuximab und Daratumumab (Abb.).
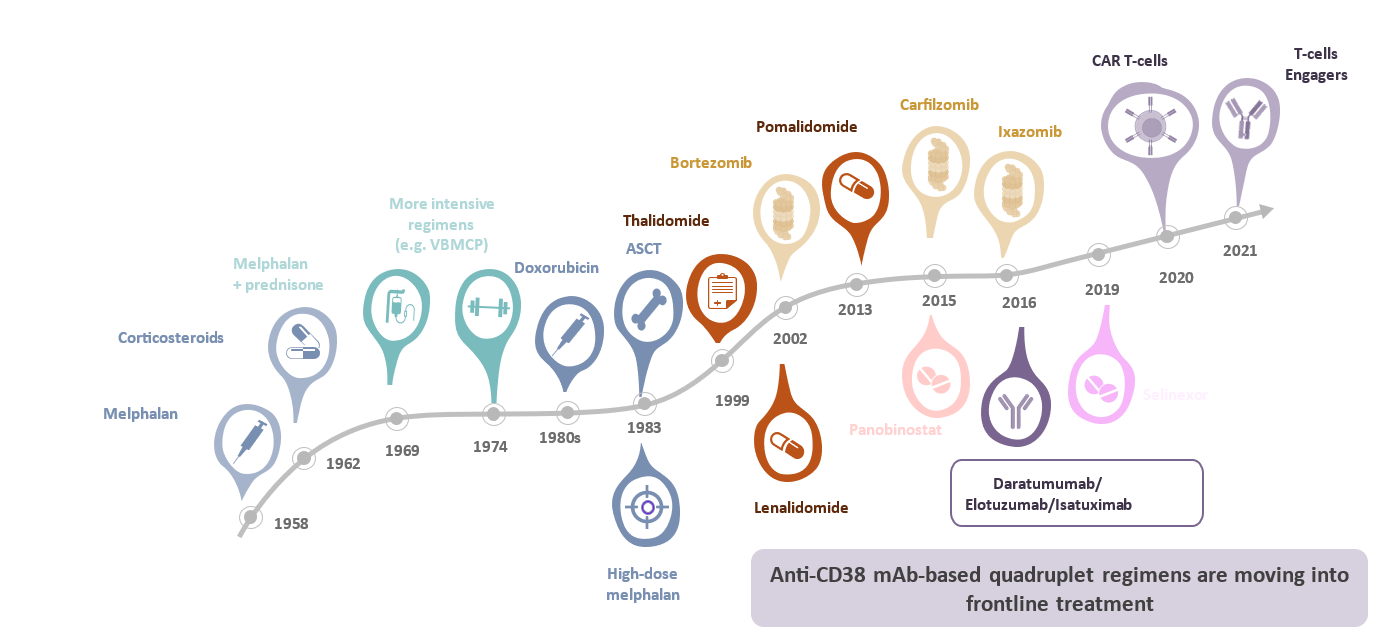
Abb: Überblick über die Therapielandschaft des Multiplen Myeloms, 1958 – 2021 | modifiziert nach Mohty M, Personal Material 2023 (presented at EHA 2023) | ASCT: autologe Stammzelltransplantation; CAR: chimärer Antigenrezeptor; mAB: monoklonale Antikörper
Quadruplet-Regime: die Macht der 4
Für NDMM-Patient:innen war eine Hochdosischemotherapie (HDT) mit anschließender ASZT bislang Therapiestandard. Die Einführung von Immunmodulatoren, Proteasom-Inhibitoren und Anti-CD38-Antikörpern hat in den letzten Jahren die medikamentösen Behandlungsoptionen erweitert und die Prognose insgesamt verbessert. Angesichts der sich wandelnden Erstlinientherapielandschaft und der Verfügbarkeit von Quadruplet-Regimen stellt sich die (berechtigte) Frage, ob die ASZT noch immer als Goldstandard anzusehen ist. Die Rolle von Quadruplet- vs. Triplet-Therapien ist eine wichtige Überlegung für die künftige Behandlung von NDMM-Patient:innen, die für eine Transplantation in Frage kommen. Obwohl eine Vielzahl an Studien bei dieser Patientenpopulation eine höhere Wirksamkeit von vierfachen gegenüber dreifachen Induktionsschemata gezeigt hat, sind mehrere Fragen ungeklärt:
- Was ist die optimale Dauer für Induktion und Konsolidierung?
- Sollte eine Konsolidierung nach ASZT bei allen Patient:innen oder nur bei bestimmten Subgruppen zur Anwendung kommen?
- Sollten Hochrisiko-Patient:innen anders behandelt werden als Patient:innen mit Standard-Risiko?
- Welche Rolle kommt der MRD bei der Identifizierung der optimalen Erstbehandlung zu?
Quadruplet-Regime:
Isatuximab in Kombination mit Lenalidomid/Bortezomib/Dexamethason (Isa-RVd) ist das erste Regime, das in einer Phase-III-Studie (GMMG-HD7) bei 50 % der Patient:innen am Ende der Induktion eine rasche und statistisch signifikante MRD-Negativität und eine Überlegenheit gegenüber RVd zeigt.1 In der vorab geplanten Interimsanalyse bei Patient:innen mit Hochrisiko erreichte die Phase-II-Studie GMMG-CONCEPT ihren primären Studienendpunkt einer statistisch signifikanten MRD-Negativitätsrate am Ende der Konsolidierung, wobei mehr als zwei Drittel der transplantablen Patient:innen unter Isatuximab in Kombination mit Carfilzomib/Lenalidomid/Dexamethason (Isa-KRd) eine MRD-Negativität erzielen konnten.2
Rolle der Konsolidierung nach ASZT:
In der Phase-III-Studie EMN02/HO95 war das progressionsfreie Überleben (PFS) bei ASZT-Patient:innen, die eine Konsolidierung mit Bortezomib/Lenalidomid/Dexamethason (VRd) erhielten, signifikant besser als bei jenen Patient:innen, bei denen keine post-ASZT-Konsolidierung zur Anwendung kam.3, 4 In der Phase-III-Studie STaMINA hingegen zeigte sich kein signifikanter Unterschied in der 6-Jahres-PFS-Rate zwischen Patient:innen, die nach der ASZT eine VRd-Konsolidierung erhielten, und solchen, die keiner post-ASZT-Konsolidierung zugeführt wurden.5, 6 Diese Ergebnisse unterstreichen die anhaltende Ungewissheit in Bezug auf die Rolle der Konsolidierung nach einer ASZT.
Verfeinerung der Maintenance-Strategien
Die Zielsetzung einer Erhaltungstherapie betrifft die Verlängerung des Überlebens, ohne einen Relaps zu erleiden, die Aufrechterhaltung einer MRD-Negativität, die Vermeidung kumulativer oder Langzeit-Toxizität, die Verhinderung nachteiliger Auswirkungen auf die Lebensqualität sowie die Abwendung von Auswirkungen auf die Wirksamkeit nachfolgender Behandlungen bei einem Relaps7.
Hochrisikopopulation:
Als derzeitiger Standard of Care (SOC) unter den Maintenance-Regimen gilt eine Lenalidomid-Monotherapie.8 Bei Patient:innen mit Hochrisiko-Zytogenetik sind die Outcomes bei einer Lenalidomid-Erhaltungstherapie schlechter als bei Standard-Risikopatient:innen, was auf einen unmet need in dieser Population hinweist.9, 10 Die Definition von Subgruppen, die eine intensivere Erhaltungstherapie benötigen (z. B. Patient:innen mit Hochrisiko-Zytogenetik), ist ein wichtiges Element zur Optimierung der Maintenance. Neuartige Therapiestrategien, wie etwa Anti-CD38-Antikörper-basierte Regime mit mehreren Wirkstoffen (GMMG-CONCEPT-Studie: Isatuximab in Kombination mit Carfilzomib, Lenalidomid und Dexamethason2; OPTIMUM/MUK9-Studie: Daratumumab in Kombination mit Cyclophosphamid, Lenalidomid, Bortezomib und Dexamethason11), können dazu beitragen, die Überlebensoutcomes bei Hochrisiko-Patient:innen zu verbessern.
Dauer der Erhaltungstherapie:
Eine Lenalidomid-Erhaltungstherapie bis zum Progress wird als SOC angesehen.12 Die Identifizierung jenes Zeitpunkts, zu dem Patient:innen die Erhaltungstherapie ohne Beeinträchtigung der Wirksamkeit beenden können, würde dazu beitragen, die mit der Behandlung verbundene Toxizität zu verringern und die Lebensqualität der Patient:innen zu verbessern.9, 13
Der MRD-Status
ist nachweislich ein starker Prädiktor für die Überlebensaussichten.14 In Zukunft könnte die MRD zur Steuerung der Behandlung verwendet werden, z. B. um zu entscheiden, welche Wirkstoffe in der Erhaltung eingesetzt werden sollen15, 16, wann eine Deeskalation erfolgen und wann die Behandlung abgebrochen werden soll.16, 17




















































































