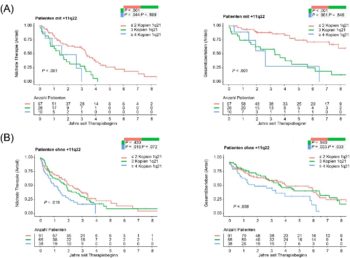
Prognostischer Wert zusätzlicher 1q21-Kopien
Das Multiple Myelom (MM) kann aufgrund von primären Chromosomenaberrationen – primäre IGH-Translokationen oder Hyperdiploidie (HRD) – in verschiedene Subgruppen unterteilt werden. Zur Abschätzung der Prognose einer MM-Erkrankung werden unter anderem Aberrationen herangezogen, die standardmäßig durch die Fluoreszenz-in-situ-Hybridisierung (FISH) untersucht werden. Als Hochrisikomarker nach revidiertem ISS gelten t(4;14), t(14;16) und die Deletion 17p. Auch der sekundäre Zugewinn 1q21 (+1q21) wird mit einer ungünstigen Prognose assoziiert; dabei scheint die Kopienzahl von +1q21 relevant zu sein.
Ziel unserer retrospektiven Studie* von 794 Patienten (Jahre 2010–2020), davon 299 Patienten mit Überlebenszeitdaten aus dem Österreichischem Myelomregister, war es, die Fälle nach primären Aberrationen zu ordnen und mit sekundären Aberrationen (z.B. +1q21) und der Klinik zu assoziieren. Beinahe alle Patienten (98 %) wurden in der Induktionstherapie mit immunmodulierenden Substanzen und/oder Proteasom-Inhibitoren behandelt, 44 % erhielten eine autologe Stammzelltransplantation und 39 % eine Erhaltungstherapie. Die untersuchten Patienten (medianes Alter 70 Jahre) hatten eine mediane Zeit bis zum Beginn der nächsten Therapielinie (time to next treatment, TTNT) von 2,0 Jahren und ein medianes Gesamtüberleben (overall survival, OS) von 5,8 Jahren. Wie in anderen Studien hatten ≥ vier Kopien im Vergleich zu drei Kopien 1q21 einen stärkeren negativen Einfluss auf die Prognose.
Als nächstes unterteilten wir die Fälle nach primären Aberrationen, beispielsweise in eine mit HRD stark assoziierte Subgruppe mit klonalem +11q22 und ohne primäre Translokationen, und führten verschiedene Berechnungen durch. Dabei zeigte sich, dass in der +11q22-Subgruppe, welche auch mit CD56+/CD117+ Antigenexpression assoziiert war und in der männliche Patienten übervertreten waren, bereits drei Kopien 1q21 mit stark verkürzten medianen TTNT und OS einhergingen (Abb., Teil A). Diese Beobachtung könnte mit der Koexpression von CCND1 und CCND2 zusammenhängen, die bei Vorliegen beider Marker, +1q21 und +11q, innerhalb der HRD-Gruppe beschrieben wurde.1 In der Gruppe, welche die restlichen Fälle enthielt, hatten nur ≥ vier Kopien 1q21, nicht aber drei Kopien einen signifikant negativen Einfluss auf TTNT und OS (Abb., Teil B).
Fazit: Unsere auf der DGHO-Jahrestagung vorgestellten und kürzlich publizierten Daten2, die (idealerweise prospektiv) bestätigt werden sollten, weisen darauf hin, dass die prognostische Bedeutung sekundärer Aberrationen wie +1q21 in unterschiedlichen MM-Subgruppen verschieden sein kann. Unsere Daten sind vereinbar mit einem negativen Einfluss von +1q21 bei HRD. Die Berücksichtigung des 1q-Status ermöglichte die Unterscheidung zweier +11q22-Patientengruppen: eine Gruppe (ohne +1q21, 22 % aller Patienten) mit einem sehr günstigen Verlauf und eine andere Gruppe (mit +1q21 unabhängig von der Kopienzahl, 12 % aller Patienten) mit einer ungünstigen Prognose.
1 Shah V et al., Leukemia 2018; 32(1):102–110
2 Locher M et al., Am J Hematol 2020; (August):1–10