Prim.a Assoc. Prof.in Dr.in Robab Breyer-Kohansal
Abteilung für Atmungs- und Lungenerkrankungen, Klinik Hietzing, Wien
Anlässlich des Welt-Asthma-Tages 2022 wurden die neuesten internationalen Empfehlungen in der Diagnostik und Behandlung von Asthma durch die Global Initiative for Asthma (GINA) veröffentlicht.1 Asthma ist weiterhin eine weltweit häufig auftretende chronische Erkrankung: Über 399 Millionen Menschen sind betroffen.2 Das sind ca. 4,3 % der gesamten Weltbevölkerung. In Österreich gibt es dazu die Daten der österreichischen LEAD-Studie. Hier zeigte sich eine Asthmaprävalenz der untersuchten Allgemeinbevölkerung (Männer und Frauen, 6–80 Jahre) von 4,4 %. Asthma ist und bleibt weiterhin die häufigste chronische Erkrankung bei Kindern.
Asthma ist eine heterogene Erkrankung, die durch eine chronische Atemwegsentzündung charakterisiert wird. Eine adäquate Diagnose ist maßgeblich, um den Verlauf dieser variablen Erkrankung positiv zu beeinflussen. Rein theoretisch kann man mit dem Asthma 100 Jahre alt werden, sofern die Diagnose gestellt ist und eine passende Therapie, entsprechend dem Stufentherapie-Konzept, etabliert wurde. Wichtig ist, und das gilt für alle chronisch obstruktiven Atemwegserkrankungen, dass die Patient:innen über ihre Erkrankung Bescheid wissen und im Umgang mit ihren Symptomen und der medikamentösen und nichtmedikamentösen Therapie geschult sind.
Das Stufentherapie-Konzept in der medikamentösen Asthmatherapie erlaubt uns und unseren Patient:innen eine gute Flexibilität in der Behandlung, die an die Variabilität der Erkrankung angepasst ist. Asthma ist gekennzeichnet durch die Präsenz von typischen Symptomen (Atemnot, Husten, pfeifendes Atemgeräusch, Brustenge), die plötzlich auftreten können, sowie einer variablen Atemwegsverengung (Obstruktion), die zeitweise auftreten kann (aber nicht muss) (Abb. 1).
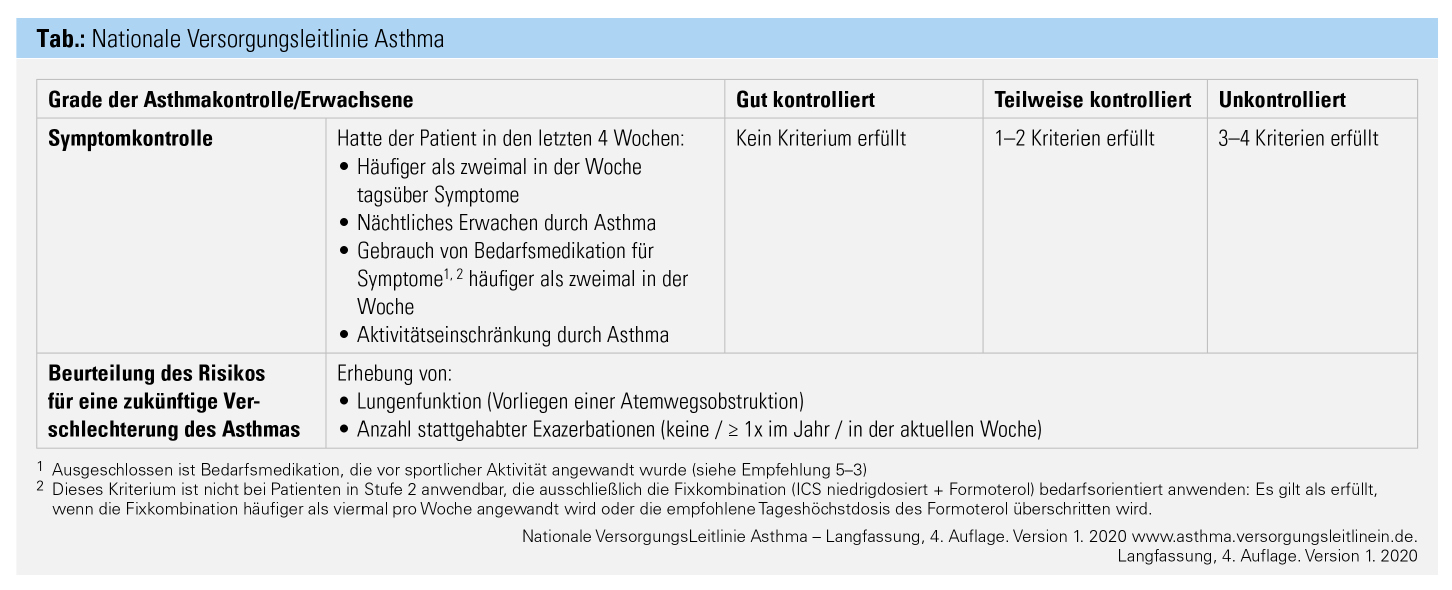
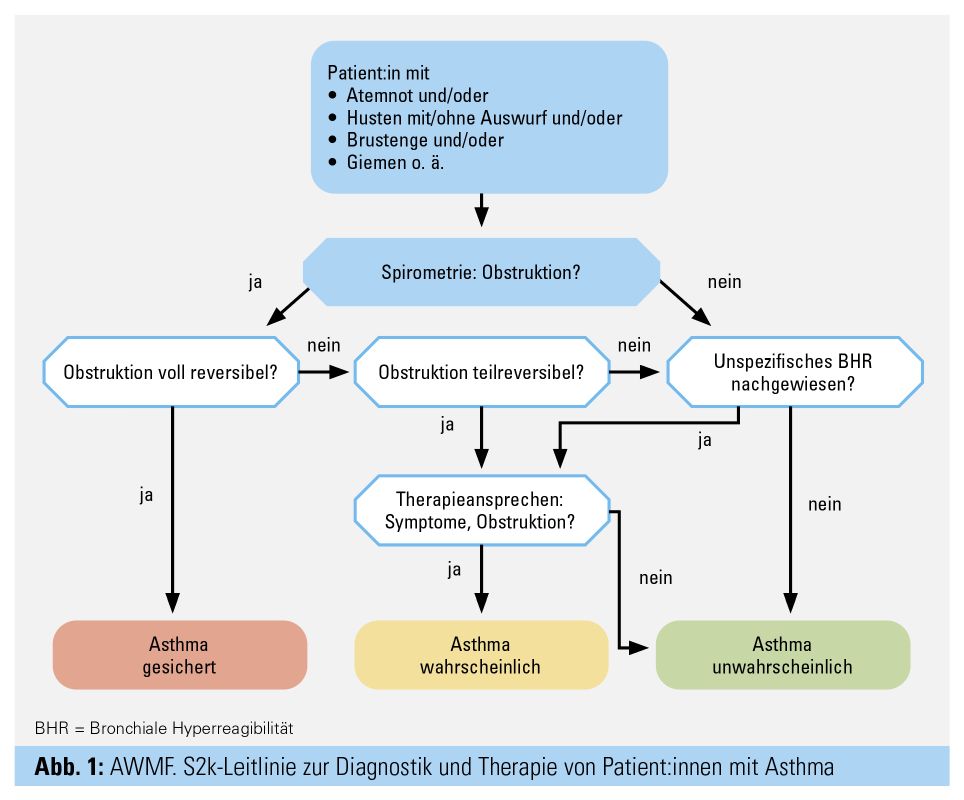 Zur sicheren Diagnose gehört daher die genaue Evaluierung der Symptome und der Lungenfunktion (Tab.). Der komplette Pathomechanismus der Entstehung bzw. Ausprägung von Asthma ist noch nicht vollständig geklärt, und mit zunehmendem Verständnis der einzelnen involvierten Pfade (Pathways) eröffnen sich jedoch auch neue gezielte Therapieoptionen.
Zur sicheren Diagnose gehört daher die genaue Evaluierung der Symptome und der Lungenfunktion (Tab.). Der komplette Pathomechanismus der Entstehung bzw. Ausprägung von Asthma ist noch nicht vollständig geklärt, und mit zunehmendem Verständnis der einzelnen involvierten Pfade (Pathways) eröffnen sich jedoch auch neue gezielte Therapieoptionen.
Typ-2-Inflammation: Etwa die Hälfte aller Patient:innen mit mildem bis moderatem Asthmaverlauf und ein deutlich höherer Anteil an Patient:innen mit schwerem Asthma weisen eine sogenannte Typ-2-Inflammation der Atemwege auf (Type-2-high).3 Zu diesem Typ gehören das allergische sowie das eosinophile Asthma. Klinisch finden sich hier eine erhöhte Anzahl an Eosinophilen im peripheren Blut (ggf. auch im Sputum), erhöhtes fraktioniertes exhaliertes Stickoxid (FeNO) sowie ein tendenziell besseres bzw. rascheres Ansprechen auf Glukokortikoide. Beim allergisch induzierten (und im weiteren Sinn auch beim eosinophilen) Asthma werden durch die von diversen Allergenen stimulierten Th2-Zellen zur Produktion von Zytokinen angeregt (v. a. IL-4, IL-5 und IL-13). IL-4 spielt in der Reifung von naiven CD4+-Zellen zu Th2-Lymphozyten eine große Rolle und stimuliert zudem die IgE-Freisetzung durch B-Zellen. Freies IgE führt an Mastzellen zu deren Degranulation und somit Freisetzung von Histamin und weiteren Mediatoren. IL-5 führt zur Proliferation und Freisetzung von Eosinophilen aus dem Knochenmark und hat einen positiven Einfluss auf deren Lebensdauer und Aktivität. Hierbei werden jedoch toxische Granula und Leukotriene freigesetzt, die wiederum gewebeschädigend sind und sich klinisch durch häufige Exazerbationen (akute Verschlechterungen) von Asthma äußern. IL-13 stimuliert ebenso die Differenzierung von B-Lymphozyten, induziert zudem auch Enzyme des respiratorischen Epithels, unter anderem die „induzierbare NO-Synthetase“, wodurch es zu einem lokalen Anstieg zytotoxischer Stickoxide kommt. NO ist in der Ausatemluft leicht messbar (FeNO) und stellt daher einen nicht unwesentlichen Baustein der Asthmadiagnostik dar. IL-4 und IL-13 stimulieren und erleichtern die Migration von Eosinophilen in die Atemwege, wo sie die Sekretproduktion und damit bronchiale Enge fördern.1 Dieses Wissen um die zugrunde liegenden Pathomechanismen führten dazu, dass bahnbrechende neue personalisierte Therapien, die sogenannten Biologika, für die Behandlung von schwerem Asthma entwickelt wurden und uns heute zur Verfügung stehen.
Unabhängig von dem zugrunde liegenden Pathomechanismus werden akute Asthmaanfälle durch bestimmte Umweltfaktoren „getriggert“. Aus diesem Grund hilft es, ein Asthmasymptomtagebuch zu führen, sodass der/die Patient:in diese auslösenden Faktoren identifizieren und eine aktive Reduktion/Vermeidung anstreben kann. Dies ist ein Bestandteil der GINA-Richtlinien. Die häufigsten Trigger-Faktoren sind: inhalative Allergene, Umweltbelastung, Stress, Kälte, Belastung, genetische Veranlagung, Staub, Rauchen und Medikamente.
Das Therapieziel ist Asthmakontrolle: Um die Therapie entsprechend dem Stufenkonzept richtig eskalieren bzw. deeskalieren zu können, wird die persönliche Symptomlast herangezogen (Tab.). Die Ziele umfassen dabei zunächst eine gute Symptomkontrolle, eine Verhinderung von Exazerbationen sowie gegebenenfalls eine Verbesserung/Normalisierung der Lungenfunktion, sofern diese eingeschränkt (= obstruktiv) ist. Um diese Ziele zu erreichen, stehen uns Substanzen zur Verfügung, die sowohl die chronische, zum größten Teil eosinophile, Entzündung reduzieren (Antiinflammation) als auch die Atemwege erweitern (Bronchodilatation). In den letzten Jahren gab es einen deutlichen Anstieg an verfügbaren antiinflammatorischen und bronchodilatorischen Wirkstoffen, die inhalativ als Mono-Substanz oder als Kombinationstherapie zur Verfügung stehen (Abb. 2).

Neues aus der Wissenschaft:
Asthma lässt sich nicht immer kontrollieren: Bevor jedoch die Diagnose schweres, nicht kontrolliertes/nicht kontrollierbares Asthma gestellt wird, ist es unbedingt notwendig, die häufigsten Ursachen einer mangelnden Asthmakontrolle auszuschließen. Diese umfassen falsche Diagnosen, eine unzureichende Therapie (medikamentös und nichtmedikamentös), patientenbezogene Faktoren (Therapieadhärenz) und/oder Komorbiditäten.
Schweres Asthma ist nicht gleichzusetzen mit schwierig zu behandelndem Asthma: Liegt trotz gesteigerter, leitliniengerechter Asthmatherapie keine ausreichende Symptomkontrolle vor (GINA-Stufe 4), müssen vor einer weiteren Therapieeskalation sowohl die zugrunde liegende Diagnose hinterfragt („Handelt es sich wirklich um Asthma?“) als auch patientenbezogene Aspekte berücksichtigt werden. Die beste Inhalationstherapie ist wirkungslos, wenn die Inhalationstechnik nicht korrekt ist; Komorbiditäten wie Adipositas oder Reflux reduzieren die Symptomkontrolle; eine persistente Allergenexposition (allen voran chron. Nikotinkonsum) triggern Exazerbationen. Auch auf mögliche Medikamentennebenwirkungen ist zu achten. Erst wenn all die genannten Punkte tatsächlich erfüllt sind und dennoch keine ausreichende Asthmakontrolle zu erzielen ist, darf die Diagnose „schweres Asthma“ gestellt und ein Step-up nach Eskalationsschema und entsprechender Phänotypisierung durchgeführt werden.
Stellenwert der Komorbiditäten: Da aufgrund seiner Pathomechanismen das Asthma nicht bloß eine isolierte Erkrankung der Atemwege darstellt, sondern oftmals nur ein Aspekt eines gestörten immunologischen Geschehens ist, gilt es hier auch auf entsprechende Komorbiditäten zu achten und im Rahmen der Anamnese auch gezielt danach zu fragen. Labormedizinische Befunde wie ein isoliert erhöhtes Serum-IgE sind zur sinnhaften Phänotypisierung nicht ausreichend. Allergisches Asthma ist mit (zumindest) einem, meist ganzjährig vorkommenden Allergen (wie z. B. Hausstaubmilbe) vergesellschaftet, häufig beschreiben die Patient:innen auch das Auftreten von Urtikaria. Das eosinophile Asthma tritt häufiger im Erwachsenenalter (Late-onset-Asthma) auf und verursacht häufiger schwerere, teils therapierefraktäre Verläufe. Häufige Begleiterkrankungen sind auf die (Hyper-)Eosinophilie zurückzuführen, wie z. B. die (mittel bis schwere) atopische Dermatitis und das hypereosinophile Syndrom. In seltenen Fällen kann eine eosinophile Granulomatose mit Polyangiitis (vormals Churg-Strauss-Syndrom) diagnostiziert werden, deren genaue Ätiologie bislang jedoch nicht gänzlich geklärt ist. Beide Formen gehen gehäuft mit einer chronischen Rhinosinusitis und Polyposis Nasi einher (CRSwNP), sodass bei entsprechendem Verdacht die Zusammenarbeit mit HNO-Fachärzt:innen wegweisend sein kann (eosinophile Histologie). Entsprechend der Konstellation an Symptomen kann eine entsprechende Biologikatherapie eingeleitet werden. Ein Blick in die Zukunft zeigt, dass diese personalisierten Therapeutika wahrscheinlich schon bereits zu einem früheren Krankheitszeitpunkt einen positiven Effekt auf den weiteren Erkrankungsverlauf haben könnten. Hier bedarf es jedoch noch guter randomisierter klinischer Studien in den nächsten Jahren.