Aktuelle chirurgische Herausforderungen
Kontext: Spätestens seit der Metaanalyse der adjuvanten Radiotherapie (Early Breast Cancer Trialist Collaborative Group; 2005) hat die Lokaltherapie-Forschung eine Renaissance erlebt. Durch die Senkung der Lokalrezidivrate um ca. 20% nach 5 Jahren Nachuntersuchungszeit verbessert sich das Überleben von Brustkrebspatientinnen um absolute 5% (@15 Jahre Follow-up). In anderen Worten: Durch die radiotherapeutische Behandlung eines lokalen minimal residual disease” wird pro 4 verhinderte Lokalrezidive ein Menschenleben gerettet. Dementsprechend gruppierten sich die diesjährigen chirurgischen St.-Gallen-Kontroversen um klinisch relevante Situation, in denen der Kliniker mit der Therapie von lokaler minimaler Tumorlast in Brust oder Axilla befasst ist.
Resektionsränder bei invasiven und intraduktalen Karzinomen
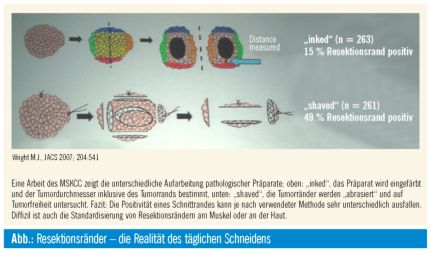
Wenn auch die genaue Millimeter-Anzahl der Resektionsränder (RR) von ChirurgInnen fast religiös zitiert und in der täglichen Arbeit berücksichtigt wird, so ist die Wahrheit der pathologischen Aufarbeitung, welche genau diese Abstände liefert, wenig standardisiert. Ein typisches Beispiel ist der randomi-sierte Vergleich zweier pathologischer Aufarbeitungsmethoden durch eine Gruppe am Memorial Sloane-Kettering Cancer Center (Wright et al 2007, Abb. 1). Beide Methoden finden zumindest in den USA weitreichende Anerkennung; dennoch findet sich beim Vergleich der positiven RR in den zwei Methodikgruppen ein eklatanter Unterschied: 15% vs. 49%. Es sei weiters hinzugefügt, dass es alleine durch die Transportdauer, Lagerung und Fixierung in Formalin bereits zu ganz wesentlichen zumindest quantitativen Unterschieden kommen kann. Und schließlich: Resektionsränder an der Haut oder basal an der Faszie können oft kleiner als ein Millimeter sein und werden kaum diskutiert. Daher stellt sich zu recht die Frage: Wie viele Millimeter Resektionsabstand sind genug?
Hat das Ausmaß des Resektionsrandes beim invasiven Karzinom einen Einfluss auf das Lokalrezidiv?
Eine Reihe von Publikationen sehr unterschiedlicher Qualität hat versucht, genau dieser Frage nachzugehen. Eine Übersicht findet sich in Tabelle 1. Alle Analysen sind retrospektiver Natur und häufig haben sich eher Radiotherapeuten und nur selten Chirurgen mit dieser Arbeit befasst. Zusammenfassend finden sich zwei Publikationen, in denen sich ein signifikanter Vorteil im Lokalrezidiv (LR) bei größerem Resektionsrand findet. Allerdings lässt sich bei beiden Arbeiten kein wesentlicher Unterschied zum positiven Resektionsrand herausarbeiten. Die Mehrzahl der Publikationen kann keine Unterscheidung machen zwischen kein Tumor am RR” und RR >Xmm”. Daraus kann gefolgert werden, dass ein knapper Resektionsrand per se sicher noch keine Indikation für eine Nachresektion darstellt.
|
Tab. 1: Die zentrale Frage ist: Does margin size matter?” |
|||||
|---|---|---|---|---|---|
|
Für eine Unterscheidung zwischen kein Tumor am RR” und einem RR > X mm” liegt keine schwerwiegende Evidenz vor. Einschränkend sind alle Studien retrospektiv, die Lokalrezidivrate unterscheidet sich aber je nach Resektionsrand nicht entscheidend. |
|||||
|
Autor |
n |
F/U |
% Lokalrezidiv |
||
|
neg. RR |
schmaler RR |
pos. RR |
|||
|
Park 2000 JCO |
533 |
8 Jahre |
7% |
7% |
27% |
|
Touboul 1999 Int. J. Rad. Onc. |
528 |
10 Jahre |
6% |
6% |
n. d. |
|
Freedman 1999 Int. J. Rad. Onc. |
1.262 |
10 Jahre |
7% |
14% |
12% |
|
Smitt 2003 Int. J. Rad. Onc. |
535 |
6 Jahre |
3% |
14% |
14% ( ≤ 2 bis 0) |
|
Obedian 2000 Cancer J. Sci Am. |
984 |
13 Jahre |
2% |
2% |
17% |
|
Pittinger 1994 Surgery |
183 |
> 3 Jahre |
3% |
3% |
n. d. |
|
RR = Resektionsrand; F/U = Follow-up |
|||||
Das bloße Festhalten am RR alleine stellt sicher eine eingeschränkte Sichtweise auf das lokale Risiko unserer Patientinnen dar. Aus zahlreichen prospektiven randomisierten Studien lässt sich oftmals parallel zu einer erfolgreichen Verbesserung des krankheitsfreien Überlebens auch eine Senkung des lokalen Risikos ablesen. Beispielhaft sei hier die moderne adjuvante Hormontherapie, aber auch die Trastuzumab-Therapie genannt. Weiters ergibt sich lokales Risiko auch aus der Biologie des Tumors und aufgrund der Tumorlast. Beweisführend sind hier v. a. die Aufarbeitung der Post-Mastektomie-Radiotherapie-Daten der DBCG (Danish Breast Cancer Group; Kyndi et al. 2008) und die bereits zitierte Radiotherapie-Metaanalyse (EBCTCG 2005).
Resektionsrand und intraduktales Karzinom
Im Gegensatz zu invasiven Wachstumsformen ist für das Carcinoma in situ deutlich häufiger ein diskontinuierliches Wachstum beschrieben. Damit könnte sich eine andere Anforderung an den Resektionsrand ergeben als dies beim invasiven Karzinom der Fall ist. Patientinnen mit DCIS erhalten (mit Ausnahme von Hormontherapie und Radiotherapie) keine adjuvante Therapie; auch daraus ergibt sich ein größerer Einfluss der Resektionsränder auf das lokale Risiko. Eine rezente Publikation von Dunne et al. (JCO 3/2009) kann hier anhand einer genauen Analyse von 4.660 Frauen mit DCIS nach Brusterhaltung und adjuvanter Radiotherapie etwas Klarheit schaffen. Dabei ergibt sich, dass ab einer Schwelle von 2 mm RR eine weitere Erhöhung des Abstandes zum nächsten intraduktalen Ausläufer keine weitere signifikante Senkung des Lokalrezidivs ergibt. Wiederum gilt, dass der Resektionsrand für sich alleine kein Kriterium sein sollte. Auch beim DCIS geben etwa die Differenzierung oder die Expression des Östrogenrezeptors Auskunft über die Biologie des Tumors.
Axilläre Dissektion bei niedrigem Risiko auf residuellen Tumor?
Im Rahmen des St. Gallen Konsensus wurde die Frage gestellt, ob alle Patientinnen mit klinisch negativer Axilla Kandidatinnen für eine Sentinel-Lymphknoten-Biopsie (SLB) seien. (Patientinnen nach neoadjuvanter Chemotherapie waren nach Auskunft des Panels von dieser Frage ausgenommen). Im Unterschied zu vielen anderen Kontroversen konnte das Panel mehrheitlich und auch bei sehr großen Tumoren oder bei multi-zentrischem Wachstum keine Kontraindikation gegen die SLB erkennen. Wesentlich umstrittener bleiben zwei weitere klinischrelevante Situationen:
1.) Ist die SLB nach präoperativer Chemotherapie (PC) eine sichere Methode?
2.) Kann auf die axilläre Dissektion verzichtet werden, in Situationen, in denen ein minimaler Befall des/eines Sentinel-Lymphknotens besteht?
Ad 1., Sicherheit der SLB nach präoperativer Chemotherapie: Tabelle 2 zeigt Daten zum Thema SLB mit und ohne präoperativer Chemotherapie aus einer prominenten Metaanalyse des M.D. Anderson Cancer Center, Houston und darunter eine Zusammenfassung von Daten aus Österreich. Dabei zeigt die Zusammenfassung der Kennzahlen ein sehr ähnliches Bild: Identifikationsraten (IR) nach präoperativer Chemotherapie sind etwas niedriger als ohne Chemotherapie. Die Sicherheit des Verfahrens ergibt sich jedoch in erster Linie aus der Sensitivität bzw. der falsch-negativen Rate (FNR) an SLB. Weder in den USA noch in Österreich lässt sich ein signifikanter Unterschied nachweisen. Die Sensitivität liegt durchwegs zwischen 89% und knapp 94% und ist nicht signifikant schlechter nach präoperativer Chemotherapie.
Eine eindeutige Empfehlung für die SLB nach PC ist dennoch, zumindest aus der Sicht des Autors, nicht auszusprechen. Die falsch-negativen Raten sind durchwegs über 5% und entsprechen damit sicher nicht dem Ideal der SLB, wie sie noch vor wenigen Jahren von zahlreichen Gruppen gefordert wurden. Es besteht zwar kein signifikanter Unterschied, aber die Datenlage insgesamt zeigt kein hohes Niveau. Dies erklärt sich auch aus der weiten Bandbreite an FNR je nach Studienzentrum. Hier finden sich zum Teil falsch-negative Raten nach präoperativer Chemotherapie in einer Größenordnung von über 15%. Dies ist wiederum nicht akzeptabel und zeigt damit auch, dass die Methode zumindest nicht konsistent in allen Bereichen funktioniert.
Ein Kompromiss (wenn auch nicht durch Evidenz belegt) könnte sich aus der genauen klinischen Beobachtung der Patientin vor und während der Chemotherapie ergeben. Patientinnen, welche bereits vor der Chemotherapie klinischnegative Lymphknoten haben und während der Chemotherapie ein gutes Ansprechen des Tumors zeigen, könnten auch jene Patientinnen sein, bei denen die Sentinel-Methode eine hohe Sicherheit hat.
|
Tab. 2: Sentinel-Lymphknoten-Biopsie (SLB) im Kontext neoadjuvanter Chemotherapie |
||||
|---|---|---|---|---|
|
Aus den Daten von Xing geht hervor, dass die Sentinel-Identifikationsrate nach neoadjuvanter Chemotherapie etwas geringer ist. Wichtig ist aber die Sensitivität, d. h. wie viele Sentinels falsch-negativ eingestuft werden (und dadurch u. U. die Patientin gefährden). Die falsch-negative Rate (FNR) war in den Daten von Xing mit 11% relativ hoch, nach österreichischen Daten mit 8% besser – wesentlich ist aber: Es gibt keinen Unterschied in Hinsicht auf die präoperative Chemotherapie. Dennoch scheint es, als wäre der Anspruch einer FNR von nicht mehr als 5% schwer zu erfüllen. |
||||
|
Studie |
IR* nach PC** |
IR ohne PC |
Sensitivität nach PC |
Sensitivität ohne PC |
|
Xing 2006 (Metaanalyse) |
85% (153/180) |
89% (1.198/1.346) |
89% (80/90) |
89% (338/379) |
|
Tausch 2008 Knauer 2006 |
85% (144/169) |
91,2% (2.934/3.216) |
92% (70/76) |
93,6% (218/233) |
|
* IR: Identifikationsrate, ** PC: präoperative Chemotherapie |
||||
Ad 2., minimaler Sentinelbefall -> Verzicht auf Axilla-Dissektion? Eine klinisch häufig auftretende Situation ist der mikrometastatische Befall eines Sentinel-Lymphknotens in der endgültigen pathologischen Aufarbeitung des Präparats. Dabei werden Mikrometastasen als Tumorzelldepots zwischen 0,2-2 mm Größe definiert und hinsichtlich des lokalen Risikos, v. a. aber hinsichtlich ihres Einflusses auf das Gesamtüberleben sehr kontroversiell diskutiert. Wie wahrscheinlich ist eine weitere Nicht-Sentinel-Lymphknoten-Metastase (NSLM, Non-Sentinel-Lymph-Node-Metastasis) überhaupt? Und: Können wir definieren, welche Patientinnen hier ein hohes Risiko haben? Erste Versuche, Untergruppen von Patientinnen mit sehr geringer Inzidenz eines NSLM zu definieren, sind gescheitert. Vor allem die Daten aus dem Mailänder Tumorzentrum belegen mehrfach, dass bei genauer Aufarbeitung des Dissektats keine Untergruppe mit einem Risiko unter 10% zu definieren ist. Auch Patientinnen mit kleinen Tumoren können in hohem Maße eine Nicht-Sentinel-Lymphknoten-Metastase haben. Aus dem gleichen Zentrum stammen auch Daten, welche das erhöhte lokale Risiko bei Patientinnen mit Mikrometastasen im Sentinel-Lymphknoten (aber ohne axilläre Dissektion) belegen. Während eine Reihe randomisierter Studien die Frage der Mikrometastasen zumindest zum Teil aufarbeiten wird, sollte doch zumindest der Versuch einer klinischen Empfehlung ausgesprochen werden:
- Wie wahrscheinlich ist der Befall eines NSLM? Hierbei können recht gut validierte Online-Rechner zumindest einen objektiven Näherungswert geben. Ein gutes Beispiel ist das MSKCC-Nomogramm (www. mskcc.org/mskcc/html/ 15938.cfm).
- Welche adjuvante Therapie erhält die Patientin ohnehin? Welche therapeutische Konsequenz würde sich aus dem Befall eines weiteren Lymphknotens ergeben?
- Welche konkurrierenden Risiken ergeben sich?
Nach einer konsequenten Beantwortung dieser Fragen kann schon eine Untergruppe definiert werden, welche mit geringer Wahrscheinlichkeit von einer axillären Dissektion profitiert. Häufig werden dies ältere oder multimorbide Patientinnen sein. Schlussendlich sollte jedoch darauf hingewiesen werden, dass die axilläre Dissektion ein gut standardisierter Eingriff mit geringer Morbidität ist.
FazitModerne Lokaltherapie-Forschung hat das Potenzial, das Gesamtüberleben unserer Patientinnen in ebenso hohem Maße zu verbessern, wie es für die moderne adjuvante Therapie bereits gut belegt ist. Die Zielsetzung muss darin bestehen, jene Tumorlast abzuschätzen, die einen Organerhalt zulässt, ohne die Patientin zu gefährden. Dabei gilt es, die modernen bildgebenden Verfahren, die pathologische Aufarbeitung, die Onkoplastik und den Routineeinsatz der adjuvanten Therapie zu berücksichtigen. |
Priv.-Doz. Dr. Peter Dubsky
Klinische Abteilung für Allgemeinchirurgie, Universitätsklinik für Chirurgie, Wien