Dermato-Onkologie: Aktuelle Studien zur Melanomtherapie in Österreich
Kinaseinhibitoren bei metastasiertem Melanom
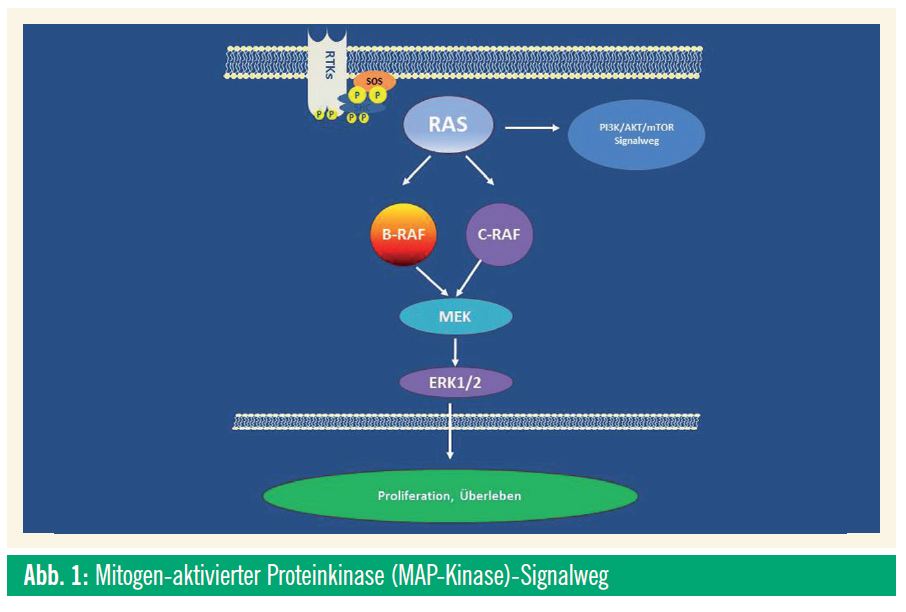
Die derzeit in Studien verfügbaren Kinaseinhibitoren zielen alle auf den so genannten Mitogen-aktivierten Proteinkinase (MAP-Kinase)-Signalweg ab (Abb. 1). Bei etwa 50% der Melanome, die an intermittierend sonnenbestrahlter Haut auftreten, liegt in diesem Signalweg eine aktivierende Mutation der B-Raf-Kinase vor. Beide hier ansetzenden Studien werden für Patienten angeboten, bei denen eine derartige Mutation vorliegt, da bei diesen Patienten ein Nutzen einer solchen Therapie zu erwarten ist.
RO5185426 (Vemurafinib)
Vemurafenib (vormals bekannt als PLX4032) ist ein oral verabreichter Kinaseinhibitor, der eine relative Selektivität für das mutierte B-Raf (B-Raf V600E)-Protein aufweist. Die Zulassungsstudie (BRIM III) wurde am heurigen ASCO-Meeting präsentiert und hat eine Verbesserung im Gesamtüberleben der Patienten unter Vemurafenib im Vergleich zu Dacarbazin gezeigt.
Bis zum Zeitpunkt der Zulassung wird die Substanz nun in einer Phase-IIIb-Studie für Melanompatienten mit B-Raf V600EMutation, die zumindest eine erfolglose Systemtherapie erhalten haben, zur Verfügung gestellt (MO25515 – multizentrische, offene Phase-IIIb-(Expanded-Access-) Studie von RO5185426 bei Patienten mit metastasiertem Melanom). Die Ansprechrate in der vorangegangenen BRIM-II-Studie, in die 132 ebenfalls vorbehandelte Patienten eingeschlossen wurden, lag bei 52%. Weitere 30% der Patienten erreichten eine Stabilisierung ihrer Erkrankung. Das Ansprechen auf die Therapie findet oft sehr rasch statt, die mittlere Dauer des Ansprechens liegt nach bisherigen Daten bei 6,8 Monaten. Aktivität wurde auch bei Patienten mit zerebralen Metastasen beobachtet, wobei in die Studie nur asymptomatische, radiologisch stabile Patienten mit zerebralen Metastasen eingeschlossen werden können.
Wesentliche Nebenwirkungen sind Arthralgien, Hautausschläge, Erschöpfung, Effluvium, Photosensitivität sowie das Auftreten von Plattenepithelkarzinomen (Keratoakanthom-ähnlich) bzw. verrukösen Hyperplasien der Haut. Letztere traten typischerweise innerhalb der ersten zwei Monate nach Therapiebeginn auf und wurden meist in lokaler Betäubung reseziert.
GSK1120212
Vor wenigen Wochen abgeschlossen wurde die Rekrutierungsphase einer Studie mit GSK1120212, einem oral verabreichten Kinaseinhibitor, der eine relative Spezifität für die MEK-Kinase aufweist. MEK liegt unterhalb von B-Raf im MAP-Kinase-Signalweg (Abb. 1) und ist in der Weiterleitung des aktivierenden Signals von mutiertem B-Raf von großer Bedeutung. In frühen Studien hat dieses Medikament Ansprechraten von um die 40% bei Patienten mit aktivierenden B-Raf-Mutationen gezeigt. Da die MEK-Kinase auch eine wichtige Schaltstelle bei Tumorzellen nach Resistenz gegen B-Raf-Inhibitoren ist, wird spekuliert, dass MEK-Inhibitoren möglicherweise ein längeres Ansprechen als B-Raf-Inhibitoren zeigen könnten. Definitive Daten hierzu liegen derzeit jedoch noch nicht vor.
In dieses Studienprotokoll (MEK114267 – randomisierte Phase-III-Studie zum Vergleich von GSK1120212 und Chemotherapie bei Patienten mit fortgeschrittenem oder metastasiertem B-Raf V600E/K-mutiertem Melanom) wurden Patienten mit nicht-operablem Stadium- III- oder Stadium-IV-Melanom eingeschlossen, die bislang keine oder maximal eine Therapie in der metastasierten Erkrankungssituation erhalten haben. Nach Austestung bezüglich der B-Raf-Mutation erfolgte die Randomisierung 2:1 zwischen GSK1120212 und Chemotherapie (Dacarbazin oder Paclitaxel). Patienten, die im Chemotherapie-Arm progredient werden, können in den MEK-Inhibitor-Arm der Studie wechseln. Zu den wichtigsten Nebenwirkungen dieses Medikaments zählen Hautausschläge (vergleichbar zu EGF-Rezeptor-Inhibitoren), Durchfall, Erschöpfung, Übelkeit, Inappetenz und periphere Ödeme. Nur wenige dieser Nebenwirkungen waren stark ausgeprägt. Eine relativ seltene, aber besondere Nebenwirkung sind Sehstörungen durch eine seröse Retinopathie bzw. eine bislang nur in einem Fall berichtete Retinavenenthrombose.
Antikörper bei metastasiertem Melanom
Ipilimumab
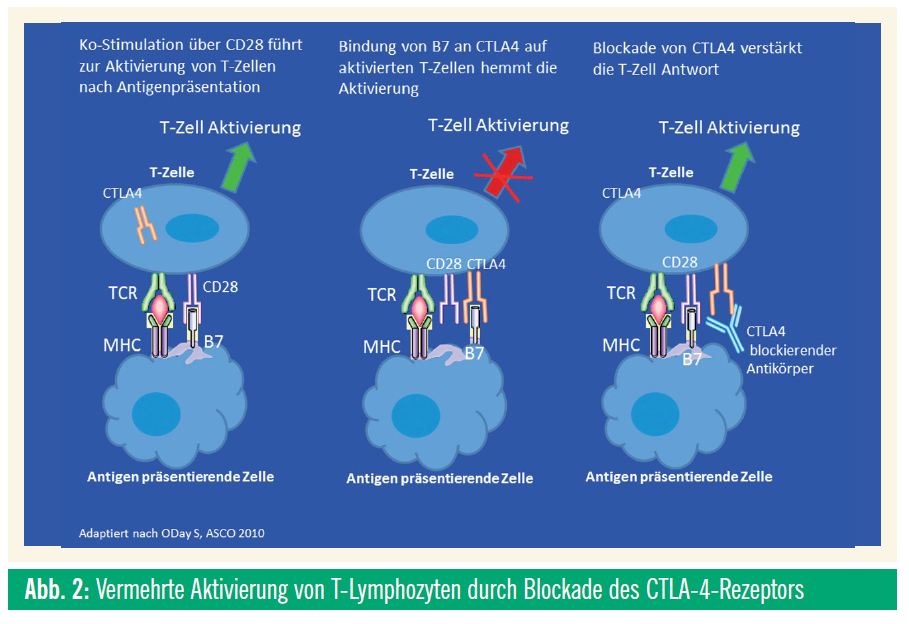
Ebenfalls für Patienten mit metastasiertem Melanom steht der T-Zell-aktivierende Antikörper Ipilimumab zur Verfügung. Es handelt sich hier zwar um keine Studie, sondern um ein patientenbezogenes “Compassionate-use Program”, dieses wird jedoch anhand eines klar definierten Protokolls durchgeführt und sollte deshalb ebenfalls hier erwähnt werden. Zusätzlich wird Ipilimumab auch als adjuvante Therapie im Stadium II im Rahmen einer Studie erprobt (siehe unten). Ipilimumab ist ein Antikörper, der die Bindungsstelle des CTLA-4-Rezeptors blockiert. Der CTLA-4-Rezeptor hat eine hemmende Wirkung auf die T-Zell-Aktivierung durch Antigen-präsentierende Zellen. Die Blockade dieses Rezeptors führt zu einer vermehrten Aktivierung von T-Lymphozyten und kann eine gegen den Tumor gerichtete Entzündungsreaktion auslösen (Abb. 2). Bei vorbehandelten Patienten konnte ein verlängertes Gesamtüberleben im Vergleich zu einer Kontrolltherapie mit einer gp-100-Vakzine beobachtet werden. Knapp 30% der behandelten Patienten profitierten von der Therapie, wobei die Mehrheit (ca. 17%) dieser Patienten nur eine Stabilisierung der Erkrankung zeigte und keinen klassischen Response. Das Ansprechen war jedoch im Schnitt über viele Monate bis sogar Jahre anhaltend, was einen wesentlichen Unterschied zu den Kinaseinhibitoren darstellt. Eine weitere Besonderheit, ist, dass das Ansprechen auf Ipilimumab im Vergleich zu zytotoxischen Substanzen oder Kinaseinhibitoren langsamer auftritt und es anfangs sogar zu einer Verschlechterung der Erkrankung kommen kann, ehe die Wirkung der Therapie einsetzt. Der Überlebensvorteil konnte auch in einer am ASCO vorgestellten Studie, in der eine Kombination von Ipilimumab mit Dacarbazin gegen eine Monotherapie mit Dacarbazin verglichen wurde, bestätigt werden.
Ipilimumab wurde vor Kurzem in den USA unter dem Handelsnamen Yervoy® zur Therapie von Melanompatienten zugelassen. Auch seitens der EMA liegt bereits ein positives Statement zur Anwendung von Ipilimumab vor. Bis zur Zulassung steht Ipilimumab Patienten, die mit Standard-Therapeutika nicht erfolgreich behandelt werden konnten und nicht in ein Studienprotokoll eingeschlossen werden können, im Rahmen des oben erwähnten Programmes zur Verfügung. Ipilimumab wird intravenös viermal im Abstand von drei Wochen verabreicht.
Die wesentlichen Nebenwirkungen von Ipilimumab bestehen in teils schweren, T-Zell-vermittelten Entzündungsreaktionen, die in praktisch sämtlichen Organsystemen auftreten können. Die häufigsten Symptome sind eine immunmediierte Enterokolitis, Hepatitis, Dermatitis, Neuropathie und Endokrinopathien. Diese Symptome treten meist während der Therapiephase auf, in Einzelfällen aber auch erst Wochen nach der Therapie. Zur Therapie werden orale Steroide bzw. andere immunsuppressive Therapeutika eingesetzt.
Adjuvante Therapien
Im Bereich der adjuvanten Therapie werden zwei immuntherapeutische Strategien bei Patienten im Stadium III auf ihre Wirksamkeit getestet. Beide Therapien vergleichen gegen einen Placebo-Arm und nicht gegen Interferon. Die Begründung dafür ist der im Gegensatz zum klaren Einfluss auf das erkrankungsfreie Überleben nur geringe bis fragliche Effekt der Interferontherapie auf das Gesamtüberleben.
Ipilimumab adjuvant
Eine dieser Strategien ist die Anwendung des bereits erwähnten Antikörpers Ipilimumab, wobei auch hier die Rekrutierungsphase der Studie vor Kurzem abgeschlossen wurde (BMS CA 184029/EORTC 18071 – adjuvante Immuntherapie mit einem Antikörper gegen CTLA-4 (Ipilimumab). Die Behandlung erfolgt im Vergleich zu Placebo nach komp letter Resektion bei Hochrisiko-Stadium-III-Patienten. In dieses Studienprotokoll wurden tumorfreie Patienten nach kompletter Lymphadenektomie aufgrund von Lymphknotenmetastasen eines kutanen Melanoms eingeschlossen. Voraussetzung war dabei mindestens eine Lymphknotenmetastase von > 1 mm. Es erfolgt der Vergleich einer Therapie mit Ipilimumab 10 mg/kg KG (4 Infusionen alle 3 Wochen, danach eine Infusion alle 3 Monate bis zu 3 Jahren) gegen Placebo. Die Nebenwirkungen unterscheiden sich nach bisherigen Erfahrungen nicht von jenen, die bei Patienten mit metastasiertem Melanom beobachtet wurden.
Vakzine gegen Tumorantigen MAGE-A3
Die zweite in diesem Bereich angebotene Studienmedikation ist eine Vakzine, die gegen das Tumorantigen MAGE-A3 immunisiert (DERMA Trial – doppelblinde, placebokontrollierte Phase-III-Studie zur Wirksamkeit von recMAGE-A3 + AS15 ASCI als adjuvante Therapie bei Patienten mit MAGE-A3-positivem resezierten Stadium-III-Melanom). MAGE-A3 ist ein in Tumoren reaktiviertes Oberflächenantigen, das bei gesunden Personen im Bereich der Spermatozoen und der Plazenta exprimiert wird. Etwa 65 % der Melanome exprimieren MAGEA3. AS15 ist ein Adjuvans, das in vorangehenden Studien mit einem verstärkten Ansprechen auf eine MAGE-A3-Vakzine bei Patienten mit metastasiertem Melanom assoziiert war.
Eingeschlossen werden Patienten mit makroskopischen Lymphknotenmetastasen nach radikaler Lymphadenektomie. Die Vakzinierungen werden subkutan über 30 Monate verabreicht. Die Verträglichkeit der MAGE-A3-Vakzinierung in vorangegangenen Studien wurde als sehr gut eingestuft. Die wichtigsten, meist nur sehr mild ausgeprägten Nebenwirkungen waren Lokalreaktionen an der Injektionsstelle, Myalgien und Erschöpfung. Sollte sich diese Vakzine als wirksam erweisen, wird das sehr gute Nebenwirkungsprofil sicher ein maßgebliches Argument in der Therapieentscheidung darstellen.
Zukünftige Studienprotokolle
B-Raf-Inhibitoren + Ipilimumab: Der Fokus liegt hier auf möglichen Kombinationen der derzeit vielversprechendsten Substanzen. So wird einerseits überlegt, das rasche und hohe Ansprechen auf BRaf-Inhibitoren mit verzögert, aber länger wirksamen Therapien wie Ipilimumab zu kombinieren. Dafür spricht auch, dass der aktivierte MAP-Kinase-Signalweg Einfluss auf das Entkommen des Tumors gegenüber der Immunantwort hat. Eine Hemmung dieser Mechanismen in Kombination mit einer immunaktivierenden Therapie sollte also eine synergistische Wirkung zeigen.
B-Raf-Inhibitoren + MEK-Inhibitoren: Auf der anderen Seite wurde bereits begonnen, die Kombination aus B-Raf-Inhibitoren und MEK-Inhibitoren zu erproben. Die Rationale liegt hier in einer verstärkten Blockade des MAP-Kinase-Signalweges und einem geringeren Auftreten von resistenten Tumorzellen in präklinischen Modellen. Diese Studien könnten die bisher erreichten Erfolge weiter verbessern. Gleichzeitig wird man der Verträglichkeit solcher Kombinationstherapien besondere Aufmerksamkeit widmen müssen, wobei nicht in jedem Fall von einer Verschlechterung ausgegangen werden muss. Daten aus einer am ASCO präsentierten Phase-I-Studie zeigen, dass eine Nebenwirkung der B-Raf Inhibitoren, nämlich das Auftreten von Plattenepithelkarzinome der Haut, in der Kombinationstherapie deutlich seltener ist.