Papilläre und retikuläre Fibroblasten in humaner Haut: Fibroblastenidentität sowie Lokalisationin der Dermis bestimmen die Funktion
Autorinnen: Ana Korosec, Sophie Frech, Beate M. Lichtenberger.
Morphologisch kann die Dermis der humanen Haut in zwei Bereiche unterteilt werden: in die obere oder papilläre Dermis mit hoher Zelldichte und relativ losem Bindegewebe und in die retikuläre Dermis in den tieferen Schichten, welche eine geringe Zelldichte aufweist, aber vollgepackt mit Kollagenen und Bindegewebsproteinen ist und in die Hypodermis mündet.1 Der zelluläre Hauptbestandteil sind Fibroblasten, welche ursprünglich als ein relativ unspektakulärer, matrixproduzierender Zelltyp angesehen wurde. Fibroblasten sind in letzter Zeit allerdings ins Rampenlicht der Forschung gerückt, da sie eigentlich sehr dynamische Zellen sind und offenbar eine große Rolle im Alterungsprozess und in vielen anderen Pathologien wie beispielsweise Krebs spielen.2, 3
Subpopulationen von Fibroblasten
In-vivo-Lineage-Tracing-Experimente haben gezeigt, dass in der Maushaut die Dermis aus zwei Abstammungslinien von Fibroblasten aufgebaut ist, welche unterschiedliche Funktionen in der Entwicklung der Haut und ihrer Anhänge wie auch in der Wundheilung und Fibrose haben4–6 und auf unterschiedliche Signale neoplastischer epidermaler Stammzellen reagieren.7 Eine Linie bilden die sogenannten papillären Fibroblasten, welche auch die Zellen der dermalen Papilla, des dermalen Sheaths und des Arrector-Pili-Muskels beinhalten und essenziell für die Entstehung von Haarfollikeln sind. Die zweite Linie bildet die untere Dermis mit den retikulären Fibroblasten, die einen Großteil der extrazellulären Matrix bilden, sowie den Präadipozyten und Adipozyten der Hypodermis.4
Es gibt zahlreiche Hinweise darauf, dass auch humane Haut mindestens zwei Subpopulationen von Fibroblasten mit unterschiedlicher Morphologie und Funktion hat.8–11 Diese reichen von unterschiedlichen Proliferationsraten bis hin zur Fähigkeit, das Gewebe zu modulieren, und der Expression von Matrixgenen, Enzymen und Zytokinen12–14 sowie zum Vermögen, das Wachstum epidermaler Stammzellen in 2D- und 3D-Kulturen zu unterstützen.15, 16
Fibroblasten-Subsetsisolieren via FACS
Aufgrund des Fehlens geeigneter Zelloberflächenmarker zur Diskriminierung von papillären und retikulären Fibroblasten für humane Haut, wurden diese Daten allerdings nur durch Fibroblasten-„explant cultures“ von dermatomierten superfiziellen bzw. unteren dermalen Schichten isoliert, was zu gemischten Zellpopulationen führte, welche eventuell in Einzelzellklone subkultiviert wurden. Allerdings verändern sowohl murine als auch humane Fibroblasten in vitro umgehend die Genexpression17–19, weshalb die Marker, die der einen oder anderen Subpopulation zugeschrieben wurden, nicht für die Isolation von Fibroblasten aus der Haut verwendet werden können.
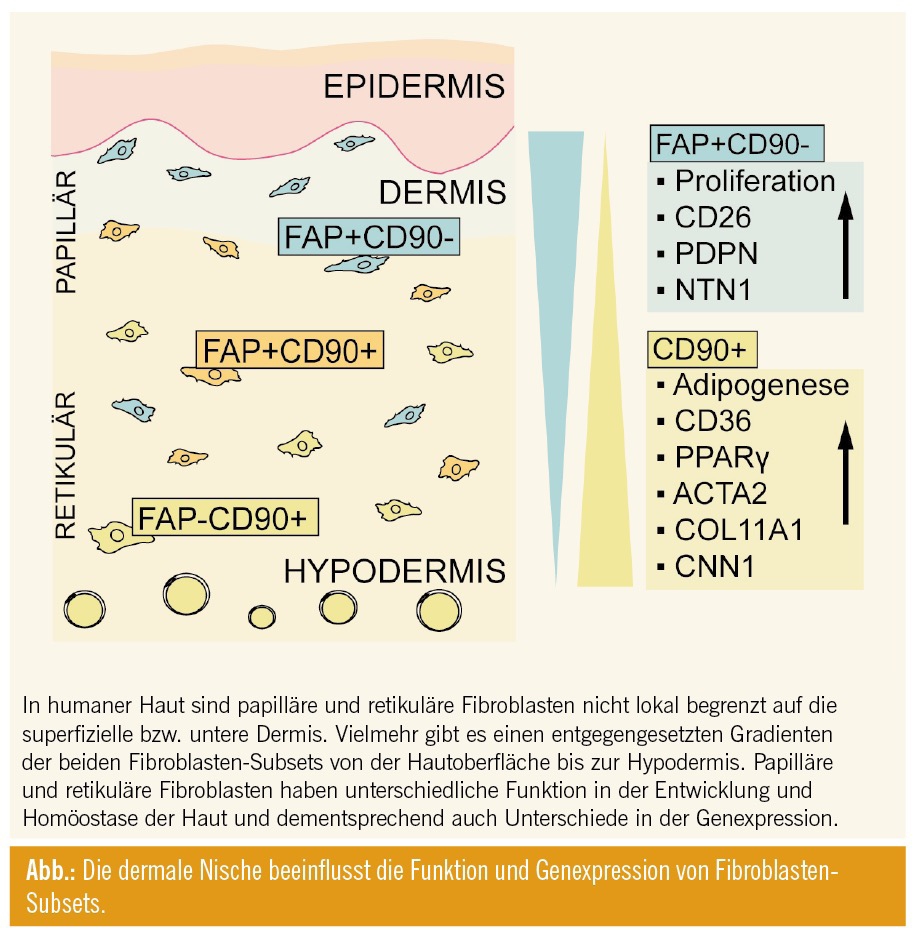
Im Rahmen der hier beschriebenen Arbeit20 konnten spezifische Oberflächenmarker (Fibroblast-activating Protein, FAP, und Thymocyte-Antigen 1, Thy-1/CD90) identifiziert und ein Protokoll zur Isolierung von papillären bzw. retikulären Fibroblasten via fluoreszenzaktivierte Durchflusszytometrie (FACS) etabliert werden. Diese neue Methode erlaubt es, die funktionelle Heterogenität unterschiedlicher Fibroblasten-Subsets in Hautpathologien zu untersuchen. Außerdem stellt sie eine enorme Weiterentwicklung für die Hautforschung dar, da sich herausstellte, dass die beiden Fibroblasten-Subsets nicht lokal auf die obere bzw. untere Dermis beschränkt sind, sondern ein entgegengesetzter Gradient von papillären und retikulären Fibroblasten von der Hautoberfläche zur Hypodermis besteht (Abb.).
Die Arbeitsgruppe von Beate M. Lichtenberger in der Skin & Endothelium Research Division an der Universitätsklinik für Dermatologie, Medizinische Universität Wien, beschäftigt sich damit, wie unterschiedliche dermale Fibroblastensubpopulationen mit Krebszellen interagieren und das Hauttumorwachstum fördern, um neue personalisierte Therapien für Krebspatienten zu finden. Außerdem untersucht ihr Team die Rolle von Fibroblasten in der Wundheilung und in Hautpathologien, die von Fibroblasten verursacht werden, wie beispielsweise Skleroderma oder Keloide, für die es bislang keine effektiven Therapieansätze gibt.