Das atopische Ekzem
Das atopische Ekzem (AE), für das als Synonyme Neurodermitis und, insbesondere im deutschsprachigen Raum, atopische Dermatitis gebräuchlich sind, ist eine chronisch rezidivierende, entzündliche Hauterkrankung, die zusammen mit der allergischen Rhinitis und dem Asthma bronchiale zum Formenkreis der atopischen Erkrankungen zählt.
Klinisch zeigt sich eine gerötete, schuppende, sehr trockene und juckende Haut. Die betroffenen Personen leiden sehr unter dieser Erkrankung und haben oft eine erheblich beeinträchtigte Lebensqualität. Die Ursache des AE ist noch nicht völlig geklärt. Ein Zusammenspiel aus genetischen Faktoren, Umwelteinflüssen und immunologischen Veränderungen wird bei der Entstehung dieser Erkrankung als wichtig erachtet.
Epidemiologie
In der westlichen Welt leiden bis zu 20 Prozent der Kinder an dieser schubhaft verlaufenden Krankheit. Bei vielen kommt es aber mit zunehmendem Alter zu einer dauerhaften Remission. Statistiken belegen, dass etwa 40 Prozent der an AE leidenden Kinder die Erkrankung mit zunehmendem Alter überwinden, während andere sie ihr ganzes Leben behalten. Bei den Erwachsenen sind drei bis fünf Prozent betroffen. Ein Beginn im Erwachsenenalter ist selten (Late Onset Atopic Dermatitis).
Atopie und atopischer Marsch
Ein wesentlicher Punkt ist, dass das AE häufig mit Typ-I-Allergien wie allergische Rhinokonjunktivitis und allergisches Asthma vergesellschaftet ist. Diese Konstellation wird als Atopie beschrieben. Darunter versteht man eine genetisch bedingte Neigung, Typ-I-Überempfindlichkeitsreaktionen zu entwickeln. So bilden sich bei 70-90% aller AE-Patienten spezifische IgE-Antikörper gegen an und für sich harmlose Umweltallergene. Untersuchungen haben gezeigt, dass Kinder mit AE ein erhöhtes Risiko haben, später im Leben respiratorische Allergien (allergische Rhinokonjunktivitis und allergisches Asthma) zu entwickeln. Diese Entwicklung wird als “atopischer Marsch” bezeichnet. Es ist daher wichtig, die Eltern von Kindern mit AE über diesen Zusammenhang aufzuklären, so dass diese auf erste Anzeichen einer allergischen Rhinoconjunctivitis und Asthma achten.
Klinik und Diagnose
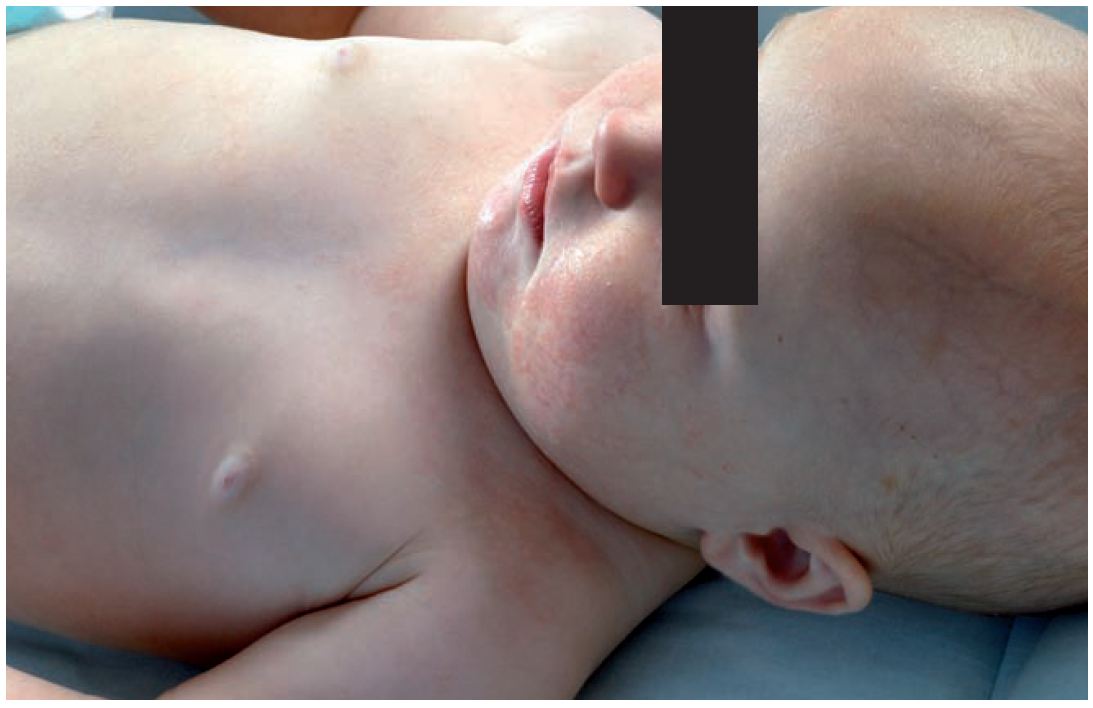
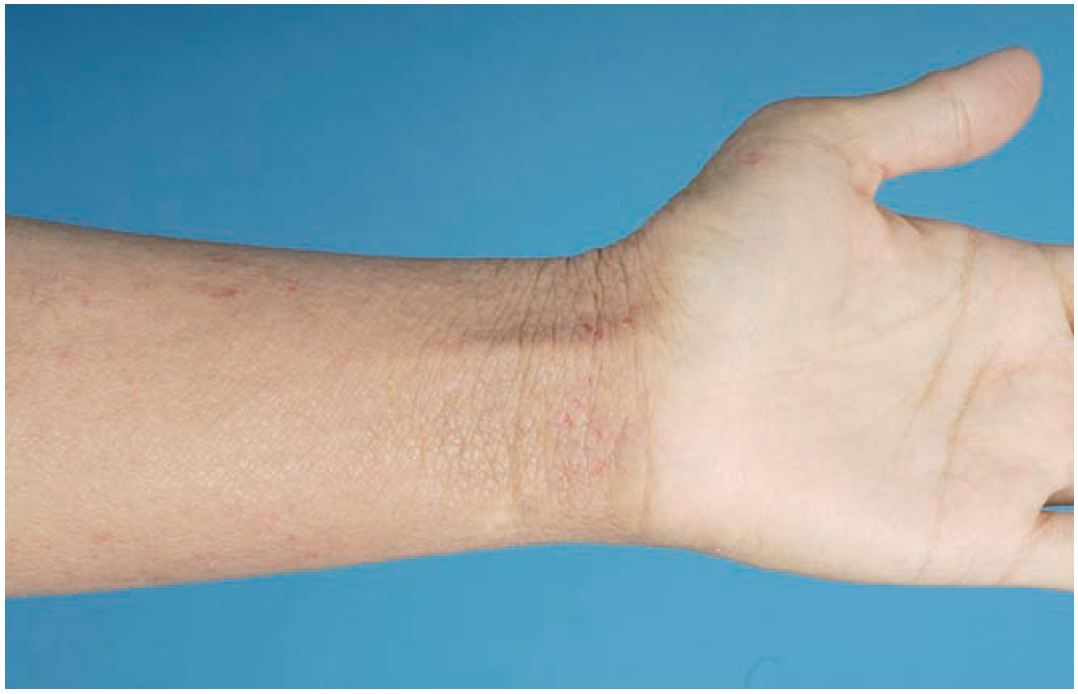
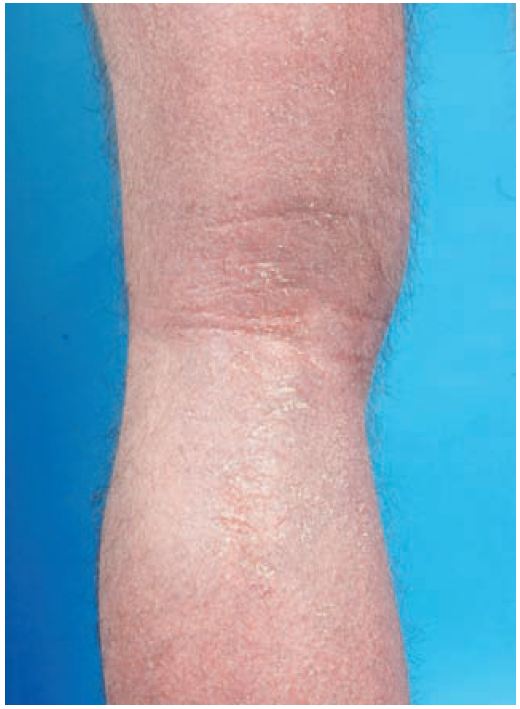
Das klinische Erscheinungsbild des AE ist altersspezifisch. Während der ersten Lebensmonate kann sich eine gelbe Schuppenkruste am Capillitium bilden (Milchschorf). Die Erkrankung kann sich dann im Kleinkindesalter auf Gesicht und Streckseiten der Extremitäten ausbreiten. Danach entwickelt sich das typische Beugenekzem. Häufig findet man als Folge von Juckreiz und Kratzen eine Lichenifikation der Haut.
Die Diagnosestellung des AE erfolgt klinisch. Als Hilfestellung wurden von Hanifin und Rajka exakte diagnostische Kriterien entwickelt. Demzufolge sind 3 der 4 Hauptkriterien nötig: Juckreiz, typische Morphologie und Verteilung der Hautläsionen, chronisch oder chronisch rezidivierender Verlauf und positive Eigenoder Familienanamnese für atopische Erkrankungen, zusätzlich zu mindestens 3 von 21 Minor-Kriterien.
Juckreiz und Neigung zu Infektionen
Zu den wesentlichen Merkmalen des AE zählt der quälende Juckreiz, der durch eine niedrige Juckreiz-Schwelle erklärt wird. Umweltallergene wie Hausstaubmilben und irritierende Substanzen verschlimmern den “Itch-Scratch-Circle” (Juck-Kratz-Zirkel). Am Ende steht die aufgeriebene, bisweilen blutig aufgekratzte Haut. Dort siedeln sich Bakterien, Viren und Pilze an, führen zu Infektionen, die wiederum das Immunsystem massiv stimulieren und zu einem Schub führen können.
Barrieredefekt und genetische Prädisposition
Ganz typisch für die Erkrankung ist die trockene Haut. Grundlage der Symptomatik ist eine geschwächte Barriere-Funktion der Epidermis. Die Ursache des Barrieredefekts liegt einerseits bei einem Mangel an Stratum- corneum-Lipiden wie Ceramid und Lipiden und andererseits an einem genetisch bedingtem Funktionsverlust von Filaggrin, einem Strukturprotein des Stratum corneum. Die Patienten leiden an einem Permeabilitätsbarrieredefekt. Die Feuchtigkeit kann nicht in der Haut gehalten werden, sodass diese austrocknet. Der Barrieredefekt begünstigt ein perkutanes Eindringen von Umweltallergenen und pathogenen Keime und in der Folge die Entwicklung von allergischen Reaktionen und Infektionen.
Darüber hinaus bestehen bei Patienten mit AE ein Defekt der antimikrobiellen Barriere und eine erhöhte Infektionsanfälligkeit für Staph. aureus, Herpes simplex und Malassezia. Ein wichtiger Aspekt hierbei sind Studien, die eine Verminderung an natürlich in der Haut vorkommenden antimikrobiellen Peptiden (z. B. β-Defensin und Cathelicidin) bei Patienten mit AE im Vergleich zu gesunden Personen aufzeigen.
Schon lange ist bekannt, dass das AE auf dem Boden einer genetischen Prädisposition entsteht. Zwei Drittel der Patienten weisen eine familiäre Vorgeschichte auf. Darüber hinaus zeigen Zwillingsstudien eine Konkordanz von 80% bei homozygoten und 30% bei dizygoten Zwillingen. Ein polygener Vererbungsmodus wurde vorgeschlagen. Genetische Studien zeigten den Einfluss von multiplen Mediatoren der atopischen Entzündung auf. Bis dato sind die “Loss-of-Function-Mutationen” des Filaggrin-Gens der bedeutendste genetische Defekt. Diese finden sich bei 18-47% aller getesteten europäischen Patienten mit AE und sind somit der wichtigste genetische Risikofaktor für die Entwicklung eines AE.
Therapie
Patienteninformation und Aufklärung
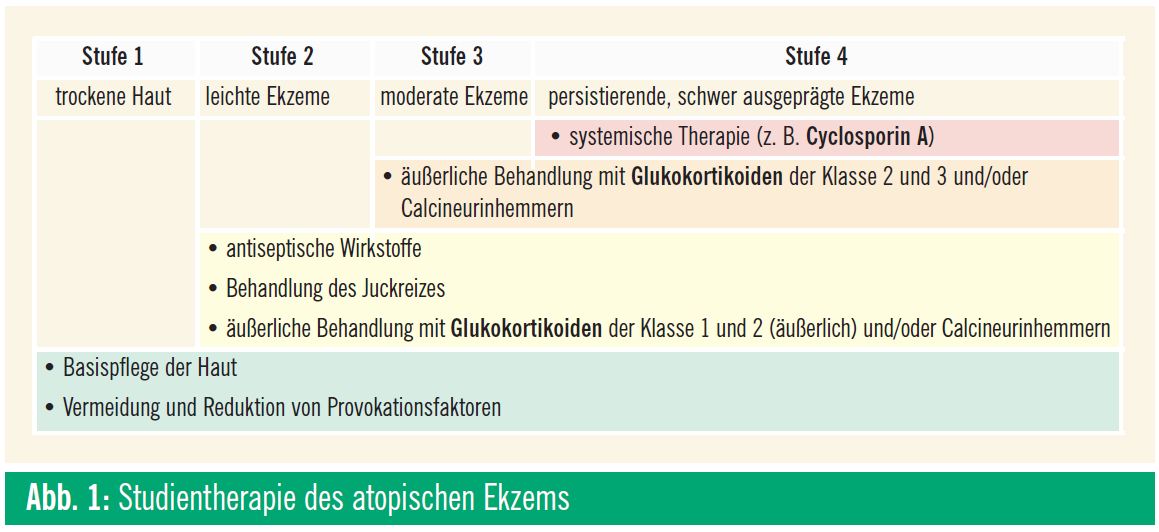
Die Aufklärung der Patienten ist eine wichtige Säule in der Patientenführung und ermöglicht den Aufbau von Vertrauen zwischen Arzt, Patient und Familie. Den Patienten sollte eine strukturierte Neurodermitisschulung angeboten werden, die folgende Punkte umfasst: genetische Disposition, Behandlung der Trockenheit der Haut, Vermeidung von Triggerfaktoren, Vermeidung von Schwitzen, Maßnahmen gegen Innenraumallergien, Reduktion der Pollenexposition, Information zur Wirkung von Sonne, Vermeidung von bakteriell kontaminierten Umweltgegenständen, Vermeidung von Kontakt mit Menschen mit aktivem Herpes simplex, Information zu Vakzinierungen und Information zur Ernährung. Die Therapie des AE richtet sich nach der Schwere der Symptome und wird individuell angepasst. Als Anhaltspunkt dient ein Stufenschema (Abb. 1).
Basispflege
Ein besseres molekulares und biochemisches Verständnis der Faktoren, die der “trockenen Haut und der Allergieneigung” zugrunde liegen, wird zukünftig zu einer Verbesserung topischer Medikamente und zur Reparatur des Barrieresystems führen. Die tägliche Basispflege soll 2-mal täglich angewendet werden und dient der Stabilisierung der Barrierefunktion der Haut. Bei der Auswahl der Pflegecreme soll darauf geachtet werden, dass diese rückfettend ist und ca. 5% Urea beinhaltet. Produkte, die Erdnussöl beinhalten, sollten aufgrund des allergenen Potenzials gemieden werden. Darüber hinaus sollen unspezifische Triggerfaktoren vermieden werden.
Topische reaktive antientzündliche Therapie
Zum Management von Schüben wird eine antiinflammatorische Behandlung mit topischen Glukokortikoiden und topischen Calcineurininhibitoren empfohlen. Topische Kortikosteroide bleiben die Hauptstütze der Therapie. Bei bestimmten Lokalisationen (Gesicht, Achseln, inguinal, Genitalregion), bei unzureichendem Ansprechen auf topische Kortikosteroide und im Langzeitmanagement sind die topischen Calcineurininhibitoren Tacrolimus und Pimecrolimus zu bevorzugen.
Topische Erhaltungstherapie mit Tacrolimus
Seit 2009 ist topisches Tacrolimus zur Erhaltungstherapie des AE bei Erwachsenen (0,1%) und Kindern (0,03%) zugelassen. Bei dieser proaktiven Behandlung wird Tacrolimus nach erfolgreicher Behandlung 2-mal wöchentlich im Sinne einer Schubprophylaxe weiter verabreicht. Basis dieser Zulassung waren 12-monatige Studien bei Erwachsenen und Kindern, die unter Erhaltungstherapie 1) eine deutlich geringere Anzahl an Exazerbationen und 2) eine deutlich längere Zeitspanne bis zum Auftreten der ersten Exazerbation zeigten und daher von der EMA als klinisch effektiv und als kosteneffektiv evaluiert wurden.
Systemische antientzündliche Therapie
Eine systemische antientzündliche Behandlung sollte einzig bei sehr schweren Fällen zur Anwendung kommen. Systemische Kortikosteroide sind schnell wirksam, dürfen aber aufgrund der Nebenwirkungen nur kurzfristig angewendet werden. Darüber hinaus haben sich Cyclosporin A (3-5 mg/kg/Tag) und Azathioprin (2,5 mg/kg/Tag) als wirksam erwiesen. Alternativ konnte in kleinen Studien die Wirksamkeit von Mycophenolat Mofetil nachgewiesen werden.
Antimikrobielle Therapie mit DermaSilk
Patienten mit AE leiden aufgrund ihres Barrieredefekts und der endogenen mikrobiellen Abwehrschwäche der Haut unter mikrobiell bedingten Exazerbationen. DermaSilk (= AEGIS) ist eine speziell mit einer quaternären Ammoniumbase behandelte Seidenbekleidung, die Bakterien sowie Schimmel- und Hefepilze bindet und tötet und dadurch mikrobiell bedingte Exazerbationen reduziert. Es ist ein dauerhaft wirksames antimikrobielles Material und sicher im Gebrauch. Studien zeigten wiederholt eine signifikante Verbesserung der Hautsymptomatik und eine Linderung des Juckreizes durch DermaSilk. Auch bei Kindern mit AE ist der Gebrauch von Derma- Silk erstaunlich effektiv und vergleichbar mit einer modernen topischen Kortikosteroidbehandlung. Aufgrund der guten Studienergebnisse wird es in der Positionsarbeit zur Diagnose und Therapie des AE der European Academy of Dermatology and Venerology (2009) therapeutisch empfohlen.
Andere begleitende Therapien
Eine adjuvante Phototherapie kann das Erscheinungsbild des AE verbessern, die bakterielle Kolonisierung vermindern und den Verbrauch von topischen antientzündlichen Medikamenten reduzieren.
Antibiotika und Virostatika sind bei Anzeichen einer bakteriellen Superinfektion und Eczema herpeticatum indiziert.
Adjuvant können systemische Antihistaminika zur Erleichterung des Juckreizes verabreicht werden.
Biologika und Probiotika
Biologika: Bis dato gibt es einzelne Pilotstudien und Fallberichte zum Effekt von verschiedenen Biologika bei schweren therapieresistenten Patienten mit AE. Repräsentative randomisierte Studien fehlen. Daher kann diesbezüglich keine Empfehlung gegeben werden.
Probiotika: Therapieregime mit Probiotika zielen darauf ab, die Mikroflora im Darm zu modulieren und so eine “allergieprotektive” T-Helfer-1-Immunantwort statt einer “allergiepermessiven” T-Helfer-2-Immunantwort zu stimulieren. Leider konnte nach ersten viel versprechenden Ergebnissen kein nützlicher Effekt bestätigt werden.
Univ.-Prof. Dr. Tamara Kopp
Universitätsklinik für Dermatologie, Wien
tamara.kopp(at)meduniwien.ac.at