Antikoagulanzientherapie nach thromboembolischen Ereignissen
Aufgrund der geringeren Tendenz zu lebensgefährlichen Blutungen und der deutlich einfacheren Therapieeinstellung werden die Nicht-Vitamin-K-antagonistischen oralen Antikoagulanzien (NOAK) heute in den meisten Indikationen als erste Wahl für eine Antikoagulationstherapie angesehen. In der Sekundärprophylaxe nach thromboembolischen Ereignissen werden sie am häufigsten zur Verhinderung von Schlaganfällen bei nichtvalvulärem Vorhofflimmern (nvVHF) und zur Therapie und Rezidivprophylaxe der venösen Thromboembolie eingesetzt. Mit Rivaroxaban ist ein NOAK zusätzlich in einer niedrigeren Dosierung zur Prophylaxe atherothrombotischer Ereignisse bei Hochrisikopatienten mit koronarer Herzkrankheit (KHK) oder peripherer arterieller Verschlusskrankheit (PAVK) in Kombination mit einer Plättchenaggregationshemmung zugelassen.
Sekundärprophylaxe bei nvVHF
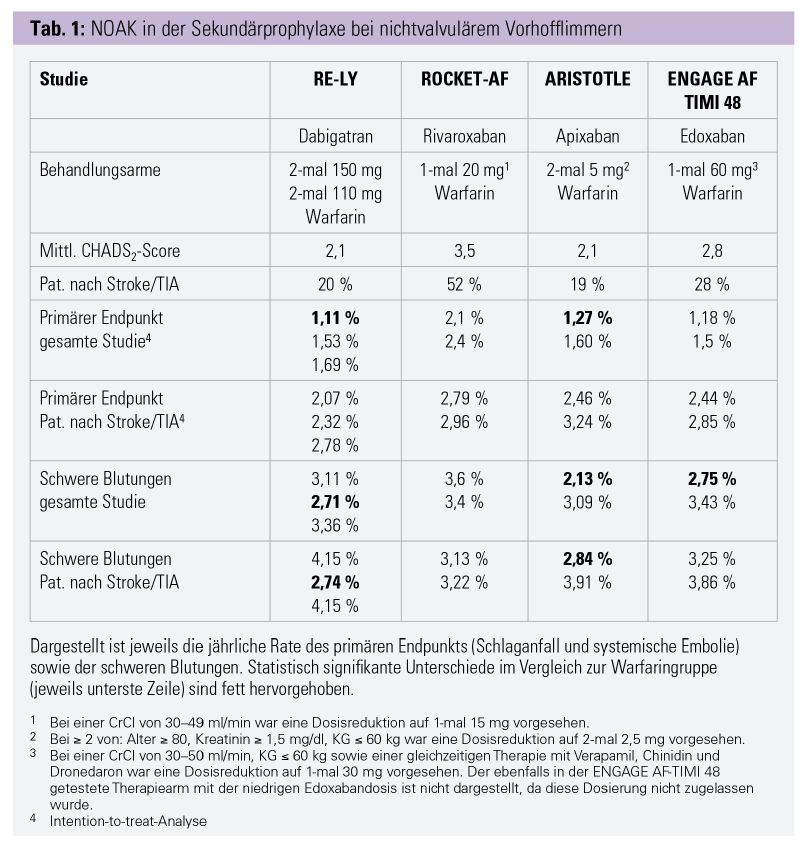
Für alle derzeit verfügbaren NOAK (Apixaban, Dabigatran, Edoxaban, Rivaroxaban) konnte in den Zulassungsstudien für die Schlaganfallprophylaxe bei nichtvalvulärem Vorhofflimmern die Nichtunterlegenheit gegenüber der Standardtherapie mit Warfarin nachgewiesen werden.1–4 Auch wenn die Studien viele Gemeinsamkeiten haben, wurden teilweise Patienten mit deutlich unterschiedlichem Risikoprofil eingeschlossen, was sich in der Variation des durchschnittlichen CHADS2-Scores widerspiegelt (Tab. 1). Konsequenterweise schwankte der Anteil der Patienten mit vorausgegangenem Schlaganfall/TIA in den Studien zwischen 20 % und 50 %. Für alle vier Studien sind auch präspezifizierte Subanalysen verfügbar, welche die Subgruppe der Patienten mit vorausgegangenem Schlaganfall bzw. TIA untersuchten.5–8 Auffallend ist dabei, dass die Rate an neuerlichen Schlaganfällen und Embolien in der Subgruppe mit vorausgegangenem Ereignis deutlich höher war, was – außer für die ROCKET-AF-Studie – auch für die schweren Blutungen zutraf. Insgesamt kann man festhalten, dass sowohl die Wirksamkeit als auch die Sicherheit der NOAK bei Patienten mit vorausgegangenem Schlaganfall oder TIA derjenigen der Gesamtstudiengruppe sehr ähnlich waren.
Therapie und Sekundärprophylaxe nach VTE
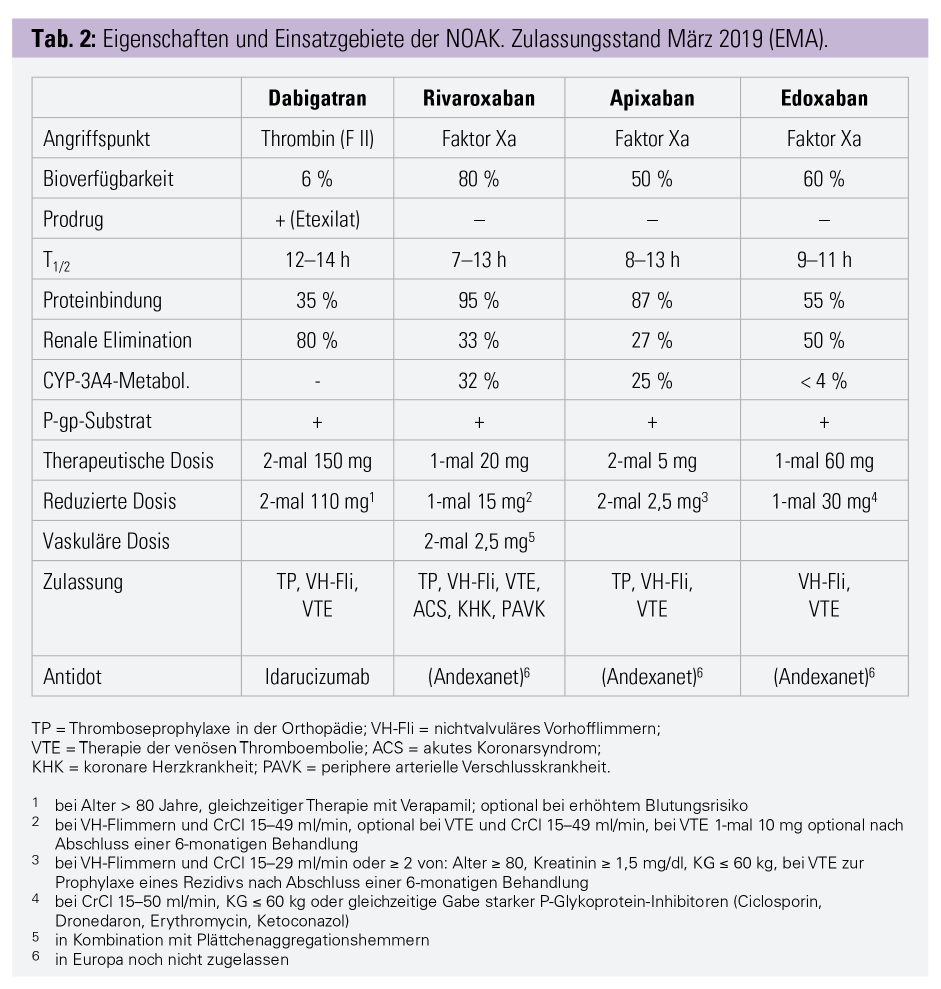
Auch für die Therapie und Sekundärprophylaxe der venösen Thromboembolie (VTE) werden die NOAK mittlerweile breit eingesetzt. In den dazu durchgeführten Studien wurden allerdings verschiedene Studiendesigns verwendet, wodurch sich die unterschiedlichen Anwendungsempfehlungen erklären lassen. Im Falle von Dabigatran und Edoxaban wurde die orale Therapie erst nach einer initialen Gabe von niedermolekularem Heparin über mindestens fünf Tage begonnen, weshalb diese Substanzen auch so zugelassen sind.9, 10 Die anderen beiden NOAK, Rivaroxaban und Apixaban, wurden in den durchgeführten Studien von Beginn an eingesetzt. Daher sind diese direkten oralen Faktor-Xa-Inhibitoren als Initialtherapie ohne vorangegangene Heparintherapie zugelassen, wobei für die initiale Therapiephase erhöhte Dosierungen vorgesehen sind (2-mal 15 mg für die ersten 3 Wochen bei Rivaroxaban, 2-mal 10 mg für die erste Woche bei Apixaban).11, 12 Mittlerweile werden in den aktuellen internationalen Behandlungsrichtlinien (10. Edition der ACCP-Guidelines) die NOAK in der Therapie der TVT für die meisten Patienten als erste Wahl vorschlagen.13 Auch für eine verlängerte Therapie der venösen Thromboembolie mit NOAK gibt es mittlerweile überzeugende Daten, welche die Sicherheit dieser Therapien gut belegen. Für Apixaban ist nach Abschluss einer 6-monatigen Behandlung für die Sekundärprophylaxe eine Dosisreduktion auf 2-mal 2,5 mg vorgesehen. Diese Dosis wies in der AMPLIFY-EXT-Studie ein besonders günstiges Sicherheitsprofil bei gleicher Wirksamkeit auf.14 In der Folge wurde auch Rivaroxaban in der EINSTEIN-CHOICE-Studie in einer niedrigeren Dosis (1-mal 10 mg) gegen die Standarddosis und ASS 100 mg getestet und ist mittlerweile ebenfalls in dieser niedrigeren Dosis nach Abschluss einer mindestens 6-monatigen Therapie zugelassen (Tab. 2).15
Prophylaxe atherothrombotischer Ereignisse bei Hochrisikopatienten
Für den Faktor-Xa-Inhibitor Rivaroxaban gibt es zusätzlich Daten für eine noch deutlich unter der prophylaktischen Dosis liegende, sogenannte vaskuläre Dosierung (2-mal 2,5 mg). In der ATLAS-ACS-2-TIMI-51-Studie wurden über 15.500 Patienten mit einem rezenten akuten Koronarsyndrom (ACS) mit Rivaroxaban 2-mal 5 mg, Rivaroxaban 2-mal 2,5 mg oder Placebo zusätzlich zur doppelten Thrombozytenaggregationshemmung behandelt.16 Verglichen mit Placebo wurden bei beiden Dosierungen von Rivaroxaban weniger ischämische Endpunkte, aber mehr schwere Blutungen beobachtet. Bemerkenswert ist, dass die Gesamtmortalität bei Patienten, die mit der niedrigeren Dosierung (2-mal 2,5 mg Rivaroxaban) behandelt worden waren, signifikant niedriger war.
In die COMPASS-Studie wurden über 27.000 Patienten mit stabiler KHK und zusätzlichen Risikofaktoren oder PAVK eingeschlossen und zu einer Behandlung mit Rivaroxaban 2-mal 5 mg, Rivaroxaban 2-mal 2,5 mg plus ASS 100 mg oder dem Kontrollarm (ASS 100 mg) randomisiert.17 Der primäre Endpunkt (kardiovaskulärer Tod, Myokardinfarkt oder Schlaganfall) wurde von 4,1 % der Patienten unter Rivaroxaban 2-mal 2,5 mg plus ASS versus 5,4 % unter ASS allein erreicht. Dieser Vorteil der Kombinationstherapie wurde allerdings durch eine signifikant höhere Rate an schweren Blutungen erkauft, wobei aber nicht mehr fatale oder intrakranielle Blutungen als unter ASS beobachtet wurden.
Wie bereits in der ATLAS-ACS-2-TIMI-51-Studie, konnte auch in COMPASS eine signifikante Reduktion der Gesamtmortalität unter Rivaroxaban 2-mal 2,5 mg plus ASS demonstriert werden. 62 % der COMPASS-Patienten hatten einen Myokardinfarkt in der Anamnese, wobei sich die Ergebnisse dieser Subgruppe nicht von der gesamten Studienpopulation unterschieden.18
Resümee
Die vorliegenden Studiendaten zur Therapie mit NOAK nach thromboembolischen Ereignissen untermauern in überzeugender Weise die Wirksamkeit und Sicherheit dieser Arzneimittel. Da jede antithrombotische Therapie unweigerlich auch ein Blutungsrisiko mit sich bringt, müssen im Einzelfall die Vorteile einer Antikoagulation gegen die eventuellen Nachteile sorgfältig abgewogen werden.