Typ-2-Diabetes – Argumente gegen den frühen Einsatz von Insulin
Es steht außer Zweifel, dass Insulin das bestwirksame Antidiabetikum ist, das prinzipiell in jeder Phase der Diabeteserkrankung einsetzbar ist. Bei Typ-1-Diabetes konnte durch eine weitgehend normale Diabeteseinstellung mittels einer möglichst physiologischen Insulinsubstitution das Schicksal der Patienten drastisch verbessert werden. Ganz anders ist die Situation beim Typ-2-Diabetes, bei dem es sich um eine sehr komplexe Stoffwechselerkrankung handelt und bei welcher der intensivierten Blutzuckereinstellung – im Vergleich zur Normalisierung von Lipiden und des Blutdrucks – eine deutlich geringere Bedeutung zukommt (Yudkin et al., Lancet 2010).
Die Patienten werden immer dicker
Besonders wichtig ist die Tatsache, dass Patienten mit Typ-2-Diabetes vor 40 Jahren einen wesentlich geringeren Body Mass Index (BMI) aufwiesen (in Zentraleuropa damals 26–27 kg/m2), während heute der mittlere BMI bei Diabetespatienten in Europa bei 29 bis 31 kg/m2 und in den USA um 34 kg/m2 liegen dürfte. Prinzipiell ist Insulin auch noch bei sehr übergewichtigen Patienten wirksam, im Vergleich zu schlanken Personen ist allerdings die Wirksamkeit stark herabgesetzt (Gagnon-Auger et al., Diabetes Care 2010). Nachteile wie Gewichtszunahme und beträchtliche Steigerung des Hypoglykämierisikos sind zu bedenken. Aus diesem Grund wird bei Patienten mit Typ-2-Diabetes immer häufiger eine Insulintherapie mit Antiinsulinresistenz-Medikamenten wie Metformin oder – wenn keine Kontraindikationen vorliegen – mit Pioglitazon kombiniert. Um die oft beträchtliche Gewichtszunahme und eine weitere Steigerung der Insulindosis im Therapieverlauf – assoziiert mit einer weiteren Zunahme des Hypoglykämierisikos – abzuschwächen, wurden zuletzt auch Kombinationstherapie von Insulin mit GLP-1-Analoga oder mit SGLT-2-Inhibitoren mit relativ gutem Therapieerfolg eingesetzt (Buse et al., Ann Intern Med 2011; Wilding et al., Ann Intern Med 2012).
Evidenz für Betazellprotek-tion wenig überzeugend
Bisher gibt es in der kaukasischen Bevölkerung keine überzeugende Studie, die darauf hinweist, dass durch eine frühzeitige Insulintherapie die Progression der Betazelldysfunktion verhindert werden kann. Eine kurz dauernde Studie aus China (Weng et al., Lancet 2008) ist nicht repräsentativ, da diese Patienten einen sehr hohen initialen HbA1c-Wert aufwiesen (9,8 %) – in dieser Situation würde man in jedem Fall Insulin verabreichen. Erschwerend in dieser Studie kommt hinzu, dass in der Kontrollgruppe eine Kombination von Metformin und Sulfonylharnstoff eingesetzt wurde, eine Therapieform, die mit einem hohen Therapieversagen (Gallwitz et al., Lancet 2012) assoziiert ist.
Komplikationsvermeidung nicht spezifisch für Insulin
Ein frühzeitiger Einsatz der Insulintherapie bei Patienten mit Typ-2-Diabetes wäre dann unbedingt erforderlich, wenn eine Überlegenheit bezüglich der Prävention von mikrovaskulären und makrovaskulären Komplikationen dokumentiert wäre. Dies ist aber leider auch nach 90-jähriger Insulintherapie bei Typ-2-Diabetes nicht der Fall, da die Prävention von mikrovaskulären Komplikationen ausschließlich vom HbA1c-Wert abhängig ist und bislang keine spezifischen Insulineffekte nachgewiesen werden konnten.
Kardiovaskuläre Effekte nach wie vor unklar
Noch ungünstiger ist die Situation bezüglich makrovaskulärer Komplikationen, da bisher in keiner der vorliegenden Studien (DIGAMI-2, ACCORD, ADVANCE, VADT) ein günstiger Einfluss einer verbesserten Diabetestherapie (insbesondere durch eine Zunahme der Insulintherapie) nachgewiesen werden konnte. In der DIGAMI-2-Studie zeigte sich nach 4-jährigem Verlauf sogar eine Verdopplung des Risikos von Herzinfarkt und Schlaganfall bei jenen Patienten, die Insulin erhielten, im Vergleich zu Patienten, die mit oralen Antidiabetika behandelt wurden (Mellbin et al., Diabetologia 2011). In einer kanadischen Populationsstudie fand sich ein signifikanter Zusammenhang zwischen der Insulinexposition und der kardiovaskulären und nicht-kardiovaskulären Mortalität, auch nach exakter Adjustierung für andere Medikamente und Komorbiditäten (Currie & Johnson, Diabetes Obes Metab 2012).
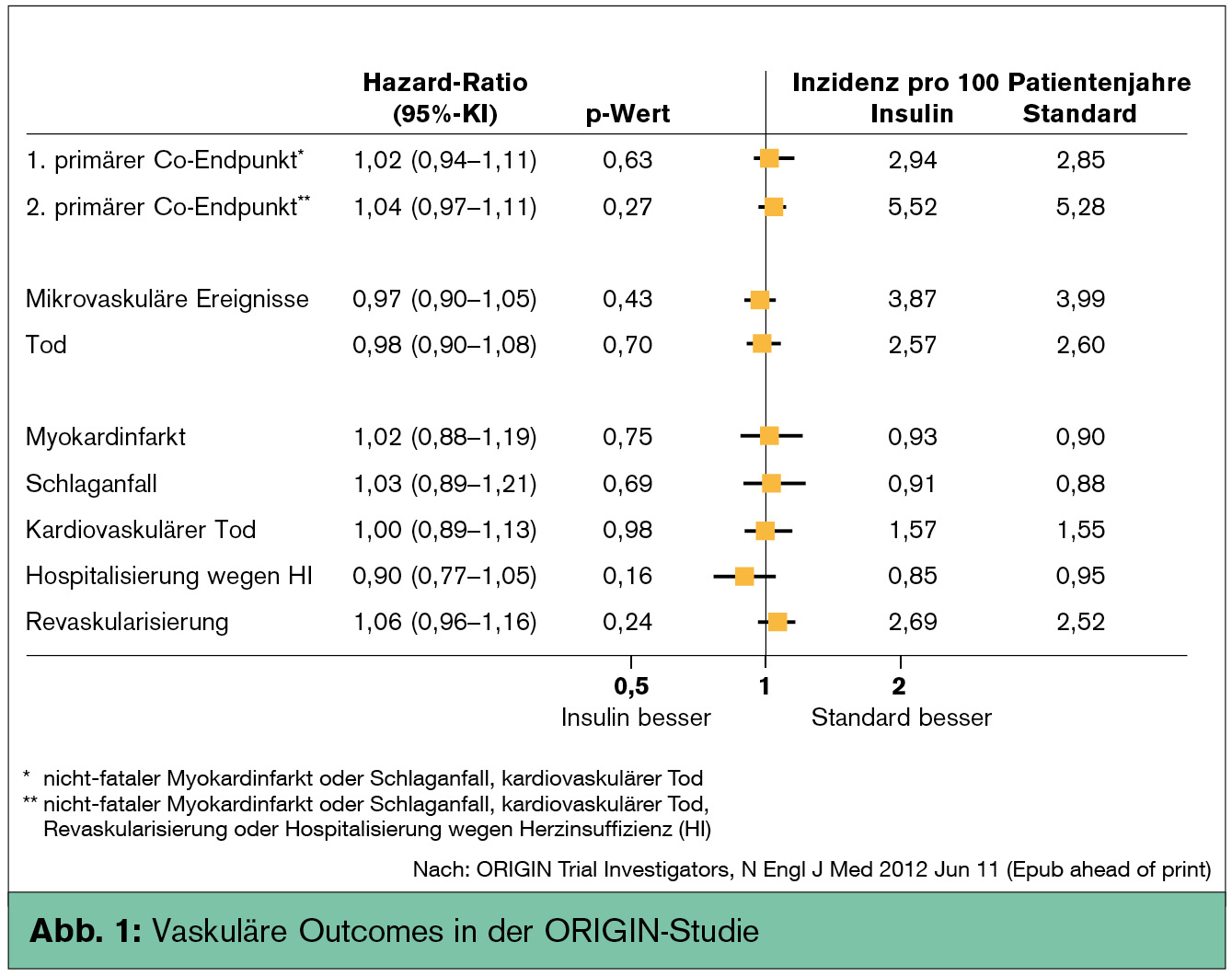 In der vor kurzem publizierten ORIGIN-Studie (NEJM 2012) hatte eine basale Insulintherapie (0,40 IE pro kg Körpergewicht bei Studienende nach 6 Jahren) bei Patienten mit Typ-2-Diabetes und hohem kardiovaskulären Risiko bezüglich Gesamtmortalität und kardiovaskulärer Mortalität oder kardiovaskulärer Ereignisse keinerlei Vorteil gegenüber einer Standardtherapie (60 % Metformin, 47 % Sulfonylharnstoffe; Abb. 1). In der basalen Insulintherapiegruppe erhielten allerdings ebenfalls 46 % der Patienten Metformin und 25 % Sulfonylharnstoffe. Die Patienten hatten bei Studienbeginn eine mittlere Diabetesdauer von 5 Jahren und einen mittleren HbA1c-Wert von nur 6,4 %. Obwohl nach 6-jähriger Studiendauer die HbA1c-Differenz mit 0,3 Prozentpunkten nur marginal unterschiedlich war (6,3 % vs. 6,5 %), hatten Patienten in der Insulintherapiegruppe 3-mal häufiger schwere Hypoglykämien und nahmen um 2 kg mehr zu als Patienten in der Kontrollgruppe.
In der vor kurzem publizierten ORIGIN-Studie (NEJM 2012) hatte eine basale Insulintherapie (0,40 IE pro kg Körpergewicht bei Studienende nach 6 Jahren) bei Patienten mit Typ-2-Diabetes und hohem kardiovaskulären Risiko bezüglich Gesamtmortalität und kardiovaskulärer Mortalität oder kardiovaskulärer Ereignisse keinerlei Vorteil gegenüber einer Standardtherapie (60 % Metformin, 47 % Sulfonylharnstoffe; Abb. 1). In der basalen Insulintherapiegruppe erhielten allerdings ebenfalls 46 % der Patienten Metformin und 25 % Sulfonylharnstoffe. Die Patienten hatten bei Studienbeginn eine mittlere Diabetesdauer von 5 Jahren und einen mittleren HbA1c-Wert von nur 6,4 %. Obwohl nach 6-jähriger Studiendauer die HbA1c-Differenz mit 0,3 Prozentpunkten nur marginal unterschiedlich war (6,3 % vs. 6,5 %), hatten Patienten in der Insulintherapiegruppe 3-mal häufiger schwere Hypoglykämien und nahmen um 2 kg mehr zu als Patienten in der Kontrollgruppe.
Die „neutralen“ Befunde des Insulinarms in der ORIGIN-Studie sind deshalb sehr kritisch zu beurteilen, da im Kontrollarm eine Kombination von Metformin und Sulfonylharnstoffen eingesetzt wurde, eine Therapieform, die in mehreren Studien – UKPDS 34 (Lancet 1998), Fremantle Diabetes Study (Sillars et al., Diabetes Obes Metab 2010) – und in 3 Metaanalysen (Rao et al., Diabetes Care 2008; Lamanna et al., Diabetes Obes Metab 2011; Boussageon et al., 2012) mit einer signifikant erhöhten kardiovaskulären Mortalität bzw. kardiovaskulären Ereignisraten assoziiert war).
In jüngster Zeit wurde vermehrt diskutiert, ob Insulin bei Patienten mit Insulinresistenz und insbesondere mit makrovaskulären Komplikationen eine proatherogene Wirkung haben könnte. Insulin senkt ja nicht nur den Blutzucker, sondern hat eine Reihe von biologischen Wirkungen in verschiedensten Geweben. In der Niere bewirkt eine Hyperinsulinämie eine vermehrte Retention von Natrium, Wasser und Harnsäure und könnte dadurch zu einem vermehrten kardiovaskulären Risiko beitragen. Die Hyperinsulinämie erhöht auch die Aktivität im sympathischen Nervensystem, was wiederum zum erhöhten Blutdruck beiträgt.
Potenzielle Folgen der mitogenen Insulineffekte
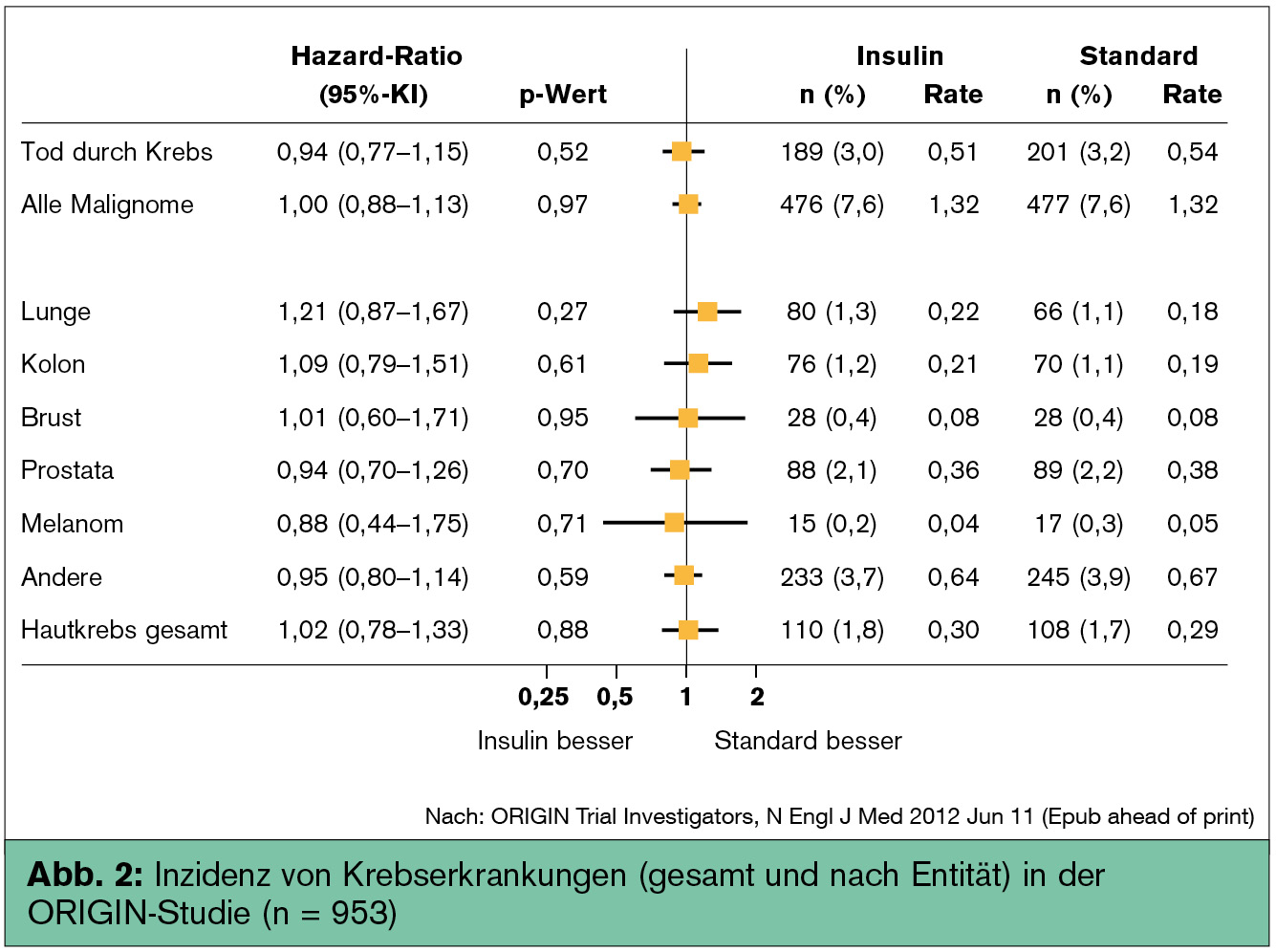 Insulin hat auch nicht nur metabolische, sondern zusätzlich mitogene Effekte, die bei sehr hoher Insulindosis besonders ausgeprägt sein dürften. Yang et al. (Gastroenterology 2004) waren die ersten, die ein erhöhtes Risiko für kolorektale Karzinome bei Patienten mit einer Insulintherapie nachweisen konnten, wobei das Risiko signifikant mit der Expositionszeit der Insulintherapie korrelierte. Ein erhöhtes Risiko für Leber- und Pankreaskrebs in Assoziation mit Insulin wurde ebenfalls beschrieben, wobei hier eine „reverse Kausalität“ durchaus denkbar ist (Currie & Johnson, Diabetes Obes Metab 2012). Neben einer erhöhten Krebsinzidenz fand sich auch eine mit der Insulintherapie assoziierten Krebsmortalität (Bowker et al., Diabetologia 2010). In der ORIGIN-Studie fand sich erfreulicherweise kein Hinweis für eine erhöhte Krebsinzidenz unter der basalen Insulintherapie mit Glargin im Vergleich zum Kontrollarm (Abb. 2). Da Metformin das mit einer Insulintherapie erhöhte Krebsrisiko abschwächen dürfte (Currie et al., Diabetologia 2009), sind in der ORIGIN-Studie weitere Untersuchungen bei Patienten im Insulinarm erforderlich, die entweder nur Insulin erhielten oder zusätzlich auch mit Metformin (46 % aller Patienten) behandelt wurden.
Insulin hat auch nicht nur metabolische, sondern zusätzlich mitogene Effekte, die bei sehr hoher Insulindosis besonders ausgeprägt sein dürften. Yang et al. (Gastroenterology 2004) waren die ersten, die ein erhöhtes Risiko für kolorektale Karzinome bei Patienten mit einer Insulintherapie nachweisen konnten, wobei das Risiko signifikant mit der Expositionszeit der Insulintherapie korrelierte. Ein erhöhtes Risiko für Leber- und Pankreaskrebs in Assoziation mit Insulin wurde ebenfalls beschrieben, wobei hier eine „reverse Kausalität“ durchaus denkbar ist (Currie & Johnson, Diabetes Obes Metab 2012). Neben einer erhöhten Krebsinzidenz fand sich auch eine mit der Insulintherapie assoziierten Krebsmortalität (Bowker et al., Diabetologia 2010). In der ORIGIN-Studie fand sich erfreulicherweise kein Hinweis für eine erhöhte Krebsinzidenz unter der basalen Insulintherapie mit Glargin im Vergleich zum Kontrollarm (Abb. 2). Da Metformin das mit einer Insulintherapie erhöhte Krebsrisiko abschwächen dürfte (Currie et al., Diabetologia 2009), sind in der ORIGIN-Studie weitere Untersuchungen bei Patienten im Insulinarm erforderlich, die entweder nur Insulin erhielten oder zusätzlich auch mit Metformin (46 % aller Patienten) behandelt wurden.























































































