Asymptomatische Pulmonalembolie beim onkologischen Patienten
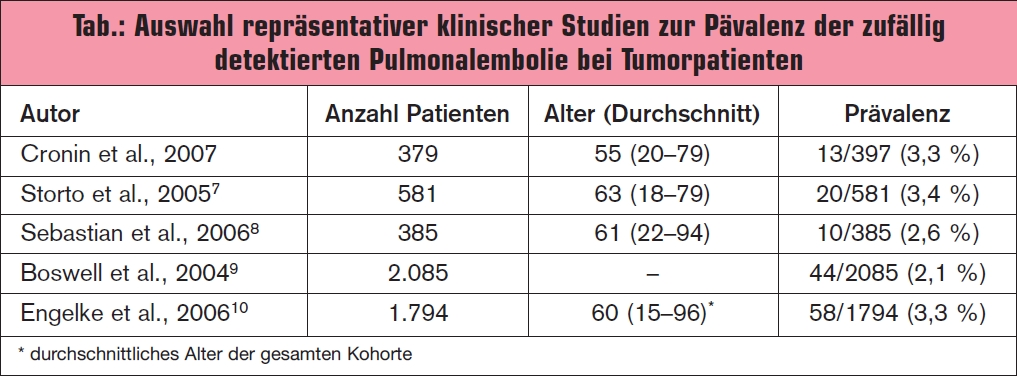
Die durchschnittliche Prävalenz an zufällig detektierten Pulmonalembolien (PE) bei Krebspatienten beträgt 3,1 % (95%-KI 2,2 bis 4,1 %). Die in > Tab. angeführten Zahlen sind bis auf die Studie von Sebastian (2006) Daten aus retrospektiven Kohortenstudien.1 Anamnestisch können durch gezielte Befragung bei manchen Patienten retrospektiv Symptome einer Pulmonalembolie erkannt werden. Es wurde gezeigt, dass die Häufigkeit PE-relevanter Symptome wie Kurzatmigkeit (22 % vs. 8 %) und rasche Ermüdbarkeit (54 % vs. 20 %) bei Tumorpatienten mit zufällig diagnostizierter Pulmonalembolie häufiger sind als bei Tumorpatienten ohne Pulmonalembolie. Andere PE-typische klinische Befunde wie Thoraxschmerz und klinischer Hinweis auf Beinvenenthrombose waren in den beiden Patientengruppen jedoch nicht unterschiedlich.2 Auffallend war, dass bei CTs, die im Rahmen eines stationären Aufenthaltes durchgeführt wurden, die Rate an Pulmonalembolien höher war als bei CTs im Rahmen einer ambulanten Kontrolle (4,0 %; 95%-KI 2,7–5,6 % versus 1,2%; 95%-KI 0,5–2,1 %).3 Das fortgeschrittene Stadium ist ebenfalls ein Risikofaktor. Nicht gesichert ist dagegen die laufende Chemotherapie als Risikofaktor für die zufällig detektierte Pulmonalembolie.1
Welche Schritte nach Diagnosestellung? Wird im Rahmen einer Routinetumorkontrolle die Diagnose „asymptomatische oder zufällig detektierte Pulmonalembolie“ gestellt, steht man zunächst vor der Frage, ob weitere diagnostische Schritte sinnvoll sind. Hier- zu gibt es keine Studien. In den ACCP-Guidelines werden weiterführende Untersuchungen (D-Dimer, Duplexsonografie der tiefen Beinvenen, Pulmonalis-CT) nur dann empfohlen, wenn das Vorhandensein einer Pulmonal – embolie mit dem bereits erfolgten CT nicht ausreichend gesichert wurde. Wenn vorhanden, sollten kürzlich angefertigte CT-Bilder herangezogen werden, um eine rezente PE von einer schon länger bestehenden PE zu unterscheiden. Das aktuelle CT sollte außerdem für Hinweise einer tiefen, zentralen Venenthrombose (z. B.: V. subclavia, V. cava inf., V. iliaca) reevaluiert werden.4
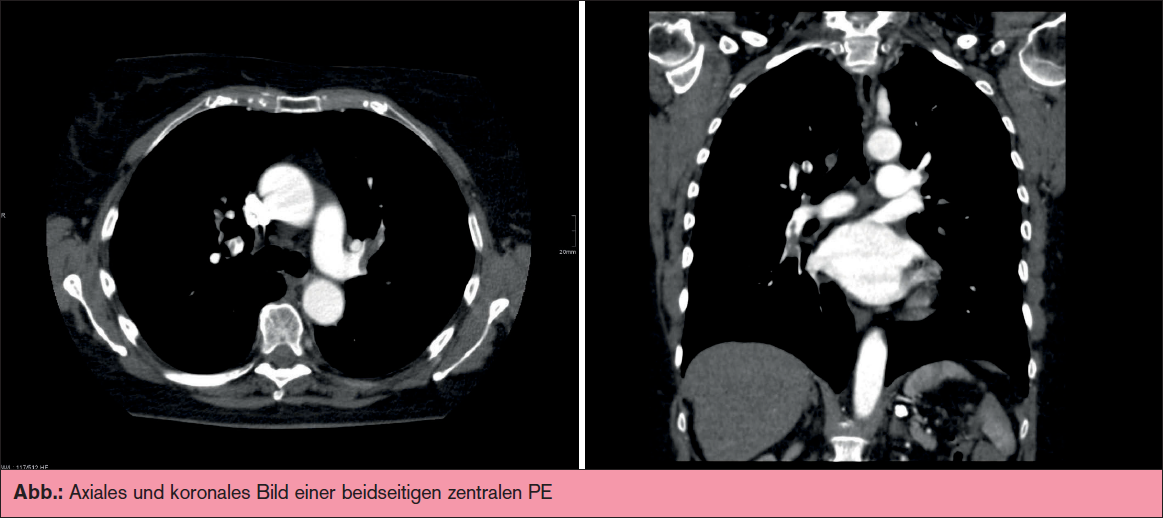
Im Kontext einer zufällig detektierten Pulmonalembolie könnte ein negatives D-Dimer darauf hindeuten, dass es sich um ein nicht so rezentes Geschehen handelt. Nach Ansicht der Autoren dieses Beitrags darf aus dem negativen D-Dimer-Befund jedoch nicht abgeleitet werden, dass eine Antikoagulation überflüssig ist, weil das Ereignis möglicherweise schon länger zurückliegend ist. Eine ergänzende Duplexsonografie ist sinnvoll, da die Diagnosesicherung der tiefen Beinvenenthrombose Auswirkungen auf Therapiemaßnahmen, insbesondere auf die Kompressionsstrumpftherapie zur Prophylaxe eines postthrombotischen Syndroms hat.
Es gibt keine Studien zur Frage, ob der Zufallsbefund Pulmonalembolie einen Einfluss auf die Morbiditäts- und Mortalitätsraten onkologischer Patienten hat. Es wurden bis dato auch keine Studien zur optimalen Therapie der zufällig detektierten Pulmonalembolie durchgeführt.3 Aufgrund des Risikos rezidivierender Ereignisse sowie der hohen Mortalitätsrate einer unbehandelten symptoma – tischen PE wird auch bei Patienten mit asymptomatischer PE eine therapeutische Antikoagulation empfohlen.4 In der 2003 publizierten CLOT-Studie zeigte sich ein Vorteil niedermolekularer Heparine gegenüber Vi – tamin-K-Antagonisten bei Patienten mit symptomatischer venöser Thromboembolie. Patienten mit zufällig detektierter Pulmonalembolie sollten daher mit Diagnosestellung gleichfalls eine Therapie mit LMWH in therapeutischer Dosierung erhalten.5 Bei potentiell kurativer Tumorerkrankung sollte die Antikoagulation bis zum Abschluss der Tumortherapie fortgeführt werden. Liegt eine Erkrankung mit nichtkurativer Therapieintention vor, wird eine langfristige Therapie empfohlen. (Grad-1C-Empfehlung)4, 6
FACT-BOX
- Steigende Häufigkeit der asymptoma tischen Pulmonalembolie bei Tumor patienten aufgrund besserer Bild qualität in der CT-Diagnostik (Prävalenz etwa 3 %).
- Bildvergleich mit Vorbefunden und Duplexsonografie der unteren Extremitäten sinnvoll.
- Gleiche Therapie wie bei symptomatischer Pulmonalembolie (niedermolekulares Heparin).
- Niedermolekulares Heparin bis zum Abschluss der Tumortherapie bei kurativer Therapieintention.
1 Cronin C.G. et al., AJR Am J Roentgenol 2007; 189:162-70
2 O’Connell C.L. et al., J Clin Oncol 2006; 24:4928-4932
3 Dentali F. et al., Thromb Res 2010; 125: 518-522
4 Kearon C. et al., Chest 2008; 133 (Supplement):454-545
5 Lee A.Y. et al., J Clin Oncol 2005; 23:2123–2129
6 ESC-Task Force for the Diagnosis and Management ofAcute Pulmonary Embolism; Eur Heart J 2008; 29:2276-2315
7 Storto M.L. et al., Am J Roentgenol 2005; 184:264-7
8 Sebastian A.J. et al., Clin Radiol 2006; 61:81-5
9 Boswell W.D. et al., Cancer Imaging 2004; 4:S58
10 Engelke C. et al., Radiology 2006; 239:563-75