EULAR 2019: Neues zur Polyarthritis
Die wissenschaftlichen Erkenntnisse des diesjährigen Kongresses der European League Against Rheumatism (EULAR) zeigten eine Wende bei den medikamentösen Therapiestrategien zur Behandlung der rheumatoiden Arthritis auf sowie neue Einsichten bei pathophysiologischen Konzepten bei dieser Erkrankung.
Neues zu JAK-Inhibitoren
Upadacitinib (UPA)
2018 haben Burmester et al. die Wirksamkeit von Upadacitinib (UPA) in Kombination mit csDMARDs bei Patienten mit mäßig bis hoch aktiver rheumatoider Arthritis nachgewiesen.1 Als nächster Schritt wurde die Wirksamkeit im Vergleich zu bereits etablierten bDMARDs, in dieser Studie zu Adalimumab, überprüft.2 In dieser SELECT-COMPARE-Studie wurde die Sicherheit und Wirksamkeit von UPA im Vergleich zu Placebo (PBO) und Adalimumab (ADA) geprüft, in Kombination mit einer stabilen MTX-Dosis. Die SELECT-COMPARE-Studie war eine doppelblinde Studie über 48 Wochen, mit einer „Rettungsarm“-Option, falls nach 14 bis 26 Wochen keine 20-prozentige Verbesserung der geschwollenen oder druckschmerzhaften Gelenke vorlag oder der CDAI > 10 war. In der UPA-Gruppe haben 38,7 % und in der ADA-Gruppe 48,6 % der Patienten diese Option in Anspruch genommen. In Woche 48 wurde eine signifikant höhere Wirksamkeit von UPA gegenüber ADA erreicht – ACR20 (65 % vs. 54 %, p < 0,01); ACR70 (36 % vs. 23 %, p < 0,001). In der UPA-Gruppe wurde etwas häufiger Herpes Zoster im Gegensatz zur ADA-Gruppe beobachtet (3,1 vs. 1,3 %). Allerdings wurden insgesamt häufiger Nebenwirkungen in der ADA-Gruppe beobachtet. Die kumulative Analyse der Sicherheitsdaten aus allen fünf (Phase-III-)UPA-Studien ergab ein ähnliches Sicherheitsprofil, und vor allem wurden venöse thromboembolische Ereignisse nicht gehäuft beobachtet.3
Was tun nach JAK-Versagen?
Die Daten von JAK-Inhibitor-Studien zeigten eine gute Wirksamkeit, und deren Einsatz ist bereits nach Versagen eines csDMARDs gerechtfertigt. Aber was passiert, wenn ein JAK-Inhibitor nicht wirkt? Wird danach noch eine TNF-Inhibition wirksam sein? Es wurde versucht, diese Frage mit der „Rettungsarm“-Option der SELECT-COMPARE-Studie zu beantworten.4 Die 77 Patienten mit unzureichendem klinischen Ansprechen aus der UPA-Gruppe erhielten dann die Therapie mit ADA und 126 Patienten der ADA-Gruppe die Therapie mit UPA. Nach Umstellung der Therapie wurde nach 6 Monaten unter ADA eine ACR20/50/70-Antwort bei 59 %/26 %/12 % und unter UPA bei 75 %/49 %/24 % der Patienten beobachtet. Obwohl sich bessere Ergebnisse nach Switch in der UPA-Gruppe zeigten, ist die Wirksamkeit von ADA nach Therapieumstellung durchaus gegeben und ADA als therapeutische Option vertretbar.
Filgotinib (FIL)
Die Wirksamkeit und Sicherheit von einem weiteren JAK-1-Inhibitor, Filgotinib (FIL), wurde mit oder ohne MTX bei MTX-naiven RA-Patienten in einer Phase-III-Studie geprüft.5 In dieser doppelblinden Studie wurden die Patienten mit mäßig bis schwer aktiver RA wie folgt auf 4 Gruppen randomisiert (2 : 1 : 1 : 2):
- FIL 200 mg täglich + MTX wöchentlich (bis zu 20 mg),
- FIL 100 mg + MTX,
- FIL 200 mg (+ PBO) oder
- MTX (+ PBO).
Nach 24 Wochen erreichten signifikant mehr Patienten in den Armen FIL 200 mg + MTX (81,0 %; P < 0,001) und FIL 100 mg + MTX (80,2 %; P < 0,05) ein ACR20-Ansprechen im Vergleich zur MTX-Monotherapie (71,4 %). Bei der ACR20-Antwort zeigte die Gruppe mit FIL-Monotherapie keine höhere Wirksamkeit im Vergleich zur MTX-Monotherapie, allerdings wurde in Bezug auf die ACR50/70-Antwort eine signifikant höhere Wirksamkeit von FIL beobachtet (58,1 %, 40 % vs. 45,7 %, 26 %, p < 0,001).
In einer weiteren doppelblinden Phase-III-Studie mit FIL wurde die Wirksamkeit und Sicherheit bei Patienten mit aktiver RA von FIL 200 mg und FIL 100 mg gegenüber ADA oder PBO mit stabiler MTX-Dosis geprüft.6 Sowohl in der Woche 12 als auch 24 erreichten signifikant mehr Patienten in den FIL-Armen mit 200 mg und 100 mg ein ACR20/50/70-Ansprechen im Vergleich zu PBO. Da diese Studie ein non-inferiority-Design hatte, wurde auf Basis von DAS28(CRP) ≤ 3,2 keine Unterlegenheit von FIL gegenüber ADA beobachtet. Schwere Infekte wurden etwas häufiger in den FIL- und ADA-Armen gegenüber PBO beobachtet. Betreffend Herpes Zoster und thromboembolischer Ereignisse wurde kein Unterschied zum PBO-Arm notiert.
JAK-Inhibitoren als Monotherapie
Die Erfahrungen mit bereits etablierten JAK-Inhibitoren zeigen die Daten des britischen Registers.7 In diesem Register sind 443 Patienten mit einer JAK-Inhibitor-Therapie erfasst, davon 374 Patienten (84 %) mit einer Baricitinib-Therapie und 69 (16 %) Patienten mit einer Tofacitinib-Therapie (TOFA). Interessanterweise wurde bei einem Drittel der Patienten gleich nach einem csDMARD die Therapie mit einem JAK-Inhibitor eingeleitet. Der Großteil der Patienten, die davor eine bDMARD-Therapie erhielten, hatten vorher im Schnitt drei unterschiedliche Biologika und 52 % davon eine Rituximab-Therapie, wobei diese Patienten zahlreiche Komorbiditäten aufwiesen. Besonders interessant erscheint die Tatsache, dass 57 % der Patienten eine Monotherapie mit JAK-Inhibitoren erhielten.
Das Potenzial der JAK-Inhibitoren als Monotherapie wurde auch für UPA erkannt und in der randomisierten, doppelblinden SELECT-EARLY-Studie gegenüber MTX geprüft.8 Nach 48 Wochen zeigten UPA 15 mg ein 74%- und UPA 30 mg ein 75%-ACR20-Ansprechen, demgegenüber zeigte MTX ein Ansprechen bei 57 % der Patienten. Eine CDAI-Remission wurde bei 33 % bzw. 40 % der Patienten bei UPA 15 mg bzw. 30 mg gegenüber 17 % bei MTX beobachtet. Bei unzureichendem Ansprechen auf UPA-Monotherapie wurde ein Rettungsarm vorgesehen, und MTX wurde als Therapieerweiterung bei 6 % der Patienten mit UPA 15 mg und 3 % UPA 30 mg hinzugefügt.
In der post-hoc-Datenanalyse der ORAL-STRATEGY-Studie, in der die Wirksamkeit und Sicherheit der Tofacitinib-Monotherapie gegenüber TOFA + MTX und ADA + MTX festgestellt wurde, ergaben sich interessante Daten zur TOFA-Monotherapie.9 In der Originalpublikation zeigte die TOFA-Monotherapie keine überzeugenden Ergebnisse.10 Jedoch bei weiterer Stratifizierung wurde erkannt, dass Patienten mit einer Krankheitsdauer von weniger als 2 Jahren gleich gut von einer Monotherapie mit TOFA profitieren bzw. dass sich kein signifikanter Unterschied bei der Wirksamkeit im Vergleich zu einer Kombinationstherapie mit MTX fand.
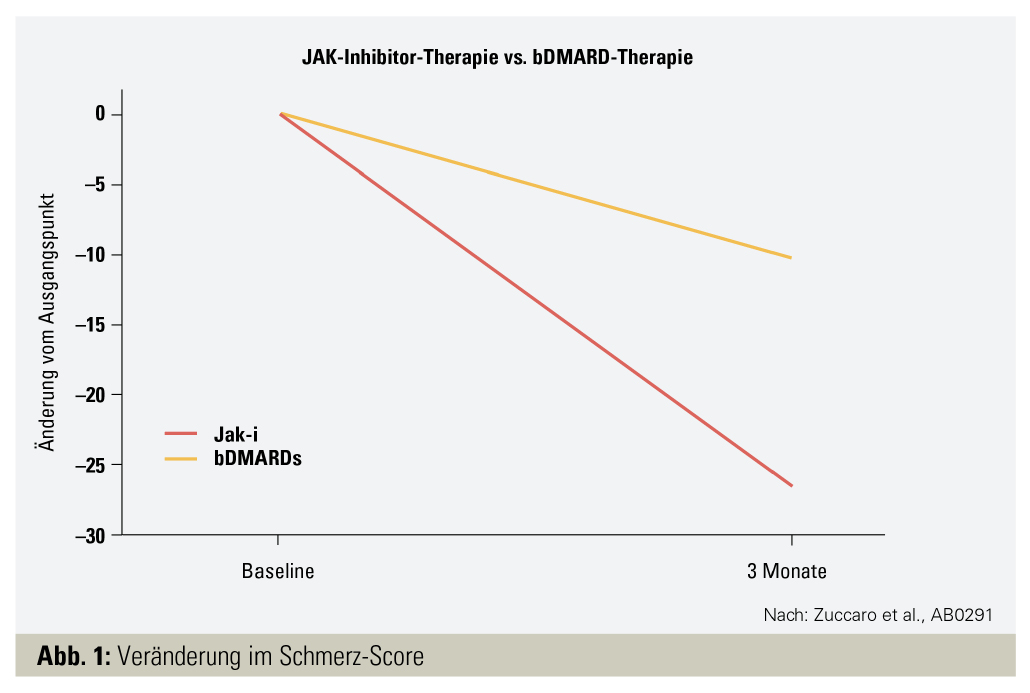
In der Datenanalyse des apulischen Registers (BIOPURE) wurde das frühe klinische Ansprechen bei RA-Patienten unter JAK-Inhibitor-Therapie vs. bDMARD-Therapie untersucht.11 Es zeigte sich nach drei Monaten eine signifikant höhere Veränderung im VAS-Schmerz-Score bei Patienten, die mit JAK-Inhibitoren behandelt wurden, im Vergleich zu jenen mit einer bDMARD-Therapie (p = 0,0005) (Abb. 1). Beim DAS28 wurde dieser Unterschied nicht beobachtet.
Update der EULAR-Empfehlungen
Aufgrund dieser mehr als überzeugenden Datenlage zu JAK-Inhibitoren wurde ein Update der EULAR-Empfehlungen zur RA-Therapie angekündigt. Die JAK-Inhibitoren werden den bisher etablierten bDMARDs gleichgestellt, und nach fehlendem Ansprechen auf eine Therapie mit csDMARDs ist der Einsatz von JAK-Inhibitoren gerechtfertigt. Diese Empfehlung betrifft auch den Einsatz von JAK-Inhibitoren als Monotherapie.
ANA und Arthritis
In unserem Alltag sind wir oft mit folgender Befundkonstellation konfrontiert: entzündliche Arthralgien und niedrig positive ANA-Werte. Wie ist diese Befundkombination zu interpretieren bzw. ab welchem ANA-Wert sollen wir auch an eine Kollagenose denken?
Überinterpretation niedriger ANA-Titer: Eine portugiesische Gruppe untersuchte in einer retrospektiven Beobachtung 207 Patienten mit suspekten entzündlichen Arthritiden und korrespondierenden Laborwerten wie CRP oder BSG.12 Bei den meisten Patienten wurde eine RA diagnostiziert, und bei 64,2 % der Patienten wurden zusätzlich positive ANA-Werte beobachtet – meist in einer niedrigen Titration (1 : 160 in 33,8 %, 1 : 320 in 19,3 %, 1 : 640 in 8,7 % und 1 : 1280 in 2,4 %) mit dicht-feingranulärem Muster (45,1 %). Der Großteil der untersuchten Patienten mit positiven ANA-Werten hatte keine ANA-assoziierte Erkrankung, und besonders beim 1:320-Titer wurde ein geringer prädiktiver Wert beobachtet. Daraufhin wurde vor einer Überinterpretation bei niedrig positiven ANA-Werten gewarnt.
Hoher Titer als Prädiktor: Von besonderem Interesse waren dazu auch die Ergebnisse einer japanischen Studie.13 In dieser Studie wurde untersucht, ob das Vorhandensein von einem positiven ANA-Titer die Entwicklung von Anti-Drug-Antikörpern (ADrA) und die klinische Wirksamkeit bei RA-Patienten vorhersagt. In dieser prospektiven Observation wurden 92 Patienten (38 Infliximab IFX und 54 ADA) eingeschlossen. Vor und während der Therapie wurden ANA und ADrA bestimmt. 13 (34,2 %) Patienten aus der IFX-Gruppe und 18 (33,3 %) aus der ADA-Gruppe entwickelten die ADrA. Interessanterweise waren alle ADrA-positiven Patienten vor der Therapie ANA-positiv. Ein hoher ANA-Titer vor und nach der IFX-Behandlung könnte die Entwicklung von ADrA voraussagen und möglicherweise ein Prädiktor für ein Behandlungsversagen sein.
Lauret et al. untersuchten, ob ein Therapiewechsel zu einem Infliximab-Biosimilar mit der Entwicklung von ADrA assoziiert ist. Während des Beobachtungszeitraums von 3 Jahren wurde kein gehäuftes Auftreten von ADrA beobachtet. Allerdings wurden etwas häufiger allergische Reaktionen bei Patienten mit ADrA beobachtet.14
Niedrigdosiertes Rituximab als Erhaltungstherapie
Eine holländische Gruppe hat in der REDO-Studie die Wirksamkeit der RTX-Nachbehandlung mit niedrigen Dosen (1 × 500 mg oder 1 × 200 mg) und mit einer Standarddosis (1 × 1.000 mg) verglichen. In diese Studie wurden jene RA-Patienten eingeschlossen, die bereits ein gutes klinisches Ansprechen auf die initiale Rituximab-Therapie zeigten (DAS28[CRP] < 2,99). Diese Patienten wurden in drei Gruppen randomisiert (1 : 2 : 2) : 1 × 1000 mg, 1 × 500 mg und 1 × 200 mg für Monat 3 und 6. Es zeigte sich eine suffiziente Wirkung bei den Patienten mit der niedrigen RTX-Dosis, und in diesen beiden Gruppen wurden seltener Infekte beobachtet.
Impfung und RA
Influenza: Patienten unter TNFi-Therapie weisen ein erhöhtes Influenza-Risiko gegenüber der gesunden Population auf. Darüber hinaus wurde bei TNFi-behandelten Patienten eine leicht verringerte Serokonversionsrate nach Influenza-Impfung beobachtet. Trotzdem wird die Immunantwort als ausreichend angesehen, um allen RA-Patienten eine Influenza-Impfung zu empfehlen. Allerding sieht es im klinischen Alltag ganz anders aus: Der Großteil der Patienten wird nicht wie empfohlen geimpft.
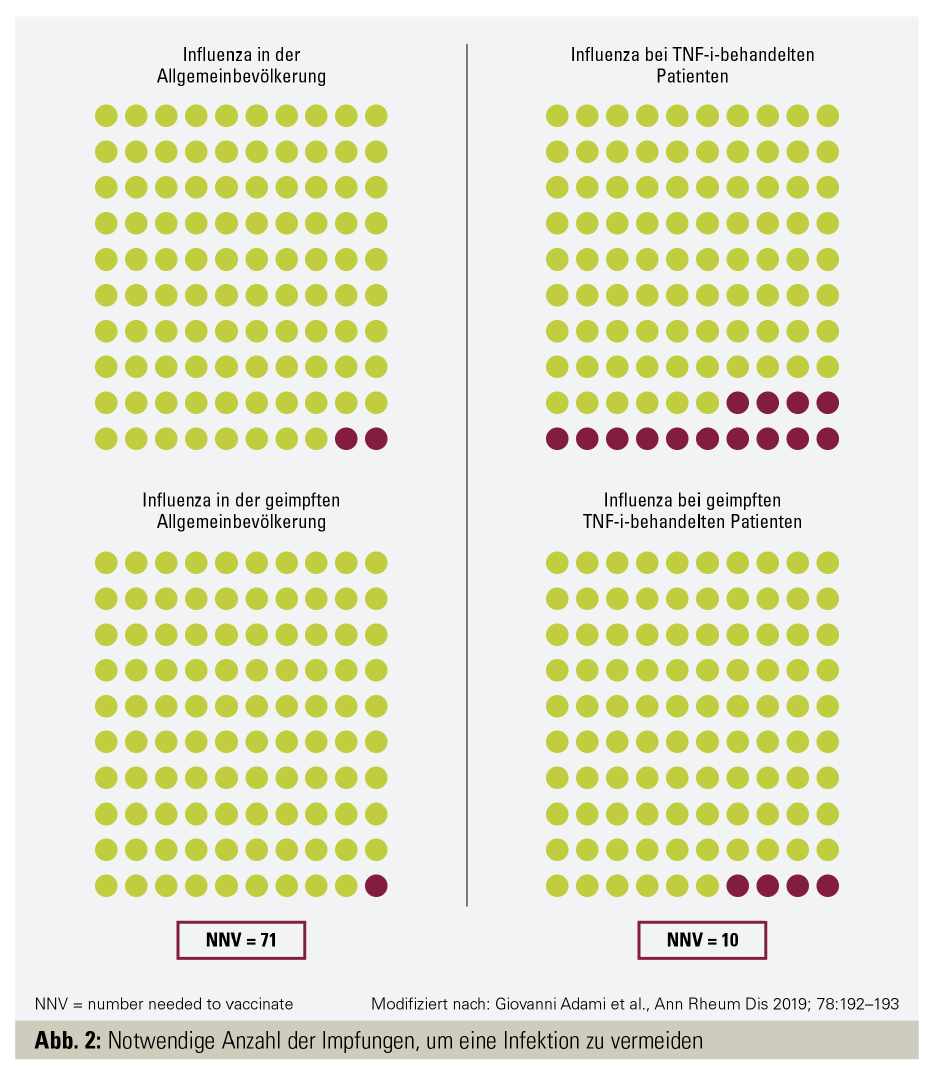
In der Studie von Adami et al. wurde untersucht, wie hoch die genaue Anzahl der Impfungen ist (number needed to vaccinate, NNV), um eine Infektion mit Influenza zu vermeiden. Die Datenanalyse ergab bei den Patienten mit RA und TNFi eine NNV von 10 bzw. einen Kostenfaktor von ca. 165 Euro.16 Als Vergleich dazu: Der Kostenfaktor für die Gesamtpopulation beträgt 1.174 Euro und die NNV ist 71 (Abb. 2).
Herpes Zoster: Seit Etablierung der JAK-Inhibitoren bei RA wird zunehmend das Risiko einer Herpes-Zoster-Infektion thematisiert. Mit dem rekombinanten adjuventierten Wirkprinzip der neuen Totimpfung zeigte sich eine 90%ige Wirksamkeit. Diese wird in Deutschland bei RA-Patienten über 50 Jahren empfohlen. Da dieser Totimpfstoff auch Adjuvans beinhaltet, wurde die Sorge geäußert, dass dieser auch eine RA-Reaktivierung auslösen könnte. Eine Gruppe aus Boston hat 300 Patienten nach der Impfung untersucht.17 Nach der ersten Impfdosis wurde bei 3,00 % (n = 9) und nach der zweiten bei 2,86 % (n = 4) eine Reaktivierung der Grundkrankheit beobachtet. Alle Nebenwirkungen wurden als mild eingestuft, und eine klinische Observation war nicht notwendig. Die vorbestehende immunsuppressive Therapie wurde nicht geändert (bei Einzelfällen eine passagere Dosissteigerung).