Evidenzbasierte Therapie des Schlaganfalls
Unter der Prämisse „time is brain“ basiert die Behandlung des akuten ischämischen Schlaganfalls (AIS) auf den beiden Säulen der intravenösen Thrombolyse (IVT) und der mechanischen Thrombektomie (MT). In den vergangenen Jahren haben mehrere klinische Studien neue Evidenz für beide Therapieverfahren erbracht. Erweiterte Bildgebungsverfahren (Tab.) spielen dabei eine zentrale Rolle, einerseits bei der zeitlichen Zuordnung eines ischämischen Geschehens, andererseits bei unklarem Symptombeginn zur Darstellung von potenziell rettbarem Hirngewebe (= Penumbra).
Intravenöse Thrombolyse
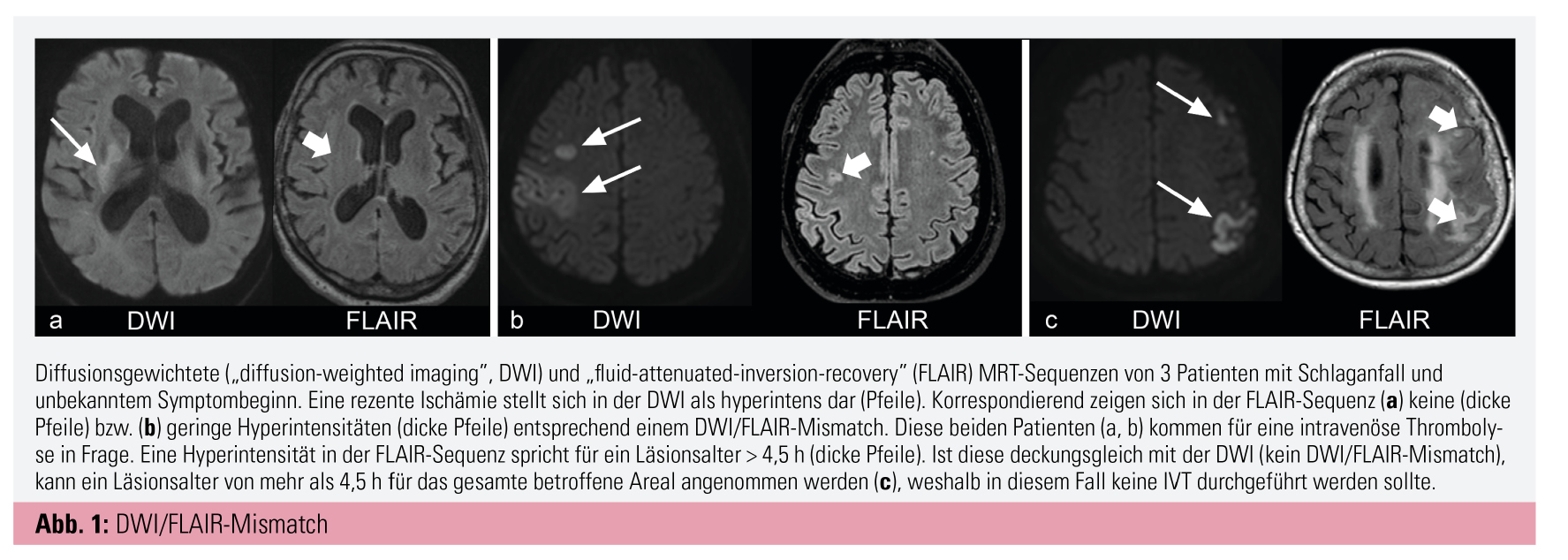
Innerhalb eines Zeitfensters von ≤ 4,5 h nach Symptombeginn ist die IVT mit Alteplase (Dosis: 0,9 mg/kg Körpergewicht) die Standardbehandlung für alle Patienten mit einem AIS.1, 2 Bei Patienten mit unklarem Onset ermöglicht die MRT mittels der Detektion eines Mismatch zwischen einer „Diffusion-weighted imaging“-(DWI-) und einer „Fluid-attenuated inversion recovery“-(FLAIR-)Sequenz die zeitliche Zuordnung des ischämischen Geschehens (Abb. 1).3, 4 Ein DWI/FLAIR-Mismatch ist beweisend für ein frisches (≤ 4,5 h altes) Infarktareal. Diesbezüglich konnte die WAKE-UP-Studie einen signifikanten klinischen Nutzen der IVT mit Alteplase verglichen zu Placebo bei Patienten mit unklarem Symptombeginn zeigen.5 In dieser Studie wurde ein klinisch gutes Ergebnis nach 90 Tagen – definiert als ein „Modified Rankin Scale“-(mRS-)Wert von 0–1 – bei 53,5 % der Patienten in der IVT-Gruppe verglichen zu 41,8 % in der Placebo-Gruppe erreicht. Allerdings fanden sich nominell häufiger symptomatische intrazerebrale Blutungen in der IVT-Gruppe (2 % vs. 0,4 %). Auch bezogen auf die IVT im erweiterten Zeitfenster (> 4,5–9 h nach Symptombeginn) konnten mittels erweiterter Bildgebung und der Darstellung der Penumbra (Abb. 2) positive Signale aus früheren Kohortenstudien bestätigt werden.6, 7 Diesbezüglich zeigte die EXTEND-Studie8, bei der Patienten mittels Perfusions-MRT bzw. Perfusions-CT und durch Nachweis von potenziell rettbarem Hirngewebe im späten bzw. unbekannten Zeitfenster eingeschlossen wurden, ein klinisch gutes Ergebnis nach 90 Tagen (mRS 0–1) bei 35,4 % in der IVT-Gruppe (Alteplase) gegenüber 29,5 % in der Placebo-Gruppe. Korrigiert für Alter und „National Institute of Health Stroke Scale/Score“ (NIHSS) ergab sich daraus ein Chancenverhältnis für ein gutes klinisches Ergebnis von 1,44 (95%-KI 1,01–2,06, p = 0,04) bei Behandlung mittels IVT mit Alteplase. Auch in dieser Studie waren symptomatische intrazerebrale Blutungen in der IVT-Gruppe signifikant häufiger als unter Placebo (6,2 % vs. 0,9 %).
Als Alternative zur Alteplase bei der IVT ist derzeit die Verwendung von Tenecteplase Gegenstand klinischer Studien. Tenecteplase bietet Vorteile in der Anwendung, da aufgrund der höheren Eliminationshalbwertszeit die Bolusgabe ausreicht und durch die höhere Fibrinspezifität möglicherweise auch bessere Rekanalisierungsergebnisse bei entsprechender Thrombusbeschaffenheit erreicht werden könnten. Diesbezüglich sind die Ergebnisse der EXTEND-IA-TNK-Studie9 als vielversprechend zu werten. Dabei zeigte sich bei der IVT innerhalb von 4,5 h nach Symptombeginn und Nachweis einer Penumbra bei Verwendung von Tenecteplase (Dosis: 0,25 mg/kg Körpergewicht) verglichen zur Alteplase (Dosis: 0,9 mg/kg Körpergewicht) ein signifikanter Vorteil hinsichtlich des klinischen Outcomes nach 90 Tagen (OR 1,7; 95%-KI 1,0–2,8; p = 0,04). Auch eine rezente Metaanalyse10 zeigte die Nichtunterlegenheit im klinischen Outcome bei der Verwendung von Tenecteplase in unterschiedlichen Dosierungen im Vergleich zur Alteplase im Zeitfenster von zumindest ≤ 6 h. Trotz dieser Ergebnisse ist die Datenlage für die Anwendung von Tenecteplase in der klinischen Routine, insbesondere hinsichtlich der optimalen Dosierung (0,1 mg/kg, 0,25 mg/kg, 0,4 mg/kg), noch nicht ausreichend.
Mechanische Thrombektomie
Bei Verschluss einer großen intrakraniellen Arterie kann das Thrombusmaterial endovaskulär mittels MT entfernt werden (Abb. 3). Dieser Eingriff wird in Österreich in spezialisierten Zentren je nach vorhandener Expertise von interventionellen Radiologen, Neuroradiologen bzw. Neurochirurgen durchgeführt. Dabei kommen folgende unterschiedliche Techniken zur Anwendung:
a) Stent-Retriever zur Thrombusbergung,
b) direkte Thrombusaspiration über einen großlumigen Katheter oder
c) Kombination aus beiden Verfahren.11
Additiv kann mittels ballonokkludierbarem Führungskatheter der Blutfluss in der A. carotis interna unterbrochen werden, um das Risiko einer antegraden Embolisation durch die Manipulationen zu verringern. Welche dieser Techniken die besten Resultate hinsichtlich Effizienz und Sicherheit bietet, ist weiterhin Gegenstand klinischer Studien.
Die MT ist die etablierte Standardbehandlung bei Patienten mit Verschluss einer großen intrakraniellen Arterie (A. carotis interna, ACI; A. cerebri media im Hauptstamm, M1-Segment) innerhalb von 6–12 h nach Symptombeginn, sowohl nach erfolgter IVT als auch bei Kontraindikationen zur IVT.12 Besonders eindeutig ist der Nutzen der MT bei der Behandlung innerhalb von 6 h nach Symptombeginn, wenn noch kein ausgedehnter Infarkt vorliegt (< 70 ml Infarktvolumen). Die Einschätzung der Ausdehnung der ischämischen Läsion erfolgte in den großen randomisierten Studien13–17 zumeist mittels des Alberta Stroke Program Early CT Score (ASPECTS), der Werte zwischen 10 (keine Infarktzeichen) und 0 (Infarktzeichen im gesamten Mediastromgebiet) annehmen kann. In der Mehrzahl der klinischen Studien zur MT wurden Patienten mit ASPECTS < 6 ausgeschlossen. Diesbezüglich schlägt die „European Society for Minimally Invasive Neurological Therapy“ (ESMINT) in den rezent überarbeiteten „European Recommendations on Organisation of Interventional Care in Acute Stroke“ (EROICAS) eine Behandlung mittels IVT und MT auf individueller Basis und in ausgewählten Fällen auch bei ASPECTS < 6 und einem Infarktkern von > 70 ml vor, wobei der Empfehlungsgrad hier als Expertenmeinung ausgegeben wurde.18 Auch dabei wird auf das Hinzuziehen von erweiterten Bildgebungsmethoden zur Darstellung der Penumbra als Entscheidungskriterium hingewiesen.
Auch im erweiterten Zeitfenster bis 24 h nach Symptombeginn bzw. bei unbekanntem Symptombeginn konnten DAWN19 und DEFUSE-320 die Effektivität der MT unter Anwendung erweiterter Bildgebungsmethoden zur Patientenselektion zeigen. In diesen beiden Studien wurden ausschließlich Patienten mit einem Verschluss der intrakraniellen ACI oder im M1-Segment aufgenommen. In DAWN erfolgte der Einschluss beim Nachweis eines Missverhältnisses zwischen klinischer Symptomatik und Infarktvolumen unter Berücksichtigung des Patientenalters. Die Studie wurde nach einer Zwischenanalyse, in der eine klare Überlegenheit der MT + IVT gegenüber der IVT allein gezeigt werden konnte, vorzeitig beendet. Der Anteil der nach 90 Tagen funktionell unabhängigen Patienten (mRS 0–2) lag in der MT+IVT-Gruppe bei 49 % verglichen mit 13 % in der IVT-Gruppe. Der Einschluss in DEFUSE-3 erfolgte mittels Nachweises einer Penumbra. Auch diese Studie zeigte vergleichbare Ergebnisse, wobei ein mRS von 0–2 nach 90 Tagen bei 45 % der Patienten in der MT+IVT-Gruppe und lediglich bei 17 % in der IVT-Gruppe erreicht wurde (RR 2,67, 95%-KI 1,6–4,48; p < 0,001). In beiden Studien zeigte sich kein signifikanter Unterschied zwischen den Gruppen hinsichtlich symptomatischer intrakranieller Blutungen.
Verschlüsse im M2-Segment: Die Behandlung von Verschlüssen im M2-Segment ist derzeit umstritten. Obwohl Patienten in einzelne randomisierte Studien eingeschlossen werden konnten13, 16 und eine Subgruppen-Analyse12 vielversprechende Ergebnisse zugunsten der MT zeigte, ist die Datenlage derzeit nicht ausreichend, um eine eindeutige Empfehlung daraus abzuleiten. Trotzdem spricht sich die ESMINT diesbezüglich für eine Behandlung mittels MT + IVT mit dem Empfehlungsgrad einer Expertenmeinung aus.18
NIHSS ≤ 5: Keine belastbaren Daten liegen derzeit für die MT bei Patienten mit einem niedrigen NIHSS-Wert (≤ 5) vor. Allerdings wird bei Patienten mit invalidisierend erscheinender Symptomatik (signifikantes motorisches Defizit, Aphasie oder Hemianopsie) und bei klinischer Verschlechterung trotz IVT von der ESMINT die MT empfohlen.18 Das Patientenalter stellt keinen Exklusionsgrund für die MT dar, vielmehr profitieren Patienten, welche vor dem AIS funktionell unabhängig waren (mRS 0–2), von einer MT.19, 20 Zur Vervollständigung muss an dieser Stelle noch erwähnt werden, dass für die MT in der hinteren Strombahn keine belastbaren Daten aus randomisierten Studien vorliegen.21 Trotzdem empfiehlt die ESMINT, in Analogie zur vorderen Zirkulation den Therapieansatz der IVT und MT ernsthaft in Betracht zu ziehen.18
Resümee
Mittels erweiterter Bildgebung kann die Indikation für die IVT und MT auf ein breiteres Zeitfenster ausgedehnt und somit einer größeren Patientengruppe angeboten werden. Von immanenter Bedeutung bleibt der Leitspruch „time is brain“, welcher ein reibungsloses Zusammenspiel sämtlicher beteiligter Fachdisziplinen verlangt, um das bestmögliche Outcome für die betroffenen Patienten zu erreichen.