Highlights zur Hypertonie
Therapierefraktäre Hypertonie
Professor Grassi präsentierte eindrucksvolle Daten, dass die therapierefraktäre Hypertonie mit einer ausgeprägten Sympathikusüberaktivierung einhergeht, wobei es Verbindungen zur Insulinresistenz und zum Aldosteronsystem gibt.
Medikamentöse Therapie der therapierefraktären Hypertonie: In der ASPIRANT-Studie konnten die Ergebnisse von etwa 10 Observationsstudien nachvollzogen werden, die zeigen, dass Spironolacton in diesem Kollektiv eine wirksame Behandlungsmöglichkeit darstellt: 117 Patienten mit therapierefraktärer Hypertonie wurden zu 25 mg Spironolacton oder Placebo randomisiert. Ausschlussgründe waren u. a. GFR < 40 ml/min und Hyper – kaliämie > 5,4 mmol/l, die Patienten nahmen im Mittel 4,5 andere Antihypertensiva ein. Die Blutdrucksenkung (24-Stunden-Durchschnitt) betrug nach 8 Wochen 13,8/4,2 (Spironolacton) vs. 4,0/3,2 (Placebo) mmHg. Der Blutdruckabfall war bei niedrigerem Ausgangs- Kaliumspiegel, niedrigerer Reninaktivi – tät sowie höherer Aldosteron-Renin-Ratio höher.
Interventionelle Therapie der therapierefraktären Hypertonie: Professor Krum ging der Frage nach, ob die interventionelle renale Sympathikusdenervierung (RSD) eine Hauptrolle in der Behandlung übernehmen soll. Durch diese Intervention kommt es zu einer bedeutsamen (etwa 30 mmHg systolisch nach 6 Monaten) und anhaltenden (zumindest 3 Jahre) Blutdrucksenkung bei 80–90 % der Patienten. Als Prädiktoren der Blutdrucksenkung durch RSD haben sich bisher das Ausmaß der Sympathikusaktivierung sowie das Vorhandensein eines Diabetes mellitus herausgestellt. Interessanterweise verbessert sich auch der Zuckerstoffwechsel (Abnahme der Nüchternglukose um etwa 10 mg/dl nach 1 Monat) durch die Intervention. Dr. Lambert aus dem AKH Linz präsentierte Ergebnisse der RSD, gemessen mit 24-Stunden- Blutdruckmonitoring bei 25 Patienten. Während die Reduktion des Ordinationsblutdrucks von 178/97 mmHg auf 157/86 mmHg nach 3 Monaten signifikant war, zeigte sich im 24-Stunden-Monitoring nur ein Trend (Reduktion von 154/89 mmHg auf 145/85 mmHg).
Die Baroreflex-Aktivierung (elektrische Stimulation am Karotissinus) zeigt nach bis zu 5 Jahren eine anhaltende Blutdrucksenkung um bis zu 50/30 mmHg, 81 % der Patienten sprechen auf die Behandlung an. Das Gerät steht derzeit aber nicht zur Verfügung.
Neue Antihypertensiva in der Pipeline?
Aldosteronsynthase-Inhibitoren: Es ist bekannt, dass Aldosteron neben der Natriumretention und Kaliumausscheidung wesentliche proinflammatorische und profibrotische Effekte zur Wirkung bringt, wodurch sich die Assoziation mit kardiovaskulären Erkrankungen (wie Hypertonie oder Herzinsuffizienz) gut erklären lässt. Die Mineralokortikoidrezeptor-Antagonisten (MRA) (Spironolakton, Eplerenon; nichtsteroidale Antagonisten werden gerade entwickelt) spielen in der Behandlung der Hypertonie eine bedeutende Rolle, allerdings steigen aufgrund gegenregulatorischer Mechanismen die Renin- und Aldosteronspiegel stark an, was die Wirkung auf lange Sicht beeinträchtigen könnte. Dazu kommen Aldosteroneffekte, die nicht über den Mineralokortikoidrezeptor vermittelt werden und daher auch nicht durch MRA blockiert werden können. Inhibitoren der Aldosteronsynthase könnten hier nützlich sein, der erste (LCI 699) wurde bereits bei Patienten mit Hyperaldosteronismus getestet. Allerdings wird neben der Synthese von Aldosteron auch die Kortisolsynthese gehemmt. Der Kortisol-Präkursor 11-Deoxykortisol steigt an, der Kortisolspiegel selbst wird durch einen kompensatorischen Anstieg von ACTH konstant gehalten. Bei den Patienten mit Hyperaldosteronismus kam es zu einem deutlichen Anstieg des Kaliumspiegels, aber nur zu einer geringen Blutdrucksenkung (–4/–2 mmHg im 24-Stunden-Durchschnitt). In einer Phase-IIStudie an Patienten mit essenzieller Hypertonie senkte LCI 699 den Blutdruck signifikant, aber geringer als Eplerenon. Als denkbare Indikationen für Aldosteronsynthase- Hemmer kommen neben der (therapierefraktären) Hypertonie auch andere Erkrankungen mit erhöhtem Aldosteronspiegel (Herzinsuffizienz, metabolisches Syndrom, aber auch Leberzirrhose) in Betracht. Ein potenzielles Problem ist laut Prof. Zannad die Tatsache, dass die kardialen Mineralokortikoidrezeptoren (im Gegensatz zu den nichtkardialen MR) nicht nur durch Aldosteron, sondern auch durch Kortisol stimuliert werden können.
Duale Inhibitoren der neutralen Endopeptidase (Neprilysin) und des RAAS: Die neutrale Endopeptidase (NEP) vermittelt den Abbau der körpereigenen natriuretischen Peptide (ANP, BNP), ihre Hemmung führt zu höheren Spiegeln von ANP und BNP mit vermehrter Vasodilatation, Natriumausscheidung und antihypertrophen Effekten. Zugleich hemmt die NEP auch den Bradykinin-Abbau. Die erste Substanz aus dieser Gruppe, Omapatrilat, wies neben der Hemmung der NEP eine ACE-hemmende Wirkung auf. Trotz der vielversprechenden Blutdrucksenkung musste die klinische Entwicklung der Substanz aufgrund eines zu häufigen Auftretens von Angioödemen eingestellt werden, was durch die dreifache Hemmung des Bradykinin- Abbaus (ACE-Hemmung, NEP-Hemmung, Aminopeptidase-Hemmung) erklärt wurde. Eine neu entwickelte Substanz, LCZ-696, weist neben der NEP-Hemmung eine Angiotensinrezeptor-Blockade auf (somit könnte das gehäufte Auftreten von Angioödemen verhindert werden). In einer randomisierten doppelblinden Studie mit 1.328 Hypertonikern, geleitet von Prof. Ruilope, zeigte LCZ-696 eine deutlich stärkere Blutdrucksenkung als die ARB-Muttersubstanz Valsartan und als die NEP-hemmende Muttersubstanz AHU-377. Interessanterweise zeigte sich unter LCZ-696 auch eine stärkere Senkung des Pulsdrucks (der ein Surrogatparameter für die Gefäßsteifigkeit und ein bedeutender kardiovaskulärer Risikomarker ist) als unter Valsartan. Es kam auch zu keinem vermehrten Auftreten von Angioödemen. Ob das Konzept der NEP-Hemmung auch bei sys tolischer oder diastolischer Herzinsuffizienz vorteilhaft ist, wird derzeit in der PARADIGM-HF- und in der PARAMOUNT-Studie geprüft.
„Pro & Contra“-Sitzungen
Management der atherosklero tischen Nierenarterienstenose
„Nierenarterien-Stents sind immer noch gerechtfertigt“ – Pro: Im Referat „Pro Stenting“ wurde von Prof. Beutler argumentiert, dass die Einschlusskriterien der beiden großen, zuletzt publizierten Studien STAR und ASTRAL den Einschluss von Patienten mit vermutlich nicht-signifikanten Stenosen erlaubten, der Einschluss von Patienten, die definitiv eine Katheterintervention benötigten, aber nicht möglich war (ASTRAL), wodurch der Effekt der Intervention wahrscheinlich unterschätzt wurde. Als Vorteile der Intervention wurde angeführt, dass die Zahl der Antihypertensiva reduziert werden kann, dass die Wirkung der ACEHemmer nach der Intervention besser sei, dass das Wiederauftreten des „Flash“-Lungenödems reduziert wird und dass die Kontrolle einer bestehenden Herzinsuffizienz verbessert wird.
„Nierenarterien-Stents sind immer noch gerechtfertigt“ – Contra: Im Referat „Contra Stenting“ wurde von Prof. Plouin argumentiert, dass die Blutdruckkontrolle in den großen Studien nicht besser wurde, dass Patienten mit atherosklerotischer Nierenarterienstenose meist an generalisierter Atherosklerose, Arteriosklerose ( systolische Hypertonie) und auch an intrarenaler Gefäßsklerose leiden (und dass diese Probleme durch einen Stent in einer Nierenarterie nicht lösbar sind) und dass bei der Intervention schwere Komplikationen auftreten können. Eine große Studie, die auf renale und kardiovaskuläre Endpunkte abzielt (CORAL-Studie), wird noch bis 2012 laufen.
Fazit: Beide Sprecher waren sich dann einig, dass bei Patienten mit therapierefraktärer Hypertonie die Suche nach einer Nierenarterienstenose Sinn macht. Eine interventionelle Behandlung erscheint besonders bei „Flash“- Lungenödem, einer Abnahme von Nierengröße oder Nierenfunktion und bei einer Unverträglichkeit für ACE-Hemmer bzw. Angiotensinrezeptorblocker sinnvoll. Im Übrigen sollten alle Patienten mit atherosklerotischer Nierenarterienstenose konsequent medikamentös behandelt werden, wobei insbesondere Aspirin, Statine und RAAS-Hemmer empfohlen werden.
Blutdruckzielwerte bei Diabetikern
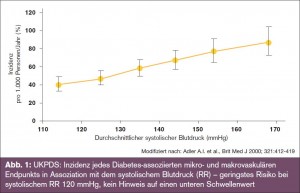
„Der Zielblutdruck von Diabetikern ist < 130 mmHg“ – Pro: Als Argumente für eine Senkung des systolischen Blutdrucks < 130 mmHg bei Diabetikern wurde von Prof. Ryden neben den Empfehlungen der „alten“ Guidelines (JNCVII und ESC 2007) angeführt, dass eine kontinuierliche Beziehung zwischen Blutdruckhöhe und kardiovaskulären Ereignissen besteht, dass eine Nachanalyse der UKPDS-Studie einen Vorteil für niedrigere Blutdruckwerte gezeigt hat (ohne eindeutigen unteren Schwellenwert) und dass man ambitionierte Ziele wählen sollte, um eine bessere Blutdruckkontrolle zu erreichen (> Abb. 1).
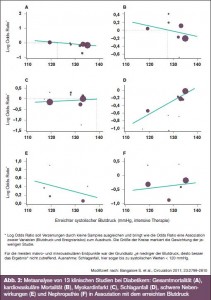
„Der Zielblutdruck von Diabetikern ist < 130 mmHg“ – Contra: Gegen eine Blutdrucksenkung < 130 mmHg sprechen laut Prof. Messerli die Ergebnisse rezenter Studien (ACCORD: kein Vorteil, aber vermehrte renale Funktionsstörungen; INVEST: Vorteil nur hinsichtlich Insult, nicht aber hinsichtlich Myokardinfarkt; PROFESS: Rezidivinsulte vermehrt bei einem RR < 120 mmHg). In der ROADMAP-Studie war die kardiovaskuläre Mortalität bei Blutdruckwerten < 126 mmHg deutlich erhöht, ähnlich auch in der ONTARGET-Studie („JKurven- Phänomen“) (> Abb. 2).
Fazit: Übereinstimmung erzielte man dabei, dass die Blutdruckkontrolle bei den meisten Diabetikern mangelhaft ist. Die neuesten Guidelines sind mit ihren Empfehlungen vorsichtig: Die Europäische Hypertoniegesellschaft empfiehlt 2009 einen Zielbereich von 130–139/80–85 mmHg, idealerweise nahe der niedrigeren Grenzwerte. Die Amerikanische Diabetesgesellschaft empfiehlt 2011, dass ein Blutdruckziel < 130 mmHg systolisch für die meisten Diabetiker angezeigt ist und dass bei bestimmten Patientencharakteristika höhere oder niedrigere systolische Zielwerte möglich sind. Bei den niedrigen Zielwerten ist wohl an jüngere Patienten ohne begleitende generalisierte Atherosklerose, insbesondere koronare Herzkrankheit zu denken.