Lokoablative Therapie
Die Radiofrequenzablation (RFA) wird von der European Association for the Study of the Liver (EASL) als Erstlinientherapie für das „early“ HCC empfohlen. Ausgenommen davon sind Patienten mit einem solitären HCC mit sehr guter Leberfunktion, bei denen weiterhin eine Resektion empfohlen wird. Die RFA kann auch bei singulären HCCs < 2 cm („very early“ HCC) als Alternative zur Resektion eingesetzt werden.
Prinzip: Bei der RFA werden Ionen in der Umgebung der RFA-Sonde durch hochfrequenten Wechselstrom in Schwingung versetzt. Die dadurch erzeugte Reibung führt zu einer Gewebserhitzung um die Sondenspitze. Ab einer Temperatur von ca. 60 °C kommt es zu einer histologisch nachweisbaren Koagulationsnekrose. Das zerstörte Gewebe wird von körpereigenen Zellen abgeräumt und durch narbengewebe ersetzt.
Ziel der RFA ist – in Analogie zur chirurgischen Resektion (R0) – die Zerstörung sämtlicher Tumorzellen (A0).
Technik: Technisch unterscheidet man zwischen monopolaren und multipolaren Systemen. Bei monopolaren Systemen fließt der Strom innerhalb des Patienten zwischen einer nicht isolierten Sondenspitze und einer Hautelektrode.
Verschiedene nadelähnliche und schirmartig ausfahrbare Sondendesigns sind erhältlich. Um die nekrose noch weiter zu vergrößern, werden Sonden durch einen internen Wasserkreislauf gekühlt und/oder parallele Elektroden fix auf einem Schaft gekoppelt. Weiters kann durch die kontinuierliche kontrollierte Injektion von Kochsalzlösung über die RFA-Sonden ein Austrocknen des Gewebes verhindert und dadurch das Ablationsareal vergrößert werden. Vorteil der parenchymsparenden RFA gegenüber der Resektion ist die mehrmalige Wiederholbarkeit aufgrund der geringen Belastung der Patienten und der niedrigen Komplikationsraten. Außerdem können auch zentrale Lebertumoren, bei denen eine Hemihepatektomie erforderlich wäre, mit wenig Parenchymverlust behandelt werden.
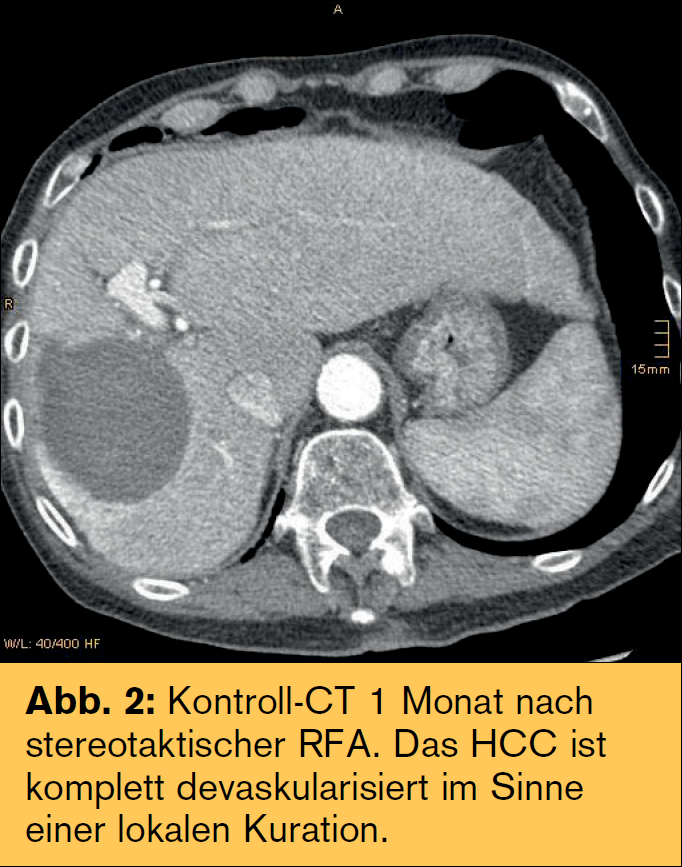
Sondenpositionierung: Die RFA-Sonden werden üblicherweise bildgesteuert perkutan positioniert. Grundvoraussetzung ist die Lokalisierung der Läsion während der Sondenpositionierung. Bei Ultraschall-(US)-gezielten Punktionen wird die Sonde unter Echtzeit-Bildgebung vorgeschoben. Allerdings ist die Sondenspitze mittels US im Unterschied zum CT – abhängig von Schallbedingungen und Erfahrung – oft schwer identifizierbar. Für viele Läsionen sind aufgrund anatomischer Gegebenheiten (subphrenische Läsionen, Hohlorgane, Lunge, Rippen) doppelt angulierte Zugänge erforderlich. Dadurch limitiert bzw. erschwert sich der Eingriff insbesondere bei der CT-gezielten Technik. Die in Innsbruck entwickelte stereotaktische RFA (SRFA) erlaubt die Planung von mehreren überlappenden nekrosearealen auf Basis von dreidimensionalen multimodalen Datensätzen und die präzise Umsetzung im Patienten. Dadurch können auch Tumoren mit mehr als 10 cm Durchmesser komplett zerstört werden.
Morbidität und Mortalität: Prinzipiell handelt es sich bei der RFA um eine komplikationsarme Therapie. In einer Multicenterstudie mit 2.300 Patienten und 3.554 Tumoren lagen die Komplikationsrate bei 2,2 % und die Mortalität bei 0,3 % (Livraghi, Radiology 2003). In einer Metaanalyse bei 3.670 Patienten wurde eine Komplikationsrate von 8,9 % und eine Mortalitätsrate von 0,5 % errechnet (Mulier, Br J Surg 2002). Besonders zu achten ist auf einen ausreichend weiten Sicherheitsabstand zu umgebenden vitalen Strukturen. Am häufigsten sind Blutungen und Pleuraergüsse. Selten sind Abszesse, Gallengangverletzungen und Schädigungen von nachbarorganen. Insbesondere bei Patienten mit eingeschränkter Leberfunktion besteht ein höheres Risiko für ein Leberversagen nach RFA. Daher wird – in Analogie zur Resektion – eine Volumetrie vor RFA von großen Lebertumoren zur Abschätzung des verbleibenden Lebervolumens empfohlen.
Ergebnisse der rFA bei HCC: In einer prospektiv- randomisierten Studie (Chen, Ann Surg 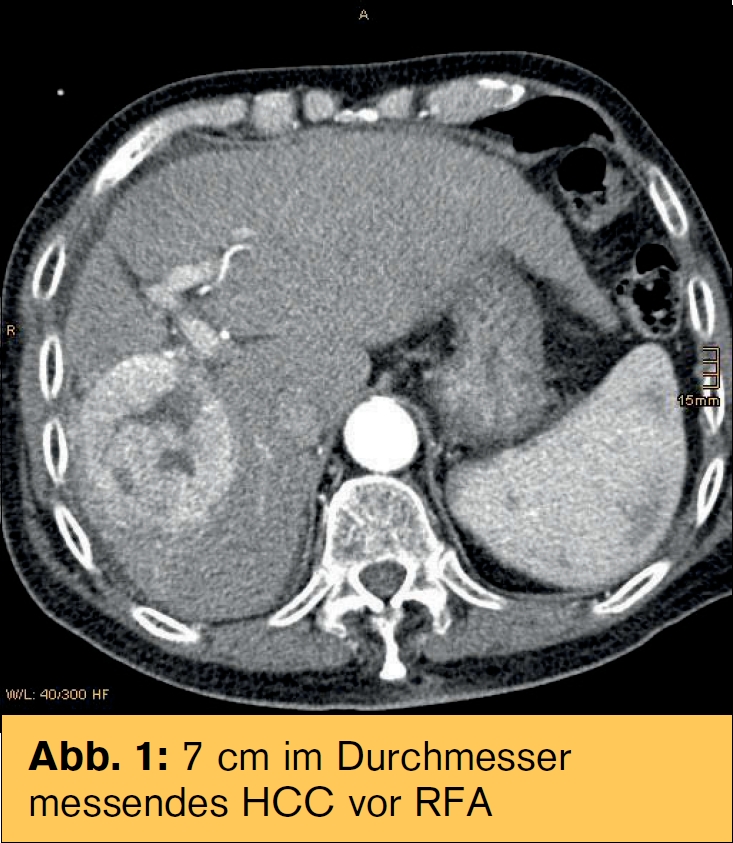 2006) bei 180 Patienten mit solitärem HCC < 5 cm wurde die perkutane lokal ablative Therapie mit der Resektion verglichen. Dabei zeigten sich 1-, 2-, 3-, und 4-Jahres-Überlebensraten nach RFA von 95,8 %, 82,1 %, 71,4 % bzw. 67,9 % und nach Resektion von 93,3 %, 82,3 %, 73,4 % bzw. 64,0 %. Statistisch ergab sich kein Unterschied zwischen den zwei Behandlungsmethoden. Im Vergleich zur Chirurgie ist die RFA weniger invasiv und mit einer geringeren Komplikationsrate und geringeren Kosten verbunden. Aufgrund der vergleichbaren Überlebensdaten sollte die RFA bei einzelnen operablen HCCs ≤ 2,0 cm als Mittel der 1. Wahl angewendet werden (Livraghi, Hepatology 2007). Die 5-Jahres-Überlebensraten nach Resektion liegen bei 60–70 % (Poon, Clin Oncol 2000; Figueras J., Am Coll Surg 2000; Cha, Ann Surg 2003), die nach RFA bei inoperablen HCCs bei ca. 40 % (Machi, World J Surgery 2005; Chen, Clin Radiol 2005).
2006) bei 180 Patienten mit solitärem HCC < 5 cm wurde die perkutane lokal ablative Therapie mit der Resektion verglichen. Dabei zeigten sich 1-, 2-, 3-, und 4-Jahres-Überlebensraten nach RFA von 95,8 %, 82,1 %, 71,4 % bzw. 67,9 % und nach Resektion von 93,3 %, 82,3 %, 73,4 % bzw. 64,0 %. Statistisch ergab sich kein Unterschied zwischen den zwei Behandlungsmethoden. Im Vergleich zur Chirurgie ist die RFA weniger invasiv und mit einer geringeren Komplikationsrate und geringeren Kosten verbunden. Aufgrund der vergleichbaren Überlebensdaten sollte die RFA bei einzelnen operablen HCCs ≤ 2,0 cm als Mittel der 1. Wahl angewendet werden (Livraghi, Hepatology 2007). Die 5-Jahres-Überlebensraten nach Resektion liegen bei 60–70 % (Poon, Clin Oncol 2000; Figueras J., Am Coll Surg 2000; Cha, Ann Surg 2003), die nach RFA bei inoperablen HCCs bei ca. 40 % (Machi, World J Surgery 2005; Chen, Clin Radiol 2005).
Livraghi et al. (Radiology 1999) konnten einen Vorteil der RFA gegenüber der Alkoholinstillation im Rahmen einer randomisierten Studie nachweisen. Bei 86 Patienten mit 112 HCCs ≤ 3 cm wurde die Effektivität der RFA mit der Alkoholinstillation verglichen. Mittels RFA konnte bei 90 % eine komplette Ablation erzielt werden (1,2 Sitzungen pro Tumor), mittels Alkoholinstillation lediglich bei 80 % (4,8 Sitzungen pro Tumor). Im Unterschied zur transarteriellen Chemoembolisation (TACE) lässt sich mittels RFA eine lokale Kuration erzielen.
Indikationsstellung: Die Indikationsstellung richtet sich nach der BCLC-Klassifikation (Barcelona Clinic Liver Cancer Classification). Bei Patienten mit nicht-resektablem BCLC-0-ATumoren (frühes Stadium: einzelne Tumoren > 2 cm oder 3 Tumoren < 3 cm, ECOG-0, Child A/B) gelten die RFA und die perkutane Alkoholinstillation als Standard, wobei die RFA als Methode der ersten Wahl der perkutanen Alkoholinstillation vorzuziehen ist. Andere ablative Therapien wie Mikrowelle und Kryotherapie werden derzeit in Studien untersucht. Aufgrund der lokalen Kuration bei > 90 % können bei BCLC-0-Tumoren < 2 cm (sehr frühes Stadium) sowohl die RFA als auch die perkutane Alkoholinstillation als Alternative zur Resektion eingesetzt werden.
Die Resektion, die mit einer Mortalität von 2–3 % bei Leberzirrhose vergesellschaftet ist, wird nach den neuen EASL-Richtlinien (Journal of Hepatology 2012; 56:908-943) als Erstlinientherapie bei Patienten mit solitären Tumoren und sehr guter Leberfunktion empfohlen (normales Bilirubin, Thrombozyten > 100.000, Lebervenendruckgradient < 10 mmHg).
Neoadjuvante Therapie von Patienten auf der Warteliste für die Lebertransplantation: Die Lebertransplantation gilt als Methode der ersten Wahl bei Patienten mit einem singulären HCC mit maximal 5 cm Durchmesser oder maximal 3 HCCs mit jeweils maximal 3 cm Durchmesser und einer eingeschränkten Leberfunktion. Über eine Erweiterung der Kriterien auf UCSF (einzelner Herd bis 6,5 cm, 2–3 Herde bis 4,5 cm oder Gesamtdurchmesser maximal 8 cm) oder „Up to seven“-Kriterien (Summe des Durchmesser des größten HCCs und der Anzahl der Tumore bis maximal 7) wird diskutiert. Falls die geschätzte Wartezeit bis zur Lebertransplantation 6 Monate übersteigt, werden als Überbrückung neoadjuvante Therapien zur Vermeidung einer Progression und damit einem Drop-out aus der Liste empfohlen. Aufgrund der Tatsache, dass die RFA im Vergleich zur TACE eine höhere Rate an kompletten nekrosen erzielt, wird diese als Methode der ersten Wahl empfohlen. Weitere Informationen und Videos über die stereotaktische RFA: http://sip.uki.at.
FACT-BOX
Die RFA ist eine minimal invasive, relativ nebenwirkungsarme Methode zur lokal kurativen Behandlung von Patienten mit nicht-resektablen „early“ HCCs.
Beim „very early“ HCC erzielt die konventionelle US-/CT-gezielte RFA mit der Resektion vergleichbare Überlebensraten bei geringerer Morbidität und Mortalität.
Die RFA ist die Methode der Wahl als Überbrückung zur Lebertransplantation. Mittels stereotaktischer RFA (SRFA) können Tumoren >10 cm lokal kurativ behandelt werden.
Der Autor bedankt sich bei folgenden Personen, die in die Entwicklung, den klinischen Einsatz bzw. die statistische Auswertung der Ergebnisse der 3-D-navigierten RFA involviert sind: Prof. W. Jaschke, Doz. G. Widmann, Dr. P. Kovacs, Dr. M. Haidu, Dr. P. Schullian, Prof. G. Bodner, Dr. M. Vogele, RT T. Lang, RT F. Schanda, RT M. Knoflach, RT C. Hinterleithner, RT M. Fasser, RT J. Mahlknecht, RT Y. Schlesinger, DI R. Stoffner, Prof. W. Vogel, Prof. I. Graziadei, Prof. H. Zoller, Dr. K. Nachbaur, Prof. R. Margreiter, Prof. H. Weiss, Prof. A. Klaus.