Medikamentöse Therapie der stabilen COPD – Aktualisierte GOLD-Empfehlungen* und neue Trends
Die COPD – chronisch-obstruktive Lungenerkrankung – ist durch eine persistierende, nicht vollständig reversible Einschränkung der Lungenfunktion charakterisiert, die üblicherweise progressiv fortschreitet. Kausal verantwortlich für das Krankheitsbild sind Noxen in Form von Partikeln oder Gasen, die eine verstärkte Entzündungs antwort in den Atemwegen und der Lunge hervorrufen. In der Folge kommt es zur Entzündung und Fib – rosierung der Luftwege mit Lumeneinengung, vergrößerter Atemwiderstand („small airway disease“) und zur Zerstörung des Lungenparenchyms selbst (Verlust des alveolären Attachments, Ver ringerung der elas tischen Rückstellkraft) mit/ohne Emphysembildung.
Als Hauptursache gilt Tabakrauch. Für die Differenzialdiagnostik ist jedoch daran zu denken, dass auch der Anteil an Nie-Rauchern beachtlich ist – die Daten der großen epidemiologischen Studie BOLD (Burden of Obstructive Lung Disease Study) zeigten einen Anteil von etwa 30 % unter den Personen mit Atemwegsobstruktion.
Epidemiologie: Man kann durchaus von einer Volkskrankheit globalen Ausmaßes sprechen. COPD ist eine führende Ursache von Morbidität und Mortalität weltweit, man geht man von etwa 600 Millionen Betroffenen aus. Die österreichischen BOLD-Daten zeigen eine Häufigkeit der Atemwegsobstruktion (FEV1/ FVC < 0,7) bei 26 % der Bevölkerung (jenseits des 40. Lj.) und eine Häufigkeit der behandlungspflichtigen COPD (GOLD-Stadium 2+) von 10 % (Schirnhofer et al., Chest 2007).
Man nimmt an, dass die ohnehin jetzt schon beträchtliche Krankheitslast, aber auch ökonomischen Last durch COPD durch die demographische Entwicklung und die voraussichtlich eher steigende Prävalenz der Risikofaktoren weiter zunehmen wird.
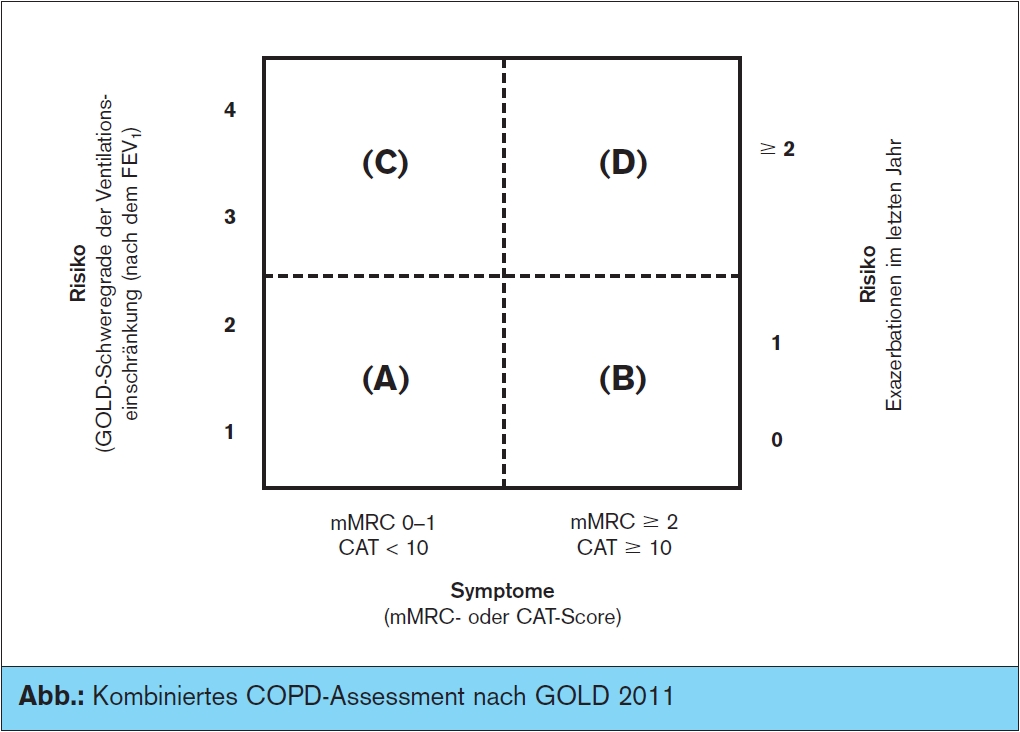
COPD-Assessment nach GOLD 2011
Die klinische Diagnose sollte bei allen Patienten in Betracht gezogen werden, die Atemnot/ Kurzatmigkeit (progressiver Verlauf, persistierend, unter Belastung verstärkt), chronischen Husten (kann intermittierend und auch unproduktiv sein) oder Auswurf (bei Husten) aufweisen und/oder eine Exposition zu Risikofaktoren in der Anamnese aufweisen. Unumgänglich für die Diagnostik ist die Spirometrie: ein FEV1/FVC-Wert < 0,7 bestätigt eine persistierende Einschränkung der Lungenfunktion und damit das Vorliegen einer COPD.
Kombiniertes Assessment von Ventilationseinschränkung, Symptomschwere und Exazerbationsrisiko: Neben der relativen Stagnation im Bereich der medikamentösen Therapie war ein großes Manko des COPDManagements in den vergangenen Jahren, dass die Schweregradeinteilung anhand der FEV1 nur unzureichend der Komplexität der Erkrankung und der Heterogenität des Ver- laufs, deren Ursachen nach wie vor im Dunkeln liegen, gerecht wird. Eine rationale Umwegstrategie gegen die dadurch bedingte strukturelle Unter- bzw. auch Übertherapie lautete, Phänotypen mit spezifischer Prognose oder therapeutischer Charakteristik zu differenzieren, d. h. ein einzelnes oder eine Kombination von Krankheitsattributen zu definieren, die Unterschiede zwischen Indivi – duen mit COPD beschreiben, die für die Prognose relevant sind (Symptomatik, Exazerbationsfrequenz, Therapieansprechen, Krankheitsprogression, Mortalität).
Ein wichtiger Aspekt der nun vorliegenden GOLD-Empfehlungen ist deshalb ein differenziertes Assessmentschema, das durch die Kombination der 3 Säulen Lungenfunktionseinschränkung, Symptomschwere und Exazerbationsrisiko eine Einteilung den Patienen 4 Risikokategorien erlaubt (> Abb.):
- Zunächst Symptom-Assessment: Hier fließen phänotypische Variablen wie Husten, Schleim, Engegefühl, Belastungsdyspnoe, Schlafqualität, Ausmaß der atemnotbedingten Alltagseinschränkungen etc. ein. Die Symptomschwere wird anhand von einfachen Tests der Therapieüberwachung und Prognoseabschätzung beurteilt: 1. der COPD Assessment Test (CAT), ein 8-Item-Test zur Gesundheitsstatuseinschränkung (catestonline.org) oder 2. der Modified British Medical Research Council (mMRC) Questionnaire zur Beurteilung der Atemnot (gute Vorhersagekraft des Mortalitätsrisikos). Die Patienten werden anhand eines dieser Tests zu 2 Gruppen zugeordnet, einer mit wenig Symptomen (mMRC 0–1 oder CAT < 10) und einer mit mehr Symptomen (mMRC ≥ 2 oder CAT ≥ 10).
- Assessment der Lungenfunktionseinschränkung: Die traditionellen 4 GOLDSchweregrade nach dem post-bronchodilatatorischen FEV1-Wert (Grad 1: ≥ 80 % pred., Grad 2: ≥ 50 bis < 80 % pred., Grad 3: ≥30 bis < 50 % pred., Grad 4: < 30 % pred.) werden in 2 übergeord nete Gruppen nach einem Cut-off von < 50 % pred. eingeteilt (Grade 1–2 bzw. Grade 3–4).
- Exazerbationsassessment: Den größten Einfluss auf die Prognose der Erkrankung und die Lebensqualität der Patienten haben intermittierende Verschlechterungen im Rahmen von akuten Exazerbationen. Sie werden daher bei den meisten aktuellen COPD-Therapiestudien als primärer oder sekundärer Endpunkt mit aufgenommen. Die diagnostische Erfassung der akuten Exazerbation und deren Gewichtung in Bezug auf den Schweregrad hat daher im Behandlungsverlauf die größte Bedeutung. Der Zuordnung des Exazerbationsrisikos nach GOLD 2011 erfolgt unter Berücksichtigung der Funk – tionsseinschränkung, mit der Rationale, dass ≥ 2 Exazerbationenin innerhalb des letzten Jahres oder ein FEV1 < 50 % ein hohes Risiko anzeigen.
In der Zusammenschau dieser 3 Bereiche erfolgt nun ein Zuordnung zu 4 abgstuften Patientenkategorien:
A: geringes Risiko mit weniger Symptomen
B: geringes Risiko mit mehr Symptomen
C: hohes Risiko mit weniger Symptomen
D: hohes Risiko mit mehr Symptomen
Ein solches Assessment-Schema unter Integration von phänotypischen Patientencharakteristika (als Einschlusskriterien von Studien gibt es den Bezug zum Outcome und damit der Evidenz für die geprüfte Substanz) lässt theoretisch nicht nur eine zielgenauere Zuordnung des Therapiebedarfs (Vermeidung von Unter- bzw. Übertherapie), sondern auch auf eine verbesserte Prädiktion des Therapieansprechens erwarten.
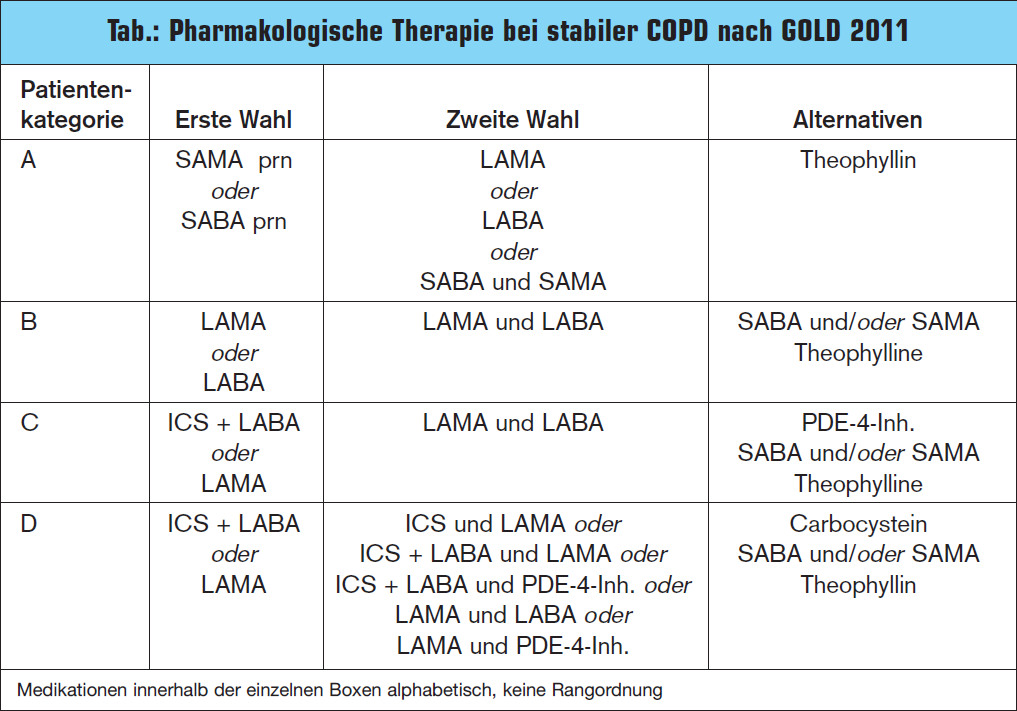
Pharmakologische Therapie nach GOLD 2011
Das kombinierte Assessment der Symptome und des Exazerbationsrisikos ist auch die Basis für das pharmakologische (> Tab.) (bzw. nicht-pharmakologische) Management. Mit derzurzeit verfügbaren Pharmakotherapie für COPD lässt sich der progrediente Lungenfunktionsverlust zwar nicht verhindern, allerdings kommt es mit Beginn der inhalativen Therapie zu einem deutlichen Zuwachs an Lungenfunktion, der auch nach mehrjähriger Beobachtung noch vorliegt. In gleicher Weise kommt es durch die entsprechende Medikation zu einer Verbesserung der Lebensqualität und zu einer deutlichen Reduktion der Exazerbationsraten. Folgende Substanzgruppen werden prinzipiell für die symtomatische Therapie empfohlen:
- Inhalative Bronchodilatatoren: Aktuell können die Therapeuten aus 2 Substanzklassen zur bedarfsmäßigen oder regelmäßigen Verabreichung zur Symptomreduktion auswählen: Beta-2-Sympathomimetika, die eine Bronchospasmolyse induzieren (kurz wirksame wie Salbutamol [SABA] und lang wirksame [LABA] wie Formoterol und Salmeterol) sowie bronchienerweiternd wirksame muskarinische Acetylcholin-Rezeptorantagonisten (das kurz wirksame Ipratropium [SAMA] und das lang wirksame Tiotropium [LAMA]). Die Therapiewahl erfolgt nach Verfügbarkeit und der individuellen Therapieantwort in Form von Symptomreduktion bzw. Nebenwirkungen. Lang wirksame inhalative Bronchodilatatoren sind wirksamer als kurz wirksame, reduzieren Exazerbationen und damit assoziierte Spitalsaufenthalte und verbessern Symptome und den Gesundheitsstatus allgemein. Die Kombination von Bronchodilatatoren unterschiedlicher pharmakologischer Klassen kann die Wirksamkeit im Vergleich zur Dosiserhöhung bei Monotherapie erhöhen und das Nebenwirkungsrisiko verringern. Theophyllin ist weniger effektiv und verträglich als inhalative Bronchodilatatoren und wird nicht empfohlen, wenn solche zur Verfügung stehen.
- Inhalative Kortikosteroide: Regelmäßige Therapie mit ICS verbessert die Symptome, Lungenfunktion und Lebensqualität und reduziert die Exazerbationen bei COPD-Patienten mit einem FEV1 < 60 % pred. Ein absetzten der ICS-Therapie kann bei manchen Patienten zu Exazerbationen führen.
Systemische Kortikosteroide sollten wegen des ungünstigen Nutzen-Risiko- Verhältnisses vermieden werden. - Phosphodiesterase-4-Inhibitoren: Bei schwerer und sehr schwerer COPD und einer Anamnese von Exazerbationen und chronischer Bronchitis reduziert der PDE- 4-Hemmer Roflumilast Exazerbationen, die mit oralen Glukokortikoiden behandelt wurden.
- Kombinationstherapien: ICS mit LABA ist bei moderater bis sehr schwerer COPD wirksamer als die Einzelkomponenten zur Verbesserung der Lungenfunktion und des Gesundheitsstatus und zur Exazerbationsreduktion.
Durch den Zusatz des Anticholinergikums Tiotropium (LAMA) zur ICS/LABA-Kombination scheint ein zusätzlicher Benefit erreichbar.
COPD-Medikamente in der Pipeline
Ein großes Dilemma der COPD-Therapie bis heute ist, dass zwar eine entsprechende pharmakologische Therapie die COPD-Symptome reduzieren, die Frequenz und Schwere von Exazerbationen, den Gesundheitsstatus und die Belastungstoleranz verbessern kann, jedoch hat keine der zur Verfügung stehenden Medikationen das Potenzial, kausal in das Krankheitsgeschehen und den Krankheitsverlauf einzugreifen. Eine Zusammenschau der großen COPD-Studien TORCH und UPLIFT lässt aber eine Interpretation in Richtung Mortalitätsreduktion zu (Miravitlles M., Anzueto A., International Journal of COPD 2009). Bis dato konnte keine Medikation den langfristigen Abfall der Lungenfunktion verhindern.
In der pharmazeutische Industrie wird in verschiedene Richtungen geforscht: So versucht man Bronchodilatatoren zu entwickeln, die länger und stärker wirken, um die Applikationsfrequenz zu senken und Patientencompliance zu erhöhen. In diese Kategorie fällt eine bereits in Phase III befindliche Fixkombination aus dem bereits 2009 zugelassenen, 24 h lang wirksamen LABA Indacaterol mit einem neuen, ebenfalls 24 h wirksamen Anticholinergikum (NVA-237, Glyco – pyrronium). Ein ganz neuer Ansatz zur Bronchospasmolyse sind so genannte bifunktionelle Medikamente, deren Moleküle gleichzeitig an den muskarinischen Rezeptoren antagonistisch und an den _-Rezeptoren agonistisch wirken (aktuell Phase-IIb-Studie zu GSK961081).
Zum anderen versucht man mit der Entwicklung neuer antientzündlicher Substanzen, die generell in die Signalübertragung der Inflammation eingreifen, von Antiproteasen und regenerativen Therapien auch krankheitsentscheidende COPD-Mechanismen zu beeinflussen. Dazu gehören etwa Zytokinantagonis – ten (CXCR2-Antagonist in Phase II, Nuclear- Factor-_B-Inhibitoren) oder Inhibitoren der p38-Mitogen-aktivierten Proteinkinase. Man darf gespannt sein auf die Wirksamkeits- und Sicherheitsdaten von neuen Therapiemodalitäten und ob sie den natürlichen COPD-Verlauf beeinflussen können.
FACT-BOX
GOLD 2011: Key Facts des COPD-Managements
- Prävention der COPD durch Vermeidung von Risikofaktoren wie Tabakrauch ist in hohem Ausmaß möglich und sollte höchste Priorität haben.
- Spirometrie ist für die Diagnose unabdingbar. Ein FEV1/FVC von < 0,7 belegt das Vorliegen einer persis – tierenden Beeinträchtigung der Lungenfunktion.
- Die Patientencharakterisierung erfolgt anhand der Beurteilung der Symptomatik, der Beeinträchtigung der Lungenfunktion, der Exazerbationsrate und Komorbiditäten.
- Diese kombinierte Evaluierung ist die Basis für das nicht-pharmakolo gische und pharmakologische Management.
- Der Benefit pulmonaler Rehabilitation und von körperlicher Aktivität kann nicht hoch genug eingeschätzt werden.
* Global Strategy for Diagnosis, Management, and Prevention of COPD, Update Dezember 2011; www.goldcopd.org