Neue orale Antikoagulantien – Und demnächst sind es vier
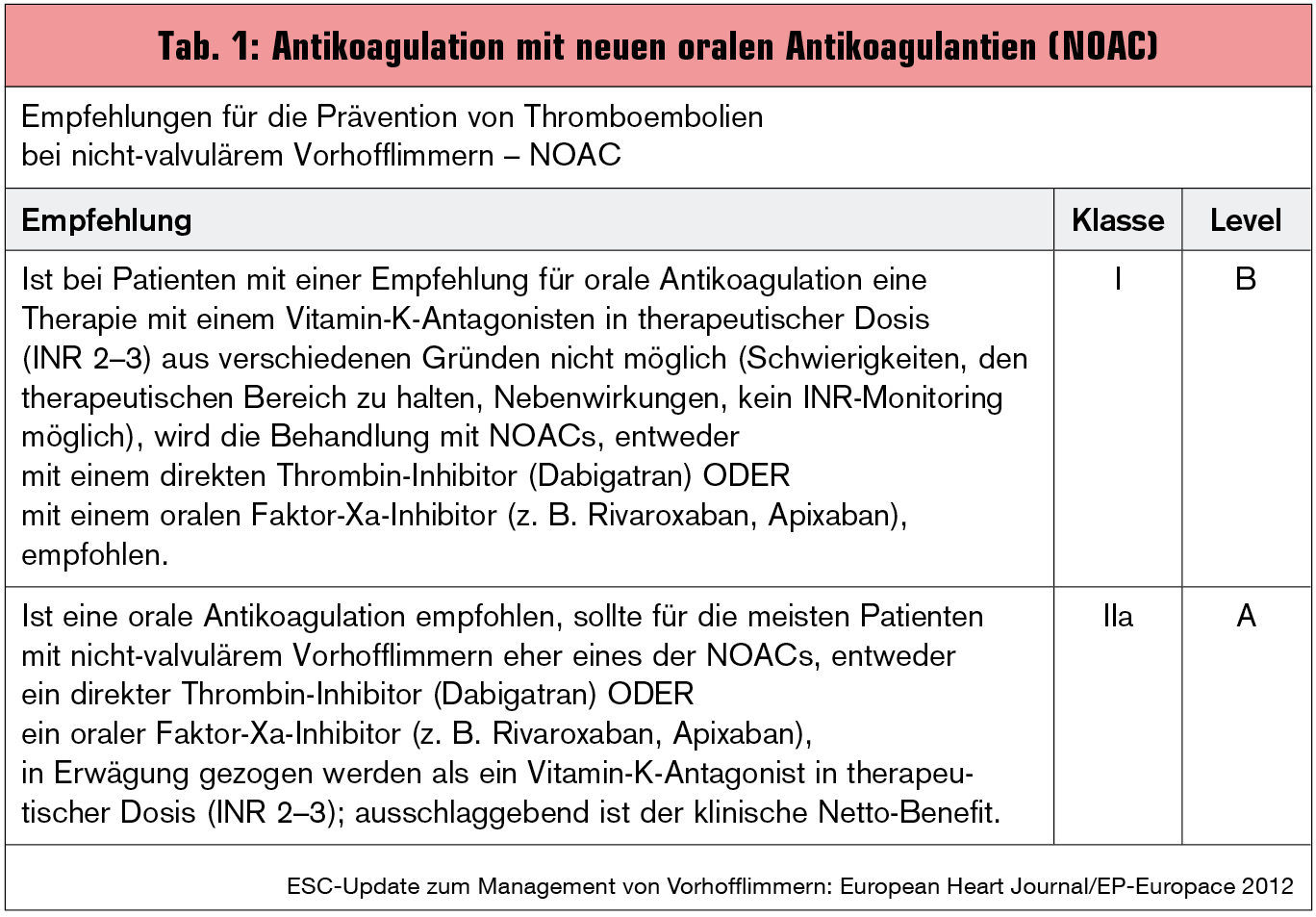
Vitamin-K-Antagonisten sind in der Prävention des Insults bei Patienten mit Vorhofflimmern (VHF) unbestritten wirksam. Dass derzeit nicht alle Patienten mit VHF und erhöhtem Insultrisiko (Tab. 1) eine orale Antikoagulation erhalten, liegt vielfach an den Vorbehalten gegenüber Vitamin-K-Antagonisten (VKA) hinsichtlich des erhöhten Risikos speziell für intrakranielle Blutungen. Auch die Limitationen in der Praxis, wie schwankende INR-Werte, belastende Kontrollen, lange Halbwertszeit, die Abhängigkeit von der Nahrungsaufnahme sowie der Medikationsinteraktion und die Komplexität des perioperativen Bridging-Managements tragen zum zurückhaltenden Einsatz bei.
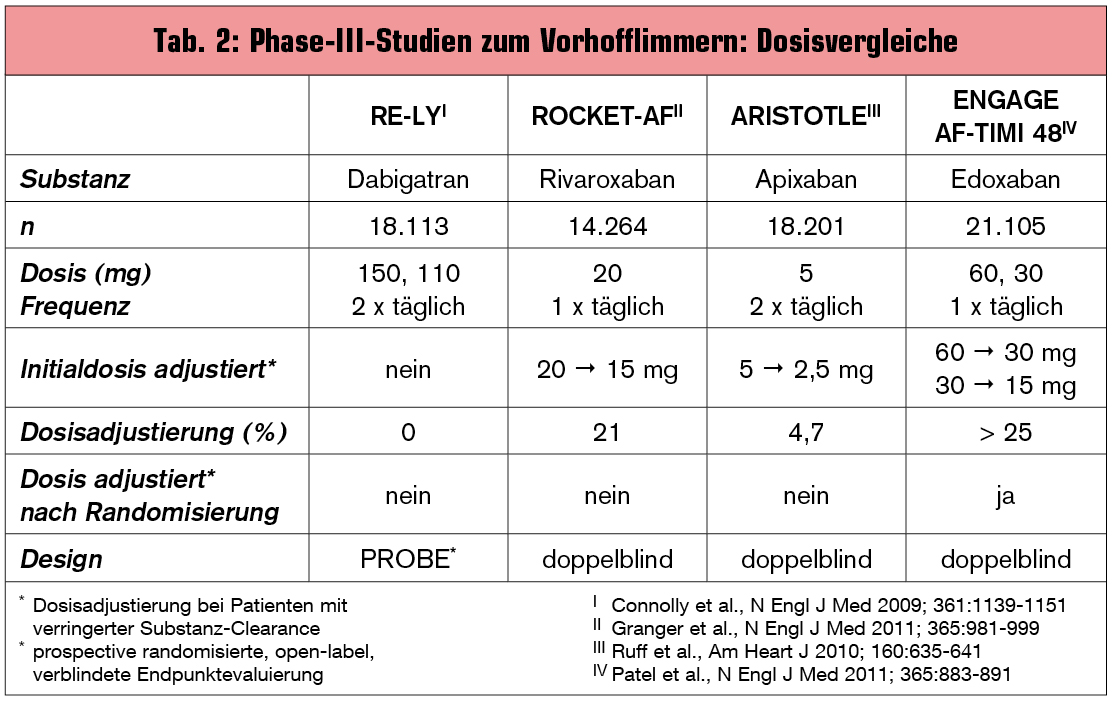
Mittlerweile stehen mit Dabigatran und Rivaroxaban zwei neue orale Antikoagulantien (NOAC) zur Verfügung (Apixaban befindet sich noch im Zulassungsverfahren), die Warfarin in Bezug auf das Thromboembolierisiko überlegen oder gleichwertig sind und/oder ein geringeres oder gleiches Risiko für intrakranielle Blutungen, lebensbedrohende und tödliche Blutungen aufweisen (Tab. 2). Sie und die vierte, in Europa noch nicht zugelassene Substanz Edoxaban standen im Zentrum eines Symposiums* beim heurigen ESC in München, das sich mit verschiedenen Fragestellungen in der neuen Ära der oralen Antikoagulation befasste.
Messlatte „Time in Therapeutic Range“
Die Phase-III-Studien zu den drei bereits zugelassenen NOAC liefern interessante Informationen zur „Time in Therapeutic Range“ (TTR) unter Warfarin. Die TTR, also der Anteil der Tage, an denen sich der INR zwischen 2,0 und 3,0 bewegte, lag zwischen 55 und 62 %, was die Problematik der Therapie mit VKA sogar unter Studienbedingungen offensichtlich macht. Eine Untersuchung von Connolly et al. an 526 Zentren erbrachte eine noch größere Bandbreite der TTR mit 44 % in Zentren der untersten Quartile bis 78 % in Zentren der obersten Quartile.1 Als Cut-off für den Vorteil einer VKA-Therapie gegenüber Clopidogrel/ASS wurde ein TTR ≥ 58 % ermittelt. Dass eine effektive OAK mit VKA in der Praxis prinzipiell möglich ist, zeigt das Swedish Anticoagulation Clinic Program mit einem TTR von 76 %.2 Die Realität der VKA-Therapie in Europa ist aber eine andere. „Wir haben gelernt, dass es hauptsächlich drei Ursachen hat, wenn das INR-Ziel nicht erreicht wird. Oft liegt es daran, dass mit einer fixen, meist zu niedrigen Dosis von Warfarin 1 mg begonnen wurde. Der zweite Grund ist ein insuffizientes INR-Monitoring. Und drittens sind die behandelnden Ärzte häufig zu vorsichtig bei der Dosistitration bei Nichterreichen des INR-Zielbereichs. Durch entsprechende Rückmeldung an unsere Studienzentren hoffen wir, die INR-Zielwerterreichung verbessern zu können“, berichtete Dr. Robert Giugliano, USA.
NOAC haben hingegen einen vorhersagbaren gerinnungshemmenden Effekt und machen ein Monitoring lediglich unter bestimmten Bedingungen notwendig.
Dosisadaptierte Therapie mit Edoxaban
Mit Edoxaban wird das vierte NOAC in der von Giugliano präsentierten ENGAGE-AF-TIMI-48-Studie untersucht. Diese ist mit 21.105 Patienten die bisher größte und mit einem Follow-up von median 2,5–3,0 Jahren längste Studie zum VHF mit einem NOAC. Das Design berücksichtigt diverse Erkenntnisse aus vorangegangenen Phase-I-3 und Phase-II-Studien4, 5, aber auch aus Studien mit anderen NOAC. So wurde die 1-mal tägliche Gabe von Edoxaban anstelle der 2-mal täglichen Gabe mit gegenüber Warfarin erhöhtem Blutungsrisiko untersucht. Weiters wurde die Dosis von Edoxaban bei Patienten adaptiert, bei denen eine eingeschränkte Nierenfunktion (Kreatininclearance 30–50 ml/min), ein Körpergewicht < 60 kg und gleichzeitiger Gabe potenter P-Glykoprotein-(PGP)-Inhibitoren vorgesehen waren. Veränderten sich die Parameter im Studienverlauf, dann wurde die Dosis kontinuierlich angepasst. Die drei Vergleichsgruppen waren Edoxaban im Niedrigdosisregime (30 mg 1 x täglich), Edoxaban im Hochdosisregime (60 mg 1 x täglich) und Warfarin. Dosisadaptionen wurden somit mit 3 Dosierungen (60, 30, 15 mg) getestet.
Risikofaktor Therapieunterbrechung
Giugliano verwies auf das Risiko der Unterbrechung einer NOAC-Therapie, wie in der ROCKET-AF-Studie apparent. Die Per-Protocol-Analyse zeigte die statistisch signifikante Überlegenheit von Rivaroxaban gegenüber Warfarin, während der Vorteil in der ITT-Analyse keine statistische Signifikanz erreichte.6 Als besonders kritisch erwies sich die Zeit der Umstellung von Rivaroxaban auf Warfarin zu Studienende von ROCKET AF. In diesem Zeitraum ereigneten sich signifikant mehr systemische Embolien unter Rivaroxaban, da die von Rivaroxaban auf Warfarin umgestellten Patienten den INR-Zielbereich erst mehrere Tage nach Absetzen von Rivaroxaban erreichten.7 In der ARISTOTLE-Studie zu Apixaban war als Reaktion darauf eine Überlappungszeit von Apixaban und Warfarin von 2 Tagen erlaubt. „Dieser Zeitraum war aber zu kurz und es wurde in den ersten 30 Tagen ebenfalls ein Überhang an Insulten von 21 versus 5 verzeichnet8“, berichtete Giugliano: „In den beiden Überlappungstagen waren die Patienten geschützt und es ereignete sich nur jeweils ein Insult in jeder Gruppe. In der ENGAGE-AF-TIMI-48-Studie wird darauf reagiert werden.“
Potenziell reversibler Effekt
Last but not least könnte die Edoxaban-Therapie in Zukunft bieten, was sich Ärzte derzeit noch von den NOAC wünschen: ein Antidot. Im Rattenmodell erwiesen sich rFVIIa (rekombinanter aktivierte Faktor VII), Feiba (aktivierter Prothrombinkomplex und nicht-aktivierter Faktor II, VII, IX und X) sowie PPSB-HAT (nicht-aktivierter Faktor II, VII, IX, X + Heparin) als potenziell wirksame Antidots zu Edoxaban.9
* „The new era of oral anticoagulation – achievements and challenges“, Symposium mit Unterstützung von Daiichi Sankyo, ESC 2012, München