Pathophysiologie der krebsassoziierten Thrombose
 Eine Krebserkrankung führt sehr häufig zu einer Aktivierung des Blutgerinnungssystems und zu Hyperkoagulabilität. Das Spektrum der prokoagulatorischen Erscheinungen reicht dabei von einfachen Veränderungen globaler Gerinnungstests und anderer Laborparameter der Hämostase und Fibrinolyse ohne klinische Manifestation bis hin zu asymptomatischen oder symptomatischen venösen Thromboembolien (z. B. tiefe Beinvenenthrombosen und Pulmonalembolien).
Eine Krebserkrankung führt sehr häufig zu einer Aktivierung des Blutgerinnungssystems und zu Hyperkoagulabilität. Das Spektrum der prokoagulatorischen Erscheinungen reicht dabei von einfachen Veränderungen globaler Gerinnungstests und anderer Laborparameter der Hämostase und Fibrinolyse ohne klinische Manifestation bis hin zu asymptomatischen oder symptomatischen venösen Thromboembolien (z. B. tiefe Beinvenenthrombosen und Pulmonalembolien).
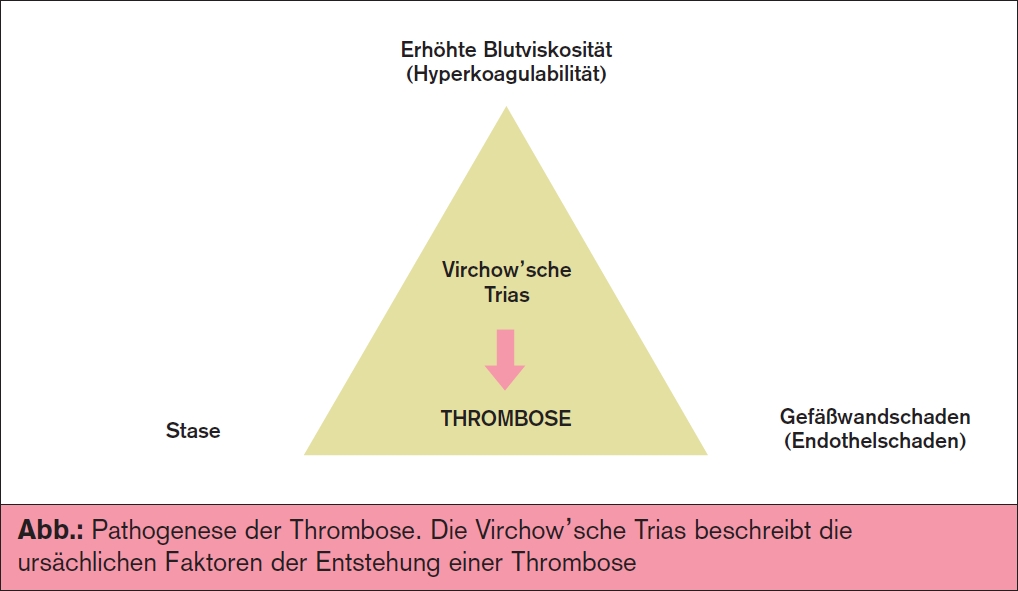
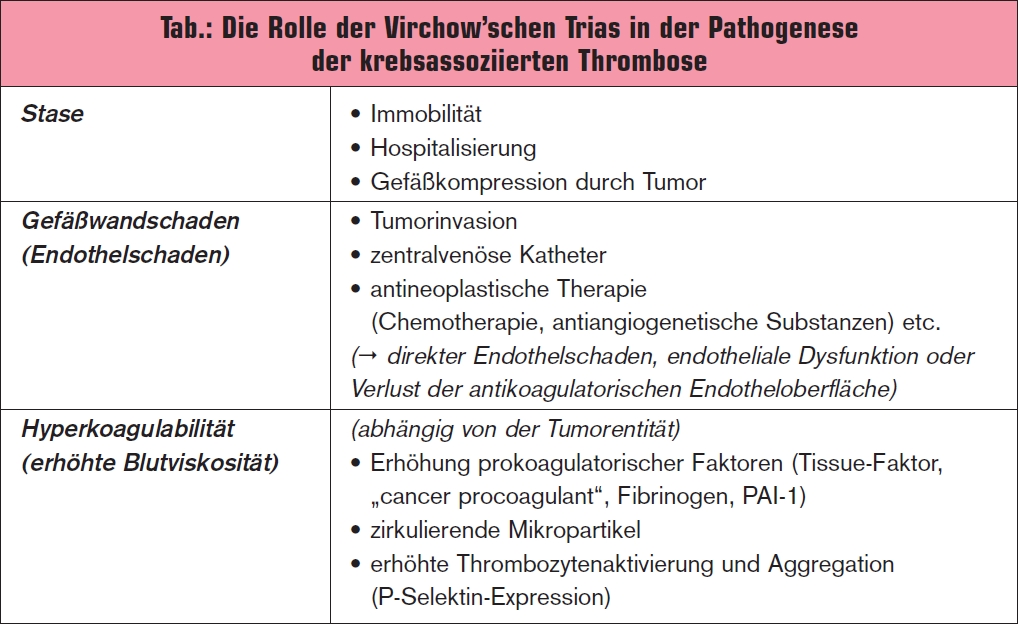
Die prädisponierenden pathogenetischen Faktoren für die Entstehung einer Thrombose können heute noch in der bereits im 19. Jahrhundert von Rudolf Virchow postulierten Trias („Virchowsche Trias“) zusammengefasst werden (> Abb.). Die Virchow’sche Trias benennt dabei 3 ursächliche Faktoren, die grundsätzlich zu einer Thrombose führen können: Hyperkoagulabilität (veränderte Blutgerinnung), Endothelschaden (geschädigte Gefäßwand) und Stase (gestörter Blutstrom) und hat bei Krebspatienten eine große Bedeutung, da diese 3 Faktoren auf eine besondere Art und Weise erfüllt werden (> Tab.). Die Schädigung der Gefäßwand kann etwa direkt durch das invasive Wachstum des Tumors in die Blutgefäße, die Anlage von zentralvenösen Dauerverweilkathetern oder indirekt durch chemotherapeutische und antiangiogenetische Substanzen verursacht werden, die zu einer endothelialen Dysfunktion und zum Verlust der antikoagulatorischen Oberfläche des Endothels führen können. Eine Immobilisation im Verlauf der Krebserkrankung, häufige Hospitalisierungen, tumorchirurgische Operationen oder eine lokale Gefäßkompression durch den Tumor, durch Lymphknoten oder Metastasen können in einen gestörten Blutfluss resultieren. Eine zentrale pathophysiologische Bedeutung für die erhöhte Thromboseneigung bei Tumorpatienten stellen die Hyperkoagulabilität und die Aktivierung des Blutgerinnungssystems dar, die im Wesentlichen von der Tumorbiologie bzw. Tumorentität und von der antineoplastischen Therapie geprägt sind.
Direkte Blutgerinnungs – aktivierung durch Krebszellen
Die Krebszellen haben die besondere Eigenschaft, das Blutgerinnungssystem durch verschiedene Wege zu aktivieren und zu einer vermehrten Generierung von Thrombin zu führen, einem zentralen Enzym in der Blutgerinnung, das Fibrinogen zu Fibrin umwandelt und somit die Entstehung eines Thrombus (Blutgerinnsels) triggert. Durch die Produktion und Expression von prokoagulatorischen Proteinen (Tissue-Faktor, Mikropartikel, Inhibitoren der Fibrinolyse oder „Cancer procoagulant“ – eine direkt den Blutgerinnungsfaktor X aktivierende Protease) haben Krebszellen selbst die Eigenschaft, eine direkte Blutgerinnungsaktivierung hervorzurufen. Krebszellen können auch indirekt über die Expression bzw. Ausschüttung von Zytokinen (IL-6, TNF-_, VEGF) oder Zelladhäsionsmolekülen mit Thrombo – zyten, Leukozyten und Endothelzellen interagieren und so zu einer Aktivierung dieser Zellen und in weiterer Folge der Hämostase führen. Eine Interaktion zwischen Krebszellen und Monozyten oder Thrombozyten geht beispielsweise einher mit einer Expression von Tissue-Faktor, dem wichtigsten physiologischen Initiator der Blutgerinnung, P-Selektin oder der Entstehung von prokoagulatorischen, in der Blutbahn zirkulierenden Mikropartikeln. Als Mikropartikel werden subzelluläre und heterogene Membranvesikel bezeichnet, die durch eine Größe von 0,1–1,0 μm sowie eine phosphatidylserinreiche und somit negativ geladene Oberfläche definiert sind. Mikropar – tikel werden nach Aktivierung oder im Rahmen der Apoptose von verschiedenen Zellen (z. B. Thrombozyten, Endothelzellen, Leukozyten, Erythrozyten oder Tumorzellen) freigesetzt und tragen Membranantigene an ihrer Oberfläche, die charakteristisch für ihre Ursprungs – zelle sind. Daneben kann auch Tissue-Faktor von der Mutterzelle auf die Oberfläche der Mikropartikel übertragen werden.
Zelladhäsionsmolekül P-Selektin
P-Selektin ist ein Zelladhäsionsmolekül, das in den Thrombozyten und Endothelzellen gespeichert ist und bei Aktivierung dieser Zellen an die Oberfläche transportiert wird. Es vermittelt die Interaktion zwischen Thrombozyten, Leukozyten und dem Gefäßendothel. Interessanterweise können Tumorzellen, insbesondere Adenokarzinome, Rezeptoren für P-Selektin exprimieren und so eine Interaktion von Thrombozyten und Endothelzellen mit Tumorzellen fördern. P-Selektin übt auch nach Bindung an seinen Rezeptor, dem P-Selektin-Glykoprotein- Ligand-1 (PSGL-1), eine prokoagulatorische Aktivität aus, indem es zu einer Expression von Tissue-Faktor auf Monozyten und Endo – thelzellen führt. Die Rolle von P-Selektin für die Entstehung einer krebsassoziierten Thrombose konnte auch durch eine klinische Studie untermauert werden, in der gezeigt wurde, dass Krebspatienten mit höheren solublen PSelektin- Spiegeln ein erhöhtes Risiko für das Auftreten von venösen Thromboembolien aufweisen. 1
FACT-BOX
Die Entstehung der krebsassoziierten Thrombose hängt von verschiedenen Faktoren ab. Die Pathogenese der Hyperkoagulabilität, die der Thromboseneigung bei Krebspatienten zugrunde liegt, ist sehr komplex. Eine besondere Rolle spielt dabei die Interaktion zwischen Tumorzellen und dem Gerinnungssystem, die zu prokoagulatorischen Veränderungen (Expression von Tissue-Faktor, P-Selektin, inflammatorischen Zytokinen und Bildung von zirkulierenden Mikropartikeln) führt und in einer Aktivierung des Blutgerinnungssys – tems resultiert.
1 Ay C et al., High plasma levels of soluble P-selectin are predictive of venous thromboembolism in cancer patients: results from the Vienna Cancer and Thrombosis Study (CATS). Blood 2008; 112:2703