Polymyalgie und Arteriitis
Die Polymyalgia rheumatica (PMR) und die Riesenzellarteriitis (RZA) sind häufige, eng miteinander assoziierte chronisch entzündlich rheumatische Erkrankungen, die fast ausschließlich Personen des höheren Lebensalters (> 50 Jahre) betreffen.
Klinik und Diagnose
Typisch für die PMR sind beidseitige Schulterschmerzen (70–95 %), Nackenschmerzen und/oder beidseitige Schmerzen am Beckengürtel (50–70 %), welche mit einer ausgeprägten Morgensteifigkeit assoziiert sind.
Die Diagnose der PMR wird durch das Vorliegen von typischen Symptomen und klinischen Befunden, Laborergebnisse und den Ausschluss relevanter Differenzialdiagnosen gestellt.
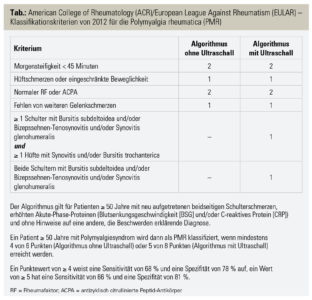
Im Rahmen eines Gemeinschaftsprojektes des American College of Rheumatology (ACR) und der European League Against Rheumatism (EULAR) wurden 2012 neue Klassifikationskriterien für die PMR publiziert. Demnach werden Patienten über 50 Jahre mit neu aufgetretenen beidseitigen Schulterschmerzen und erhöhter Akute-Phase-Reaktion dann als PMR klassifiziert, wenn zumindest 4 von 6 (ohne Ultraschall) oder 5 von 8 (mit Ultraschall) Punkten erfüllt sind (Tab.).
Bislang steht kein spezifischer Labortest für die Diagnose der PMR zur Verfügung. Eine Bursitis subdeltoidea, Bizepssehnen-Tenosynovitis und/oder eine Synovitis der Glenohumeralgelenke sind für die PMR typische Befunde in der Bildgebung. In der Ultraschallstudie, die im Rahmen der Entwicklung der EULAR-ACR-Klassifikationskriterien von 2012 durchgeführt wurde, stellte sich die sonografische Abgrenzung der PMR von der rheumatoiden Arthritis des höheren Lebensalters als besonders schwierig heraus. Hingegen war die sonografische Differenzierung von anderen Differenzialdiagnosen, insbesondere degenerativen Erkrankungen, leichter möglich.
Das klinische Erscheinungsbild der RZA hängt vom betroffenen Gefäßbett und vom Ausmaß der systemischen Entzündungsreaktion ab: Kopfschmerzen, Sehstörungen und Kieferclaudicatio stellen die häufigsten Symptome der klassischen kranialen RZA dar. Allgemeinsymptome, wie Fieber und Gewichtsverlust, stehen bei Patienten mit einer Arteriitis der extrakranialen großen Gefäße häufig im Vordergrund. Etwa 40–60 % der RZA-Patienten haben gleichzeitig eine PMR, umgekehrt entwickeln etwa 20 % der PMR-Patienten eine RZA. Auch ein Rezidiv der Erkrankung unter Therapie äußert sich am häufigsten (50 %) mit typischen Symptomen einer PMR. In Bildgebungsstudien wiesen mehr als 80 % der Patienten mit einer kranialen Form der RZA sowie ein Drittel der PMR-Patienten bei Erkrankungsbeginn einen subklinischen Befall der extrakranialen großen Gefäße auf. Die Bedeutung dieser subklinischen Vaskulitis ist aber noch unklar.
Eine gefürchtete Komplikation der RZA ist der permanente Visusverlust, welcher bis zu 20 % der Patienten betrifft. Der wichtigste Risikofaktor für die Erblindung ist die Zeit vom Auftreten der Symptome bis zum Einleiten der Glukokortikoid-(GC-)Therapie. Die rasche Diagnosestellung und Therapie ist daher entscheidend. Die Österreichische Gesellschaft für Rheumatologie (ÖGR) hat vor kurzem einen Zuweisungsleitfaden1 entwickelt, welcher das Management von RZA-Patienten in dieser initialen Phase erleichtern soll. Dieser kann auf der ÖGR-Website (www.rheumatologie.at) heruntergeladen werden.
Die Temporalarterienbiopsie mit Nachweis eines transmuralen Entzündungsinfiltrats, einer Hyperplasie von Intima und Media sowie mehrkernigen Riesenzellen galt bislang als Goldstandard in der Diagnose der klassischen kranialen Form der RZA. Trotz typischer Klinik liegen in bis zu 60 % der Fälle jedoch falsch negative Befunde vor. Die neuen EULAR-Empfehlungen für die Anwendung der Bildgebung bei Großgefäßvaskulitis unterstreichen den hohen Stellenwert des Ultraschalls für die Diagnose der RZA. Einer aktuellen Metaanalyse zufolge liegt die Sensitivität des Ultraschalls im Vergleich zur klinischen Diagnose der RZA bei 77 %, die der Spezifität bei 96 %. Das „Halo“ ist das relevanteste Ultraschallzeichen für die RZA.
Therapieoptionen
Sowohl in der Behandlung der PMR als auch in der der RZA sind GC nach wie vor der Goldstandard.
PMR: Entsprechend den EULAR/ACR-Empfehlungen wurde für die Behandlung der PMR die Anwendung der minimalen effektiven GC-Dosis (12,5–25 mg/Tag) vorgeschlagen. Je nach individuellem Risiko für GC-assoziierte Nebenwirkungen (z. B. Osteoporose, Diabetes mellitus oder andere Komorbiditäten) und dem Risiko für Rezidive (erhöhte BSG und/oder periphere Manifestationen) sollte die Dosis innerhalb dieser Spanne angepasst werden.
Die Abstufung der GC-Dosierung erfolgt nach einem individualisierten Therapieplan (gutes initiales Ansprechen und anhaltende Remission vorausgesetzt): Reduktion auf 10 mg/Tag innerhalb von 4–8 Wochen, weitere Abstufung um 1 mg alle 4 Wochen bis zum Absetzen. Die Therapie der PMR dauert in der Regel mindestens 1 Jahr.
Ein Rezidiv der PMR wird durch die Erhöhung der GC-Dosis auf die zuletzt wirksame Dosis behandelt. Bei jedem Rezidiv soll die Zugabe von Methotrexat (MTX) in Erwägung gezogen werden und eine Reevaluation der Diagnose durchgeführt werden. Den neuen Empfehlungen zufolge kann MTX aber auch schon bei Diagnose je nach Risiko für Rezidive, Auftreten von GC-assoziierten Nebenwirkungen, Komorbiditäten und/oder Begleitmedikationen angewendet werden.
Offen ist, ob „modified release“ GC-Präparate gegenüber konventionellen GC von Vorteil in der Behandlung der PMR sind. Kleineren prospektiven Studien und Fallberichten zufolge ist der Einsatz von Tocilizumab auch bei PMR-Patienten sehr vielversprechend.
RZA: Patienten mit begründetem Verdacht auf das Vorliegen einer RZA sollen entsprechend den aktuellen Richtlinien der EULAR und British Society of Rheumatology (BSR) umgehend mit hochdosierten GC (1 mg/kg Körpergewicht, max. 60 mg/Tag od. 40–60 mg/Tag Prednisonäquivalent) behandelt werden, um ischämische Komplikationen der Erkrankung zu verhindern. Die initiale GC-Dosis sollte bis zu dem Verschwinden der klinischen Symptome und der Normalisierung der erhöhten Entzündungsparameter beibehalten werden, mit anschließender langsamen Dosisreduktion (10-mg-Schritte in 2-wöchentlichen Intervallen bis zur Dosis von 20 mg; 2,5-mg-Schritte in 2–4-wöchentlichen Intervallen bis zur Dosis von 10 mg; 1-mg-Schritte in 4–8-wöchentlichen Intervallen bis zum Absetzen). Auch für die RZA gilt, dass die GC-Dosis entsprechend der Erkrankungsaktivität, dem Risiko für GC-assoziierte Nebenwirkungen, Komorbiditäten und Begleitmedikation individuell angepasst werden und ggf. eine GC-einsparende, immunsuppressive Therapie eingesetzt werden sollte. Prinzipiell ist bei der RZA eine Therapiedauer von zumindest 12–18 Monaten anzustreben.
Bei Patienten mit ischämischer Augenbeteiligung ist eine GC-Pulstherapie mit 500 mg bis 1 g Methylprednisolon über 3 Tage in Erwägung zu ziehen.
Konventionelle Immunsuppressiva sind in ihrer Wertigkeit bei der Behandlung der RZA umstritten. In einer Metaanalyse von 3 Studien wurde ein moderater Benefit von MTX in Bezug auf das Rezidivrisiko und die kumulative GC-Dosis beobachtet. Einer der wichtigsten Fortschritte der letzten Jahre war die Zulassung von Tocilizumab für die Behandlung der RZA, welches in je einer Phase-II- und Phase-III-Studie zu deutlich höheren Remissionsraten und zu einer Reduktion der kumulativen GC-Dosis führte.
Resümee
Die PMR und RZA sind sehr häufige chronisch entzündlich rheumatische Erkrankungen des höheren Lebensalters, die sehr eng miteinander vergesellschaftet sind. Der Ultraschall mit Nachweis des „Halo“-Zeichens als Ausdruck der Gefäßentzündung ist unverzichtbar für die Frühdiagnostik der RZA. Die Behandlung der PMR und der RZA basiert in erster Linie auf Glukokortikoiden, allerdings sollte eine immunsuppressive Therapie mit MTX entsprechend dem individuellen Risikoprofil in Erwägung gezogen werden. Die Zulassung von Tocilizumab stellt einen Meilenstein in der Behandlung der RZA dar,
auch wenn der Einsatz und die Dauer der Medikation noch nicht vollständig geklärt sind.