Zentrales Thema auf der UEGW – das Mikrobiom
Das Universum des intestinalen Mikrobioms verstehen: Die Forschung über das humane Mikrobiom ist nach wie vor ein junges Gebiet der modernen Wissenschaft. An die 45.000 Top-Publikationen wurden auf diesem Gebiet veröffentlicht, 50 % davon in den letzten 2,5 Jahren. Ein Großteil betrifft das intestinale Mikrobiom, wobei sich die Wissenschaft in erster Linie auf den Zusammenhang zwischen Inflammation und Karzinom-Entstehung konzentriert. Das Mikrobiom und sein Einfluss auf diverse Erkrankungen war ein zentraler Aspekt der UEGW 2018.
Gut und Böse
Die Herausforderung der richtigen Interpretation: Ergebnisse von Mikrobiomstudien sind oft unterschiedlich oder sogar kontroversiell. Die Ursache dafür liegt in der ausgeprägten Heterogenität des intestinalen Mikrobioms. Bei der Stuhl-Analyse von mehr als 2.000 Einwohnern Amsterdams stellte sich einerseits heraus, dass die ethnische Herkunft den größten Einfluss auf die mikrobielle Variabilität hatte, obwohl alle Probanden in derselben Stadt lebten. Andererseits konnte anhand von 7.000 Bewohnern einer chinesischen Provinz mit 14 Bezirken gezeigt werden, dass bei einheitlich ethnischer Herkunft der Wohnbezirk hauptverantwortlich für Unterschiede im intestinalen Mikrobiom war. Wenn bei gesunden Probanden nun schon die Variabilität so groß ist, wie komplex mag wohl die Interpretation krankheitsspezifischer Mikrobiomveränderung sein?
Populationsstudien, die sich größtenteils auf die Assoziation von bakterieller Richness mit Erkrankungen konzentriert, sind aus mehrerlei Gründen schwierig zu interpretieren.
Etwa ist eine reduzierte Richness selbst nicht zwangsläufig mit einer Prädisposition für oder mit einer Erkrankung selbst assoziiert. So ist der Unterschied am Beispiel des Typ-2-Diabetes zwischen Patienten und gesunden Kontrollen in Bezug auf die Richness in manchen Kohorten nicht gegeben, sehr deutlich aber zwischen schlanken und übergewichtigen Probanden zu sehen.
Noch komplexer wird es, wenn nun krankheitsspezifische Unterschiede bei unterschiedlichen Kohorten untersucht werden. Am Beispiel der chronisch entzündlichen Darmerkrankung (CED) zeigen CED-Patienten aus geografisch unterschiedlichen Kohorten ausgeprägte Unterschiede im Mikrobiom. Ein Vergleich des krankheitsspezifischen Mikrobioms ist daher nur eingeschränkt möglich.
In einer spanischen Kohorte konnten kürzlich 8 Taxa identifiziert werden, die so spezifisch für Morbus Crohn sind, dass sie als Mikrobiomarker verwendet werden könnten. Daraus kann jedoch nicht der Schluss gezogen werden, dass diese Keime für Morbus Crohn in einem kausalen Zusammenhang stehen. Christensenellaceae z. B. ist auch bei Patienten mit niedrigem BMI sowie Gewichtsverlust zu finden, Symptome, die bei Morbus Crohn ebenfalls häufig auftreten.
Im Rahmen des flämischen intestinalen Mikrobiomprojektes („flemish gut flora project“ – FGFP) mit > 1.000 Probanden konnten als wichtigste Haupt-Modulatoren des Mikrobioms Stuhlfrequenz bzw. Kolontransitzeit identifiziert werden. So ist harter Stuhl durch hohe Richness, langsames Wachstum, hoher proteolytischer Fermentation bei hoher mikrobieller Last gekennzeichnet. Weitere wichtige Faktoren sind Alter, BMI und Diät. Doch alle diese Faktoren sind nur zu 16 % für die interindividuelle Variabilität verantwortlich. Eine Erklärung dafür liegt vielleicht im Virom und im Fungom.
Virom und Fungom – es wird noch komplexer
Zieht man in weiterer Folge auch das Virom als Modulator des intestinalen Mikrobioms in Betracht, wird es noch komplexer. Das Programm der UEGW 2018 beschäftigte sich auch mit diesen, bisher vernachlässigten Mitbewohnern unseres Darmes. 99 % der intestinalen Viruslast bestehen aus Phagen, also Viren, deren Wirtszellen Bakterien und Archaeen sind. Man unterscheidet virulente und gemäßigte Phagen. Aktuell sind 50 % der Phagen noch nicht klassifiziert. Den größten Anteil des klassifizierten Viroms nehmen Caudovirales und zu einem geringeren Anteil Microviridae ein.
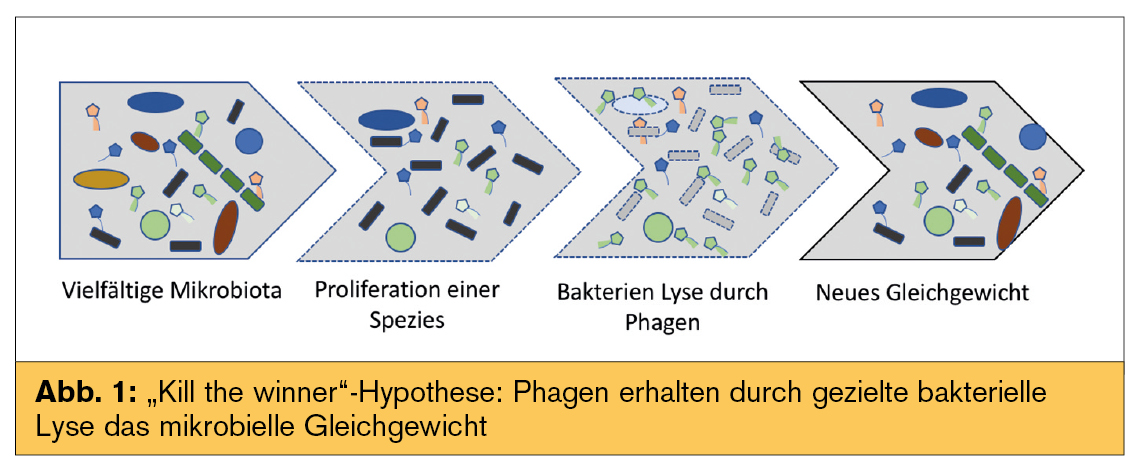
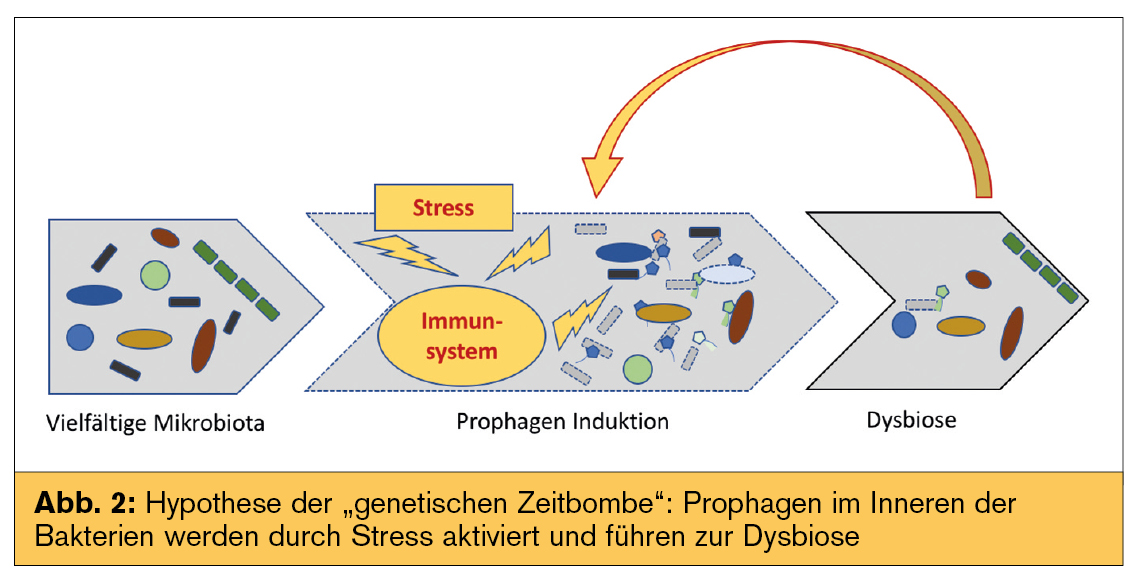
Über die Interaktion von Phagen mit Bakterien bei mit Dysbiose assoziierten Erkrankungen ist noch wenig bekannt. Aktuell werden zwei Erklärungsmodelle dafür herangezogen: „kill the winner“ und „community shuffling“ – auch als „genetische Zeitbombe“ beschrieben (Abb. 1 und 2).
Die „Kill the winner“-Hypothese geht davon aus, dass die Proliferation bestimmter Bakterien im Rahmen einer Dysbiose Phagen aktiviert. Die Phagen töten durch Lyse dominante Bakterien und führen wieder zu einem Equilibrium. Dabei kommt es zu einer Verminderung von Bakterien und gleichzeitig zu einer Vermehrung von Phagen (Abb. 1).
Unter „community shuffling“ oder „genetischer Zeitbombe“ versteht man die Modulation des Mikrobioms durch Prophagen in Bakterien. Durch bestimmte Reize induziert zerstören sie ihren bakteriellen Wirt und führen so zur Dysbiose (Abb. 2). Die Hypothese wird durch die Beobachtung unterstützt, dass das Mikrobiom von Morbus-Crohn-Patienten einen geringeren Anteil an Faecalibacterium prausnitzii und gleichzeitig einen hohen Anteil an Faecalibacterium-prausnitzii-Phagen im Vergleich zu Gesunden zeigt.
Der Anteil des Fungoms im intestinalen Mikrobiom gemessen mit Shotgun Sequencing auf DNA-Ebene beträgt nur ca. 1 %. Da Pilze jedoch ein ca. 100-fach größeres Volumen als Bakterien haben, erscheint dieses Prozent, das sich auf die DNA beschränkt, unterschätzt. Die Vielfalt der Pilze ist jedenfalls wesentlich geringer als die der Bakterien oder Viren. Die 2 Hauptvertreter sind Candida mit proinflammatorischen und Saccharomyces mit antiinflammatorischen Effekten. Bakterien wie Enterobacteriaceae interagieren mit Pilzen. So kommt es im Tiermodell bei Verlust von Enterobacteriaceae durch antibiotische Therapie zu einem Verlust dieser entzündungsmodulierenden Effekte der Pilze und kann im Umkehrversuch durch Zugabe von E. coli wiederhergestellt werden.
Modulation des intestinalen Mikrobioms
Fäkale Mikrobiota-Transplantation (FMT), auch Stuhltransplantation oder fäkale Bakterientherapie bezeichnet, ist ein radikaler Ansatz, ein dysbiotisches Mikrobiom mit dem Stuhl eines gesunden Spenders auszugleichen und damit dysbioseassoziierte Erkrankungen zu therapieren.
Aktuell gilt als einzige Indikation die rezidivierende Clostridium-difficile-Infektion (CDI). Sämtliche anderen Indikationen sollten laut nationalen und internationalen Empfehlungen nur in klinischen Studien durchgeführt werden.
Im Rahmen der UEGW wurden neue Daten präsentiert, die auch die Überlegenheit der FMT als First-Line-Therapie im Vergleich mit Metronidazol zeigen. Für den Stellenwert im klinischen Alltag spielt Kosteneffektivität eine große Rolle, wobei mittel- und langfristig die wesentlich geringere Rezidivrate der CDI und die damit geringeren Folgekosten nach FMT ebenso in Betracht gezogen werden müssen. Seit der Einführung der FMT nahm die Zahl der totalen Kolektomien als Therapie der schweren CDI dramatisch ab. Es konnte bereits von mehreren Gruppen gezeigt werden, dass die wiederholte FMT bei schweren Verlaufsformen Heilungsraten von 100 %, bei schwerer, komplizierter CDI bis zu 89 % ermöglicht. Rezente Daten einer italienischen Gruppe vergleichen Mortalitätsraten der totale Kolektomie mit 83 % mit der Mortalitätsrate der FMT mit 5 % bei schwerer CDI. Interessanterweise war auch die Sepsisrate in der FMT-Gruppe mit 5 % am Tag 90 signifikant geringer als in der Gruppe der chirurgisch therapierten Patienten (22 %).
Auf dem Gebiet der CED gibt es zunehmende Evidenz für die Wirksamkeit der FMT bei Colitis ulcerosa mit Remissionsraten bis zu 30 %. Entscheidend für das Ansprechen erscheint einerseits die bakterielle Besiedelung der Patienten vor FMT sowie andererseits das intestinale Mikrobiom des Spenders. Erste Ergebnisse einer französischen Studie demonstrieren den erfolgreichen Einsatz der FMT als Erhaltungstherapie bei ileokolonischem Crohn nach Induktion einer Remission mit Budesonid. Dieser neue Ansatz der FMT als Erhaltungstherapie gibt Hoffnung für neue Therapiekonzepte auf diesem Gebiet.
Resümee
Das wachsende Wissen um das intestinale Mikrobiom und seine Einflussfaktoren erklärt die häufig kontroversiellen und unterschiedlichen Ergebnisse von Mikrobiomstudien. Die Rolle der Phagen und Pilze auf das intestinale Mikrobiom sowie auf dysbioseassoziierte Erkrankungen ist nicht weniger komplex. Fäkale Mikrobiotatransplantation ist eine gesicherte und Antibiotika überlegene Therapie der rezidivierenden, aber auch schweren Clostridien-difficile-Infektion.