Aktuelle Entwicklungen in Diagnose und Therapie
Das Prostatakarzinom (PCa) ist mit einer Inzidenz von 30 % aller Krebsneudiagnosen die häufigste Krebserkrankung des Mannes in Österreich und nach dem Lungenkrebs die zweithäufigste krebsbedingte Todesursache bei Männern.1 Der größte Risikofaktor für das PCa ist das Alter: Das Durchschnittsalter bei der Diagnose beträgt 72 Jahre. Zudem gewinnen hereditäre Faktoren wie z.B. BRCA-Mutationen zunehmend an Bedeutung.
PCa-Früherkennung und die Rolle des PSA-Wertes sowie der Tastuntersuchung der Prostata
Die europäischen Leitlinien empfehlen die Krebsfrüherkennung mittels prostataspezifischen Antigens (PSA) ab dem 45. Lebensjahr2, sie wird jedoch mitunter kontrovers diskutiert. Neben klinisch signifikanten Tumoren werden auch deutlich mehr Karzinome entdeckt, die nie symptomatisch geworden wären. Männer sollten daher über die Vor- und Nachteile des PSA-Screenings und die Möglichkeit der Übertherapie informiert werden. Besteht nach der Aufklärung der Wunsch zur Früherkennung, soll eine PSA-Bestimmung erfolgen.3
Ebenfalls kritisch gesehen wird mittlerweile die alleinige digital-rektale Untersuchung (DRU) rein zum Screening-Zweck. Eine rezente Metaanalyse aus Wien verglich Daten aus 8 Studien mit über 85.000 Probanden, wobei für die DRU (allein oder in Kombination mit PSA-Bestimmung) keine Verbesserung bei der Früherkennung des PCa im Vergleich zum PSA-Test allein nachgewiesen werden konnte.4
Das Alter, ab dem das Screening zur Früherkennung gestoppt werden sollte, wird ebenso kontrovers diskutiert. Bei der Beurteilung sind – neben dem Alter – Komorbiditäten ein wichtiger Faktor.
Diagnostik und Staging
Besteht der serologische Verdacht auf ein PCa (PSA-Erhöhung), sollte als nächster Schritt eine multiparametrische Magnetresonanztomografie (mpMRT) der Prostata durchgeführt werden. Finden sich in der mpMRT karzinomverdächtige Areale, sollte eine Biopsie der Prostata durchgeführt werden.
Wird in der Prostatabiopsie ein Karzinom diagnostiziert, sollte je nach Risikogruppe eine Ausbreitungsdiagnostik (Staging) erfolgen. Patienten mit niedrigem und günstigem intermediärem Risikoprofil benötigen keine weitere Bildgebung. Die konventionelle Ausbreitungsdiagnostik für höhere Risikogruppen umfasst eine Computertomografie (CT) und eine Knochenszintigrafie3. Rezent hat sich die prostataspezifische Membranantigen-Positronenemissionstomografie (PSMA-PET/CT) als äußerst sensitives Verfahren zur Detektion von Metastasen erwiesen, und es kann daher für Patienten mit Hochrisikoprofil empfohlen werden.2
Strategien beim lokal begrenzten PCa
Active Surveillance. Die aktive Überwachung kommt für alle Patienten in Frage, die ein geringes Risiko haben, an einem PCa zu versterben (Tab.).
Die Leitlinien empfehlen die aktive Überwachung einerseits für Patienten mit lokal begrenztem Low-Risk-PCa mit einer Lebenserwartung >10 Jahre, einem PSA-Wert ≤10 ng/ml und einem Tumorstadium ≤T2a. Andererseits wird seit kurzer Zeit die aktive Überwachung auch für ausgewählte Patienten mit lokal begrenztem PCa der intermediären Risikogruppe mit günstigem Risikoprofil empfohlen. Zur Durchführung sind jedoch eine besonders intensive ärztliche Beratung und Begleitung unerlässlich. Das typische Überwachungsprotokoll umfasst regelmäßige PSA-Bestimmung, DRU, mpMRT und je nach Verlauf Rebiopsien. Die prospektiv randomisierte ProtecT-Studie verglich bei 1.643 Männern zwischen 50 und 69 Jahren Active Surveillance vs. Bestrahlung vs. radikale Prostatektomie über einen Nachbeobachtungszeitraum von rund 15 Jahren. Hinsichtlich des Sterberisikos durch PCa konnte kein statistisch signifikanter Unterschied zwischen den Gruppen festgestellt werden, in der Studienpopulation fanden sich jedoch überwiegend PCa mit niedrigem oder intermediärem Risikoprofil.5
Radikale Prostatektomie. Bei der radikalen Prostatektomie wird die gesamte Prostata einschließlich der Samenbläschen und gegebenenfalls der umliegenden Lymphknoten entfernt. Bei den operativen Techniken wurden im Laufe der Zeit die offenen Zugänge durch roboterassistierte Methoden erweitert. Zumeist retrospektive Vergleiche weisen darauf hin, dass die verschiedenen Zugangswege ähnliche Ergebnisse liefern.3
Strahlentherapie. Die perkutane Strahlentherapie, die bei allen Risikoprofilen ggf. in Kombination mit Hormontherapie eingesetzt wird, ist in den letzten Jahren immer präziser geworden – die sogenannte Ultrahypofraktionierung verwendet höhere Einzeldosen, wobei die gesamte Behandlung in drei bis sieben Sitzungen erfolgt. Bei der LDR-Brachytherapie („Low-dose“-Kurzdistanztherapie), die nur bei niedrigem oder günstigem intermediärem Risikoprofil geeignet ist, werden transperineal radioaktive „Seeds“ in die Prostata implantiert, die kontinuierlich Strahlung abgeben.
Nachsorge beim lokal begrenzten PCa. Die Nachsorge nach der Behandlung eines lokal begrenzten PCa ist ein wichtiger Bestandteil der Patientenversorgung. Im Mittelpunkt der Nachsorge steht die regelmäßige Kontrolle des PSA-Wertes.
Rund 30% aller Patienten entwickeln im Rahmen der Nachsorge ein biochemisches Rezidiv (BCR)6. Dies ist entweder als bestätigter Anstieg auf über 0,2 ng/ml nach radikaler Prostatektomie oder als Anstieg über 2 ng/ml über den tiefsten gemessenen PSA-Wert (Nadir) nach Strahlentherapie definiert. Sollte das der Fall sein, wird als nächster Schritt eine PSMA-PET/CT-Untersuchung durchgeführt, um Metastasen auszuschließen. Sollte das nicht der Fall sein, auch wenn in der Bildgebung kein Lokalrezidiv sichtbar ist, ist bei radikaler Prostatektomie im Vorfeld eine Bestrahlung der Prostataloge mit/ohne Androgendeprivationstherapie (ADT) die Therapie der Wahl. Eine systemische Therapie mit dem Androgenrezeptor-Signalinhibitor Enzalutamid (ARSI) ± ADT wird bei rascher PSA-Verdopplungszeit (< 9 Monate) empfohlen, wenn die Patienten im PSMA-PET-CT frei von Metastasen sind.7
Therapie des metastasierten PCa
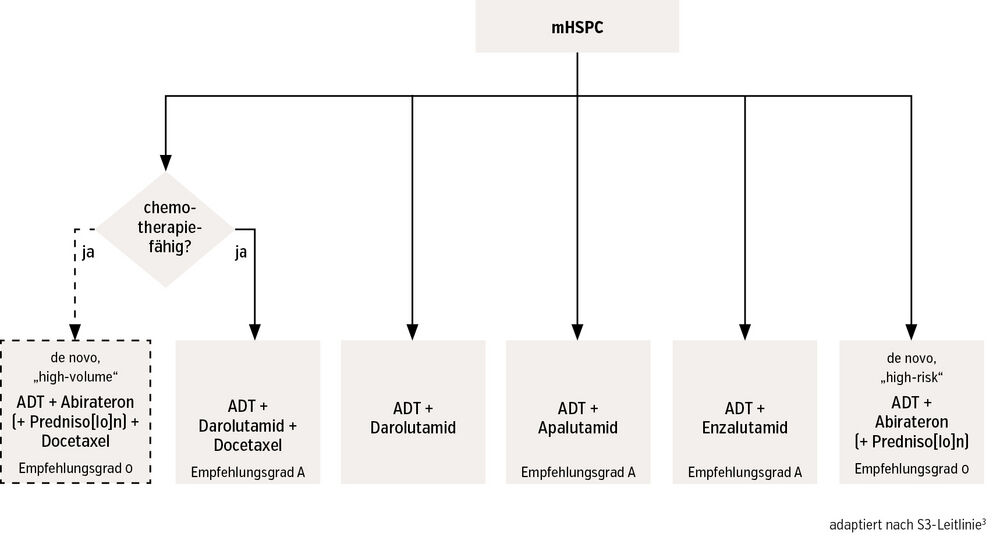
Metastasiertes hormonsensitives PCa (mHSPC). Die Grundlage der Behandlung des mHSPC ist es, den Testosteronspiegel im Körper auf Kastrationsniveau zu senken, um das Wachstum der hormonabhängigen Krebszellen zu hemmen und so die Krankheitsprogression zu verlangsamen. Die therapeutischen Optionen hierfür haben sich in den letzten Jahren deutlich weiterentwickelt (Abb.): Kombiniert mit der bewährten ADT kommen Doublet-Therapien mit ARSI (Abirateron, Enzalutamid, Apalutamid, Darolutamid) oder sogar Triplet-Therapien (Abirateron, Darolutamid) mit zusätzlicher Chemotherapie (Docetaxel) zum Einsatz.8
Zur optimalen individuellen Therapiefindung werden insbesondere Tumorlast und Risikoprofil sowie die Tatsache berücksichtigt, ob eine Metastasierung bereits bei Erstdiagnose vorliegt (synchron) oder erst im Verlauf der Erkrankung auftritt (metachron). Auch in Österreich ist die Triplet-Therapie angekommen, wie kürzlich veröffentlichte Real-World-Daten belegen, und sie wird hauptsächlich bei synchron metastasierten Patienten mit hoher Tumorlast angewendet.9
Metastasiertes kastrationsresistentes PCa (mCRPC). Besteht bei einem Testosteronspiegel < 50 ng/dl ein PSA-Anstieg auf ≥2 ng/ml, ein Progress in der Bildgebung oder ein symptomatischer Progress (2/3 der Kriterien müssen erfüllt sein), gilt das PCa als kastrationsresistent.3 Da das mCRPC biologisch heterogen ist und neben kastrationsresistenten auch hormonsensitive Tumorzellen persistieren können, ist es sinnvoll, die ADT fortzuführen.
An vorderster Front in diesem Therapiesetting stehen die ARSI Enzalutamid und Abirateron. Die Chemotherapie bleibt ein wichtiger Pfeiler der Behandlung (Docetaxel und Cabazitaxel). Bei der Radioligandentherapie mit 177Lutetium-PSMA binden radioaktiv markierte Moleküle selektiv an Prostatakrebszellen, was eine gezielte Bestrahlung der Tumorzellen bei minimaler Schädigung des umliegenden gesunden Gewebes ermöglicht.
In der VISION-Studie konnte sowohl das progressionsfreie als auch das Gesamtüberleben mit der Radioligandentherapie verlängert werden.10 Die Therapie ist eine effektive, gut verträgliche Behandlungsoption im mCRPC-Setting und in Österreich mittlerweile etabliert, wie kürzlich publizierte Real-World-Daten zeigten.11 Eine weitere Möglichkeit im mCRPC-Setting ist die Kombination eines ARSI (Abirateron, Enzalutamid) mit einem PARP-Inhibitor (Olaparib, Talazoparib).12 Sie kommt bereits bei Patienten mit bestimmten genetischen Mutationen („Homologous recombination repair“-Gene, HRR), die an DNA-Reparaturmechanismen beteiligt sind, aber auch bei jenen ohne HRR-Mutationen zur Anwendung. Die optimale Sequenz dieser Therapien bleibt Gegenstand aktueller Forschung und hängt von individuellen Faktoren wie Krankheitsverlauf, vorangegangenen Therapien, Tumorlast, genetischen Markern, Alter, Allgemeinzustand und Patientenwunsch ab.2 Die personalisierte Medizin spielt eine zunehmend wichtige Rolle bei der Auswahl der bestmöglichen Behandlungsstrategie für jeden einzelnen Patienten mit mCRPC.
Ausblick
Die kontinuierliche Weiterentwicklung von Biomarkern und bildgebenden Verfahren eröffnet Perspektiven für eine noch präzisere personalisierte Therapie. Ein spannendes Forschungsgebiet befasst sich damit, wie man Patienten besser auswählen und überwachen kann, die sich für eine Active Surveillance entschieden haben. Der wachsende Einsatz künstlicher Intelligenz (KI) hilft dabei, jene Patienten zu erkennen, die von einer Prostatektomie profitieren, wodurch sich unnötige Eingriffe vermeiden lassen. Vielversprechende Ergebnisse zeigen auch nichtinvasive genetische Tests, die mit einer einfachen Urinprobe das Risiko für eine therapiebedürftige Erkrankung oder das Risiko eines Rezidives nach Operation vorhersagen können.13 Molekulargenetische Erkenntnisse durch hochmoderne Verfahren wie die Single-Cell-DNA-Sequenzierung rücken die Erforschung der Tumormikroumgebung zunehmend in den Fokus. Auf dem Gebiet der Behandlung des metastasierten PCa gibt es neue spannende Therapiekonzepte wie beispielsweise AKT-Inhibitoren oder T-Zell-Engager, die künftig beim PCa eine Rolle spielen werden. Die genetische Testung gewinnt auch bei metastasierten Patienten immer mehr an Bedeutung, wodurch die Behandlungsansätze zunehmend individualisierter werden.