Die 5q-assoziierte spinale Muskelatrophie (SMA) stellt mit einer Inzidenz von 1 : 6.000–10.000 eine der häufigsten hereditären neuromuskulären Erkrankungen dar. Ursächlich ist eine homozygote Deletion im Survival-of-Motor-Neuron-(SMN1-)Gen auf dem Chromosom 5q13, wodurch es zu einer Unterproduktion von funktionierendem SMN-Protein und in weiterer Folge zu einer progredienten Degeneration der Alpha-Motoneuronen im Rückenmark kommt. Das SMN2-Gen am zentromerischen Teil des Chromosoms 5 unterscheidet sich vom SMN1-Gen nur durch wenige Basenpaare. Durch das fehlende Exon 7 wird das SMN2-Gen jedoch zum Großteil nicht transkribiert, was zu einem nichtfunktionierenden bzw. rasch abgebauten SMN-Protein führt. Aus lediglich 20 % der SMN2-Transkripte entsteht ein voll funktionsfähiges Protein.
Anzahl der SMN2-Kopien bestimmt SMA-Typ
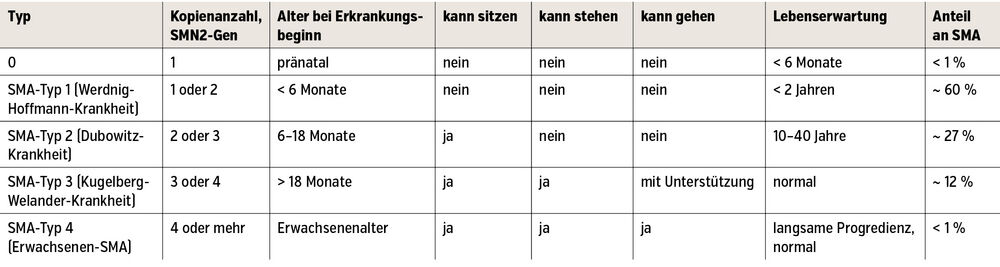
Die Krankheitsausprägung wird überwiegend durch die individuell unterschiedliche Anzahl der SMN2-Gen-Kopien beeinflusst (Tab.).
Allen Typen gemeinsam ist eine fortschreitende, symmetrische, proximal betonte Muskelschwäche, bei der die Beine früher und stärker betroffen sind als die Arme, sowie fehlende oder deutlich abgeschwächte Muskeleigenreflexe; eine kognitive Einschränkung besteht nicht. Der SMA-Typ-1 stellt mit 60 % die häufigste und (nach Typ0) schwerste Form der Erkrankung dar und war bis vor Einführung der neuen Therapien vor wenigen Jahren die häufigste Todesursache im Säuglings- und Kleinkindalter.
Kausale Therapie
Die wachsende Kenntnis über die Pathophysiologie der SMA ermöglichte die Entwicklung von 3 kausal orientierten Medikamenten, deren gemeinsames Ziel die Herstellung eines voll funktionsfähigen SMN-Proteins ist. Nusinersen, ein Antisense-Oligonukleotid, modifiziert das Spleißen der inkompletten Information des SMN2-Gens und wurde 2017 als erstes Medikament von der Europäischen Arzneimittel-Agentur für alle Altersgruppen, Phänotypen sowie Erkrankungsstadien zugelassen. Nach einer Aufsättigungsphase muss es alle 4 Monate intrathekal verabreicht werden.
Im Mai 2020 folgte die Zulassung der Genersatztherapie mit Onasemnogen-Abeparvovec für SMA-Betroffene mit max. 3 SMN2-Genkopien und einem Gewicht von bis zu 21 Kilogramm. Dabei wird die intakte SMN1-DNA über einen adenoassoziierten viralen Vektor einmalig intravenös verabreicht. Seit 2021 ist auch das Small Molecule Risdiplam in Europa verfügbar, das wie Nusinersen das Spleißen der inkompletten Information des SMN2-Gens modifiziert und für alle Altersgruppen sowie Schweregrade der Erkrankung zugelassen ist. Es muss täglich oral eingenommen werden. Die Zulassungsstudien und Veröffentlichungen mit Real-Life-Daten konnten für diese 3 Medikamente eine hervorragende Wirksamkeit bei gutem Nutzen-Risiko-Verhältnis beweisen und zeigten, dass ein früher und am besten präsymptomatischer Beginn der Therapie eine grundlegende Prognoseänderung und bestenfalls Heilung bedeutet.
Neugeborenen-Screening
Daher wurde das österreichische Neugeborenen-Screening-Programm 2021 um SMA erweitert. Bereits 34 Patient:innen konnten so präsymptomatisch detektiert und einer Therapie zugeführt werden. Die seit 2007 publizierten Standards of Care stellen weiterhin als Versorgungsrichtlinien die Basis für eine optimale Patientenbetreuung hinsichtlich Langzeitmanagement und interdisziplinärer symptomatischer Therapie dar.