Kann man chronische Pouchitis behandeln?
Indikationen für Pouch
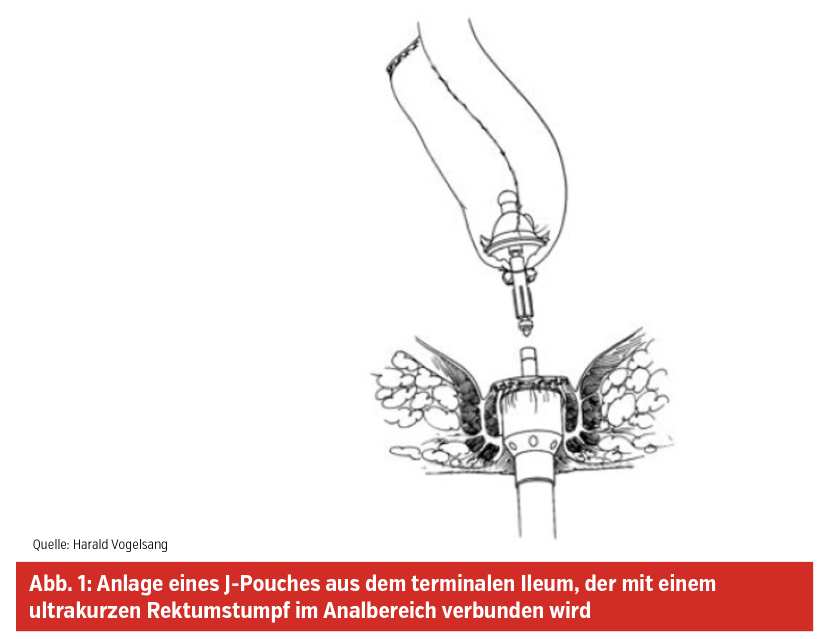
Bei einer therapieresistenten Colitis ulcerosa, bei Colitis ulcerosa mit Dysplasien oder bei familiärer adenomatöser Polyposis coli bleibt nur die Möglichkeit einer totalen Dickdarmentfernung (Proktokolektomie) mit Anlage eines Dünndarmreservoirs (Pouches), der mit einem sehr kurzen Rektumstumpf im Anus-Schließmuskel-Bereich anastomosiert (angeschlossen) wird (Abb. 1).
Allerdings entwickelt sich in 30 % der Fälle in diesem Pouch leider in den ersten postoperativen Jahren eine akute Pouchitis. Langfristig steigt dieses Risiko sogar auf über 50 %.
Wie wird nun die Diagnose Pouchitis gestellt?
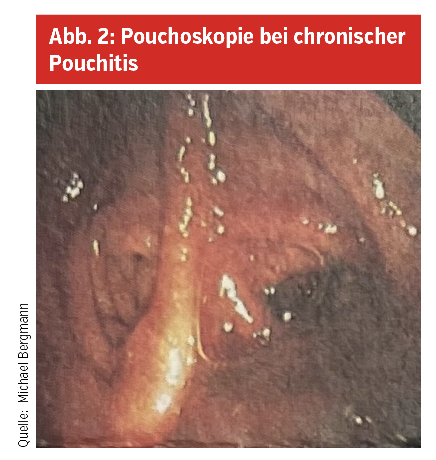
Blutige Durchfälle (mehr als 6/Tag – höhere Stuhlfrequenzen sind allerdings nach Dickdarmentfernung nicht zu vermeiden), Schmerzen oder Fieber deuten auf eine Pouchitis hin. Die endgültige Diagnose wird, wie bei der Colitis ulcerosa selbst auch, durch die Koloskopie, in diesem Fall „Pouchoskopie“ (diese ist ähnlich einer Rektoskopie) gestellt, wobei Biopsien hier wichtige Informationen zur Natur und Ursache bringen können. Zum Ausschluss insbesondere einer Clostridium-difficile-Toxin-Bildner-Besiedelung sind Stuhlkulturen zu empfehlen, speziell nach Steroidgaben. Es finden sich hier Rötungen, Schrunden (Erosionen), Geschwüre (Ulzera), Einblutungen, Fibrinauflagerungen bzw. unter dem Mikroskop sogenannte Kryptenabszesse, Ulzera und viele Entzündungszellen. Im Blutbild findet man abgesehen von einem Eisenmangel kaum Veränderungen, allerdings ist das Calprotectin im Stuhl hoch (ersten Stuhl des Tages zur Analyse bringen!).
Die primäre Standardbehandlung besteht in einer Mono- oder Kombinationstherapie mit Ciprofloxacin (1 g/d) bzw. Metronidazol (20 mg/kg/d) für 2 Wochen. Danach können Metronidazol rektal oder Budesonid (oral oder) lokal versucht werden. Bei Fehlen von entzündlichen Veränderungen in der Endoskopie ist jedoch an ein irritables Pouchsyndrom zu denken. Dies ist ähnlich einem Reizdarmsyndrom und ist von erhöhter Stuhlfrequenz und Bauchschmerzen gekennzeichnet.
Wann spricht man von einer chronischen Pouchitis?
Das Risiko für eine chronische Pouchitis liegt nach 4 Jahren bei 40 %. Risikofaktoren für eine Pouchitis sind chronisch hohe Entzündungsaktivität präoperativ, NSAR (non-steroidale Antirheumatika), eine „Backwash-Ileitis“, extraintestinale Manifestationen der CU und eine primär sklerosierende Cholangitis. Eine längere und häufigere Therapie mit den obengenannten Antibiotika kann zu verschiedenen Nebenwirkungen (Sehnenprobleme, Übelkeit, Polyneuropathie …) führen, weshalb diese gegen den möglichen Benefit abgewogen werden sollten. Kann die akute Pouchitis medikamentös (meist Antibiotika) innerhalb von 3 Monaten nicht abgeheilt werden, besteht eine chronische Pouchitis mit hohen Stuhlfrequenzen. Bei all diesen Problemen mit Urgenz und Diarrhö hat natürlich die gute Funktion des analen Schließmuskels eine hohe Wertigkeit, die deshalb schon präoperativ abgeklärt und sichergestellt werden sollte, da sonst eher ein Ileostoma von Vorteil sein könnte. Es müssen hier auch Komplikationen der Operation (Fisteln, Anastomoseninsuffizienz), M. Crohn (Histologie!) und eine Infektion (Biopsie für CMV, Stuhlkulturen) ausgeschlossen werden.
Wie kann man nun eine chronische Pouchitis gut behandeln?
Die einzige Therapie, die einen einwandfreien Nachweis in einer placebokontrollierten Studie erbracht hat, ist Vedolizumab i. v. mit einer Remissionsrate von 31 % nach 14 Wochen. Natürlich sind auch alle anderen immunsuppressiven Therapien und insbesondere Biologikatherapien wie z. B. mit Anti-TNF-Antikörper, Ustekinumab, Tacrolimus oder JAK-Inhibitoren möglich. Die besten Daten aus nichtrandomisierten Studien liegen für Infliximab mit Ansprechraten > 80 % vor.Eine andere Strategie bei der antibiotikaresponsiven rezidivierenden Pouchitis ist eine Kombinationstherapie mit Ciprofloxacin und Metronidazol über 2–4 Wochen und danach eine Rezidivprophylaxe-Therapie mit dem Probiotikum VSL # 3 (ein Probiotikum mit 6 verschiedenen Bakterien), das eine Remission bei über 80 % der Patient:innen über 12 Monate erhalten konnte. Da eine Dysbiose im Pouch sehr wahrscheinlich ursächlich für die wiederkehrende Entzündung ist und kaum Nebenwirkungen zu befürchten sind, ist dieses Rezidivprophylaxe-Konzept sehr attraktiv. Stuhltransplantationen waren in Studien bisher nicht erfolgreich. Auch Diätempfehlungen gibt es kaum, obwohl eine ballaststoffreiche Diät bei Fehlen des Kolons nicht sinnvoll erscheint. Eine 4-wöchige alleinige Elementardiät erbrachte zumindest eine Besserung der Symptome und damit auch eine Änderung des Mikrobioms im Pouch.
Wie sollte die Überwachungsstrategie bei einer Pouchitis aussehen?
Obwohl das Pouchkarzinom sehr selten ist, werden alle 1–2 Jahre Endoskopien empfohlen, insbesondere wenn ein kolorektales Karzinom in der Anamnese bestand. Durch die chronische Symptomatik ist aber meist auch ein Bedarf zur Diagnostik mit Histologie gegeben.
Wissenswertes für die Praxis
Die primäre Therapie der Pouchitis ist die Antibiotikatherapie mit Ciprofloxacin +/– Metronidazol. Vedolizumab i. v. hat in einer placebokontrollierten Studie zur Therapie der chronischen Pouchitis den Wirknachweis erbracht.